磷脂酸磷酸酶在酿酒酵母中的过表达及表型分析
张 昕 昱, 周 海 龙, 李 丽 丽, 李 宪 臻, 杨 帆
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.中国生物发酵产业协会, 北京 100833 )
0 引 言
多不饱和脂肪酸(PUFAs)是指碳链长度为18~22个碳原子并含有两个或两个以上顺式双键的直链脂肪酸[1]。PUFAs是人体所必需的营养物质,具有抗炎症、抗肿瘤、提高免疫力、调节血脂、预防心血管疾病等多种生理功能[2],对维持人类健康起着至关重要的作用[3]。然而,人体无法从头合成PUFAs,需要通过从外界摄入PUFAs来维持正常的生理需求[4]。
目前,食用PUFAs主要来源于深海鱼类、微藻和植物种子[5-6]。但由于环境资源的限制以及油脂中PUFAs丰度较低,从生物中获取PUFAs无法满足目前的市场需求[7]。因此,亟须开发生产多不饱和脂肪酸的新来源。国内外研究者逐渐将目光放在借助代谢工程的手段改造单细胞微生物来生产多不饱和脂肪酸[8-9]。近年来,国内外研究人员相继通过对酿酒酵母进行代谢工程改造使其实现多不饱和脂肪酸的合成[10-11]。然而,由于底物分歧、中间产物竞争以及脂肪酸低耐受性等原因,已报道的酿酒酵母重组菌株均无法高水平生产多不饱和脂肪酸[12-13]。
磷脂酸磷酸酶(EC 3.1.3.4,PAP)是一类重要的去磷脂酸酶,通过其自身的去磷酸化活性来调节三酰甘油(TAG)合成途径中磷脂PA向二酰甘油(DAG)的转变[14]。有研究表明,磷脂酸磷酸酶的缺失会降低酿酒酵母细胞对外源脂肪酸的耐受性[15]。本实验克隆获得酿酒酵母磷脂酸磷酸酶的编码基因PAH1,构建PAH1的酿酒酵母过表达菌株,以期为理性改造酿酒酵母使能够耐受高浓度脂肪酸提供理论基础。
1 材料与方法
1.1 材 料
酿酒酵母S.cerevisiaeBY4741及表达载体pYX212,美国英杰生命技术有限公司(Invitrogen);大肠杆菌E.coliDH10B及pMD18-T Simple Vector,获赠于大连化学物理研究所赵宗保研究员课题组。PrimeSTAR HS DNA Polymerase、250 bp DNA Marker、限制性内切酶,大连宝生物有限公司。
酵母发酵液体培养基YPD:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,pH 6.0;固体YPD培养基:琼脂粉15.0 g/L,其余同YPD液体培养基。产油培养基:葡萄糖100 g/L,酵母浸粉0.5 g/L,KH2PO44 g/L,MgSO4·7H2O 1.5 g/L,NH4Cl 0.25 g/L,痕量元素溶液1 000 μL每100 mL 培养基,pH 6.0。痕量元素溶液:CaCl2·H2O 4 g/L,FeSO4·7H2O 0.55 g/L,水合柠檬酸0.52 g/L,ZnSO4·7H2O 0.1 g/L,MnSO4·H2O 0.076 g/L,硫酸180 mmol/L。LB液体培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L,pH 7.0;LB固体培养基:琼脂粉15.0 g/L,其余同LB液体培养基。
Eppendorf PCR仪、Eppendorf AG22331电击融合仪,德国艾本德股份有限公司。
1.2 方 法
1.2.1 引物设计
磷脂酸磷酸酶的编码基因PAH1的克隆及表达载体的构建所用引物均由大连宝生物有限公司合成。所使用的引物序列及功能如表1所示。

表1 引物序列及功能Tab.1 Sequences and functions of primers
1.2.2 磷脂酸磷酸酶的编码基因PAH1的克隆
取摇床培养24 h的酿酒酵母新鲜发酵菌液,于4 ℃、4 000 r/min离心收集菌体,提取基因组DNA并以之为模板进行磷脂酸磷酸酶的编码基因PAH1的扩增。基因扩增上游引物为PAH1-F,下游引物为PAH1-R。扩增产物用1%琼脂糖凝胶电泳检测,对扩增产物进行回收。将回收的PAH1基因片段通过TA克隆连接至pMD18-T Simple Vector构建质粒pT-PAH1并进行测序验证。
1.2.3 磷脂酸磷酸酶的编码基因PAH1表达载体的构建
以质粒pT-PAH1为模板,利用引入酶切位点的引物PAH1-F1和PAH1-R2进行带有酶切位点的编码基因的扩增。将回收后的扩增产物和质粒pYX212进行双酶切,将回收的酶切片段与质粒按照浓度比1∶3进行16 ℃连接过夜,转化至E.coliDH5α感受态细胞中,涂布于含终浓度100 μg/mL氨苄西林的LB平板,挑选阳性克隆并测序验证。
1.2.4 过表达酿酒酵母菌株PAH1的构建
将鉴定正确表达质粒pYX-PAH1电击转化至S.cerevisiaeBY4741感受态细胞中,电压为1.5 kV。电击结束后,转化菌液于30 ℃温育2 h后将转化菌液涂布于筛选平板上,30 ℃培养至转化子出现。挑取阳性转化子提取质粒DNA并进行酶切鉴定。于37 ℃酶切反应2 h。鉴定正确的重组酿酒酵母命名为BY-PAH。
1.2.5 过表达酿酒酵母菌株PAH1油脂含量分析
将酿酒酵母重组菌BY-PAH接种于10 mL YPD培养基,于30 ℃、200 r/min摇床中培养24 h。以接种量2%接于100 mL产油培养基(分别含有0.25和1 mmol/L C16:1以及0.1% Triton X-100),发酵72 h。8 000g离心5 min收集菌体,烘干、称重,计算干菌体质量。在干菌中加入4 mol/L盐酸4 mL,78 ℃消化1 h。每管消化液加入8 mL体积比1∶1的氯仿-甲醇溶剂,30 ℃ 振荡混匀2 h;8 000g离心5 min,抽取下层有机相,加入8 mL 0.1%氯化钠,振荡混匀后8 000g离心5 min,抽提下层有机相采用旋转蒸发仪进行油脂收集,称重,计算细胞油脂含量。以油脂质量/菌体干重(g/g)表示油脂含量。
2 结果与讨论
2.1 磷脂酸磷酸酶编码基因PAH1的克隆
以酿酒酵母基因组DNA为模板,PCR扩增磷脂酸磷酸酶的编码基因PAH1,琼脂糖凝胶电泳结果如图1所示。在2.5 kb附近扩增出一条特异性条带,大小与磷脂酸磷酸酶的基因片段一致。将回收的PCR产物送至上海生工测序,测序结果如图2所示。经NCBI数据库比对,证明为磷脂酸磷酸酶的编码基因,大小为2 589 bp,PAH1基因编码的磷脂酸磷酸酶含有862个氨基酸残基,理论分子质量为95 029 u。该磷酸酶催化结构域(灰色部分)隶属于SMP2家族。

M,DNA marker; PAH1,目的条带
图1 PCR扩增磷脂酸磷酸酶基因的电泳验证结果
Fig.1 The electrophoresis results ofPAH1 coding gene fragment
2.2 PAH1表达载体及菌株的构建
为了构建酿酒酵母磷脂酸磷酸酶编码基因PAH1的表达载体,利用酶切连接策略将PAH1基因连接到表达载体pYX212上,连接产物转化至E.coliDH10B感受态细胞中。挑取阳性克隆进行质粒提取。对提取的质粒进行EcoR Ⅰ和Hind Ⅲ酶切验证。如图3所示,重组质粒经酶切后显示有大小为2 329、2 784、5 826 bp 3条特异性条带,与预测正确重组质粒的酶切结果基本一致。将酶切鉴定正确的质粒送上海生工测序,结果表明,成功构建了磷脂酸磷酸酶表达载体pYX-PAH1。

催化结构域用灰色突出显示,“*”代表磷酸化修饰位点,黑色突出部分和“·”代表底物结合位点图2 PAH1氨基酸序列测序结果分析Fig.2 Structural analysis of the amino acid sequence of PAH1
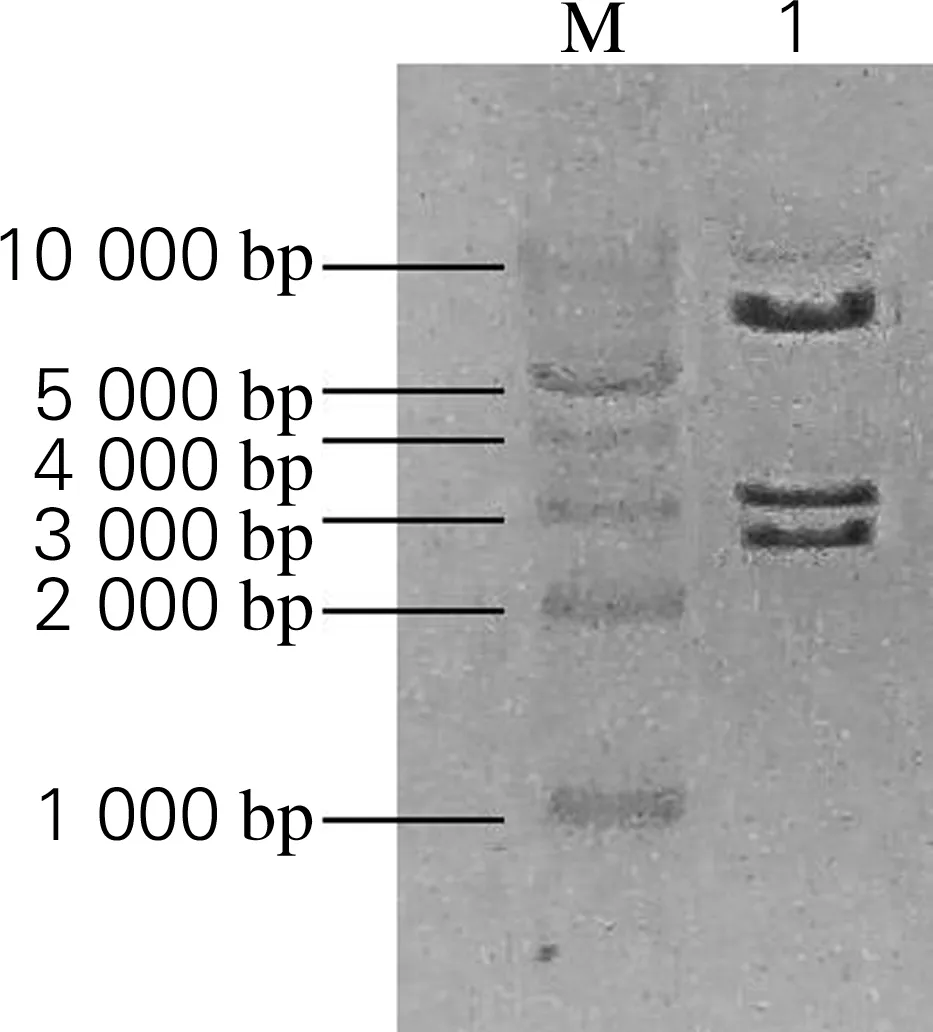
M,DNA marker;1,重组质粒酶切条带图3 重组质粒pYX-PAH1的酶切验证电泳图Fig.3 The electrophoresis results of the digested recombinant plasmid pYX-PAH1
将表达载体pYX-PAH1转化至S.cerevisiaeBY4741感受态细胞中,30 ℃静置培养,挑取阳性克隆提取重组质粒并进行PCR鉴定。电泳结果表明,扩增获得的DNA条带与理论PCR验证DNA产物大小基本一致。该结果表明成功构建了磷脂酸磷酸酶的酿酒酵母表达菌株BY-PAH。
将构建成功的表达菌株BY-PAH与带有质粒pYX212的酿酒酵母BY4741在同样的培养条件下发酵。对发酵所得菌体进行处理得到粗酶液。进行SDS-PAGE电泳分析,结果如图4所示。实验组与对照组相比,在90~117 ku有一个明显的特异性条带。PAH1蛋白的理论分子质量为95 029 u,而酿酒酵母会对蛋白进行翻译后修饰,所以PAH1蛋白的实际分子质量会偏高。该结果表明重组菌株BY-PAH成功表达了PAH1。
2.3 过表达磷脂酸磷酸酶的酿酒酵母重组菌株产油能力分析
将过表达磷脂酸磷酸酶的酿酒酵母重组菌BY-PAH先接种于YPD培养基中,30 ℃、200 r/min的条件下培养24 h,以2%的接种量于100 mL产油发酵培养基中,30 ℃、200 r/min的条件下发酵72 h,发酵结束后对胞内油脂含量进行测定。如表2所示,与对照菌株相比,过表达磷脂酸磷酸酶的酿酒酵母重组菌的油脂质量分数提高了49%。该实验结果表明,磷脂酸磷酸酶的过表达有效加强了TAG合成途径中磷脂PA向DAG的转变。DAG是TAG合成的前体,因此磷脂酸磷酸酶高水平达标直接影响了TAG的合成,有助于酿酒酵母细胞内油脂的积累。

M,蛋白marker;1,对照组;2,实验组
图4 重组菌株BY-PAH蛋白表达的SDS-PAGE电泳图
Fig.4 SDS-PAGE electropherogram of protein expression in recombinant strain BY-PAH
表2 外加棕榈油酸对重组酿酒酵母BY-PAH胞内油脂质量分数的影响
Tab.2 Effect of palmitoleic acid on lipid accumulation ofS.cerevisiaerecombinant strain BY-PAH
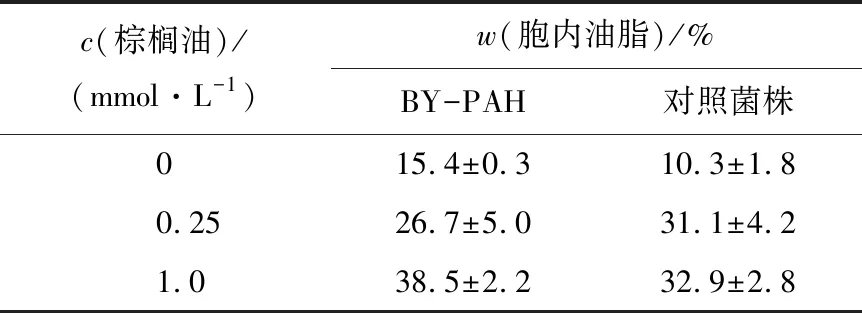
c(棕榈油)/(mmol·L-1)w(胞内油脂)/%BY-PAH对照菌株015.4±0.310.3±1.80.2526.7±5.031.1±4.21.038.5±2.232.9±2.8
2.4 过表达磷脂酸磷酸酶的酿酒酵母重组菌株脂肪酸耐受性分析
在产油培养基中培养24 h后分别添加0.25 和1 mmol/L的棕榈油酸及0.1% Triton X-100,于30 ℃、200 r/min条件下继续培养48 h,发酵终点对其进行胞内油脂含量的测定。
如表2所示,当棕榈油酸添加浓度为0.25 mmol/L 时,对照菌株BY4741和重组菌株BY-PAH的胞内油脂质量分数分别为31.1%和26.7%。当棕榈油酸添加浓度提高到1 mmol/L时,对照菌株BY4741和重组菌株BY-PAH的胞内油脂质量分数分别为32.9%和38.5%。表明培养基中棕榈油酸浓度的升高对对照菌株BY4741胞内油脂积累并无显著影响,而随着外加棕榈油酸浓度的增加,重组菌BY-PAH的胞内油脂含量随之增加。当外加棕榈油酸浓度为1 mmol/L 时,与对照组相比,重组菌积累了更多的油脂,说明磷脂酸磷酸酶通过其自身的去磷酸化活性能够将更多的脂肪酸整合到甘油三酯TAG上,使得酿酒酵母对脂肪酸有更高的耐受性。
3 结 论
以酿酒酵母为出发菌株,从中克隆出磷脂酸磷酸酶编码基因PAH1,并通过构建表达载体实现了酿酒酵母中PAH1的过表达。当重组菌限氮发酵72 h时,其胞内油脂含量与出发菌株BY4741相比有显著性提高。同时,通过在产油培养基中添加外源脂肪酸棕榈油酸,发现过表达磷脂酸磷酸酶的重组酿酒酵母胞内油脂含量显著提高。该结果表明磷脂酸磷酸酶通过将更多的脂肪酸整合到TAG上,使酿酒酵母获得较高的脂肪酸耐受性。本工作所取得的研究结果为今后理性改造酿酒酵母、构建高产多不饱和脂肪酸工业化菌株打下基础。
——一道江苏高考题的奥秘解读和拓展

