重组大肠杆菌全细胞催化合成β-丙氨酸
张 波 琨, 范 超, 洪 皓, 刘 军, 张 春 枝
( 1.大连工业大学# 生物工程学院, 辽宁 大连 116034; 2.大连医诺生物股份有限公司, 辽宁 大连 116600 )
0 引 言
β-丙氨酸(β-alanine)又名3-氨基丙酸,是自然界中唯一存在的β型氨基酸,是一种非蛋白氨基酸[1]。近年来,对于β-丙氨酸及其衍生物的研究日渐成熟,同时其在医药、美容、食品、饲料、化工及环境等领域的应用也日益突出,市场需求量逐渐增加[2-4]。目前,国内外生产的β-Ala主要通过化学合成法和生物转化法,化学合成法所需设备复杂,成本高昂,生产条件多需高温高压或强酸强碱,产物纯化烦琐,并且严重污染环境。生物转化法制备β-丙氨酸因具有工艺简单、纯化方便、绿色无污染的特点,因而受到人们的日益关注。
L-天冬氨酸-α-脱羧酶(EC 4.1.1.11,panD)是泛酸合成途径中的关键酶,以丙酮酰基为催化活性中心,可以脱去L-天冬氨酸α位羧基生成β-丙氨酸,因此利用panD催化L-天冬氨酸,绿色工业化生产β-丙氨酸已成为可能[5]。目前已有多篇报道对L-天冬氨酸-α-脱羧酶进行了深入研究[6-8]。范雪萍等[9]以特基拉芽孢杆菌(Bacillustequilensis) panD 37的基因组为模板,成功在大肠杆菌中异源表达,在优化了培养条件后实现了高密度发酵。郝大伟[10]对其实验室构建的重组菌E.coliBL21(DE3)/pET28b(+)-panD进行了研究,在优化发酵条件和合成β-丙氨酸的转化条件后,将β-丙氨酸的产量提高至0.42 g/L。高宇[11]将来源于E.coli的天冬氨酸裂解酶和来源于谷氨酸棒杆菌(C.glutamicum)的L-天冬氨酸-α-脱羧酶偶联,以富马酸和氨为底物催化合成β-丙氨酸,最终β-丙氨酸的产量为7 g/L。以上方法均为在体外情况下使用酶液进行催化,虽然效果明显,但不仅要对细胞进行破碎,而且容易造成L-天冬氨酸-α-脱羧酶失活,同时工业化大批量破碎细胞成本较高,因此探索一种便捷有效的全细胞催化生产方法十分有必要。
以L-天冬氨酸为底物,采用全细胞催化生产β-丙氨酸。E.coliBL21(DE3)/pET22b(+)-panD因带有信号肽,可以将panD分泌至周质空间,相较于一般的全细胞反应,这种重组细胞所分泌的酶能够和底物进一步接触,有利于全细胞反应的进行。通过对催化反应的几个重要因素进行单因素研究,初步确立了产物合成的适宜条件,同时基于反应过程中pH上升的问题,采用流加底物的方式保持pH稳定,从而实现高效催化合成β-丙氨酸,提高了生产效率,为大规模、低成本、高效率生产β-丙氨酸提供了一条新途径。
1 材料与方法
1.1 材 料
1.1.1 菌种来源
重组菌E.coliBL21(DE3)/pET22b(+)-panD由本实验室构建。
1.1.2 试剂与仪器
蛋白胨、酵母浸粉,北京奥博星生物技术有限责任公司;氯化钠、正丁醇、冰醋酸、氢氧化钠、氨水,天津市科密欧化学试剂有限公司;IPTG,上海阿拉丁生化科技股份有限公司;氨苄西林(Amp),上海源叶生物科技有限公司;L-天冬氨酸、β-丙氨酸,张家港华昌药业有限公司;茚三酮,国药集团化学试剂有限公司;硫酸铜、无水乙醇,天津市大茂化学试剂厂。
1号新华滤纸,杭州沃华滤纸有限公司;微量进样器,上海高鸽工贸有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;V-1100D型紫外可见分光光度计,上海美谱达仪器有限公司。
1.1.3 培养基
LB培养基:蛋白胨1%,酵母浸粉0.5%,氯化钠1%,pH 7.5,121 ℃、20 min高压灭菌。
固体培养基:蛋白胨1%,酵母浸粉0.5%,氯化钠1%,琼脂2%,pH 7.5,121 ℃、20 min高压灭菌,灭菌后,加入Amp至终浓度100 μg/mL。
1.2 方 法
1.2.1 全细胞的培养及制备
种子培养:取-80 ℃甘油保藏的菌种,在含有Amp的LB平板上划线,于37 ℃下过夜活化培养,挑取单菌落至含有100 μg/mL Amp的LB液体培养基中(装液量为50 mL每250 mL发酵瓶),于37 ℃摇床180 r/min下过夜振荡培养。
扩大培养:按2%的接种量将种子液接于含有氨苄的LB液体培养基(装液量为200 mL每500 mL发酵瓶),37 ℃、180 r/min振荡培养至OD600为0.6左右时,加入诱导剂IPTG至终浓度为0.4 mmol/L,30 ℃、180 r/min诱导18 h。培养结束后于4 ℃、4 000 r/min离心10 min,获得的菌体用pH 6.5的50 mmol/L磷酸盐缓冲液悬浮洗涤2次,所得菌体即可用于全细胞催化实验。
1.2.2 全细胞反应体系的建立及催化条件的优化
10 mL反应体系:10 mL 60 g/L L-Asp溶液(pH 6.5)重悬100 mL湿细胞并转移至小锥形瓶中,37 ℃反应4 h后,取1 mL反应液加入100 μL 1 mol/L NaOH终止反应,10 000 r/min离心5 min,取上清液测定反应液中β-丙氨酸的含量。改变反应体系中的某一条件,同时保持其他条件不变,进行单因素试验,分别考察pH调节剂(氨水、氢氧化钠)、温度(30、37、40、50、60、70 ℃)、底物初始pH(5.0、6.0、6.5、7.0、8.0、9.0)、金属离子(Na+、Mg2+、Mg2+、Ca2+、Co2+)、辅酶添加量(0、0.05、0.10、0.15、0.20 mmol/L)、底物质量浓度(10、20、30、40、50、60、100、150、200 g/L)等7个因素对全细胞催化L-Asp生成β-Ala的影响。每个试验均重复3次。
1.2.3 β-丙氨酸分析测定方法
转化反应中β-丙氨酸含量采用纸层析-分光光度法[12]进行测定。展开剂为体积比4∶1∶1的正丁醇、冰醋酸和水,0.5%茚三酮,展开时间约5 h。层析结束后,将滤纸置于110 ℃烘箱中显色2 min,出现紫红色斑点即可。将样品点剪下,置于比色管中,加入洗脱液,洗脱液成分为体积比19∶1 的75%乙醇和0.2%硫酸铜水溶液,于30 ℃洗脱20 min。利用紫外可见分光光度计于510 nm处测定吸光度,计算样品中β-丙氨酸的含量。
1.2.4 底物流加工艺初探
按照“1.2.2”的优化条件,以初始底物质量浓度50 g/L开始反应,当pH升至8.0时,取1 mL反应液作为样品,并立即补充L-天冬氨酸,使pH始终维持在6.5左右。重复该操作,直至反应体系的pH不再发生变化。
1.2.5 数据处理
利用Microsoft Excel 2016软件处理,结果均为3次测定的(平均值±标准误差值)。
2 结果与分析
2.1 全细胞催化合成β-丙氨酸的条件优化
2.1.1 pH调节剂对转化反应的影响
分别考察了氢氧化钠和氨水作为pH调节剂对转化合成β-Ala的影响。由表1可知,随着反应时间的延长,氨水作为pH调节剂的优势愈加明显,6 h时氨水调节下β-Ala质量浓度是NaOH调节的1.3倍,故氨水更适合作为底物pH的调节剂。若反应中使用NaOH,其碱性较强,不易控制,参与反应时pH改变较快,还可能引入其他离子;而且NaOH有腐蚀性,同时会产生大量热,不利于工业生产,危险性较高。相比之下,氨水价格低廉,反应温和,在工业生产上具有很大的优势。
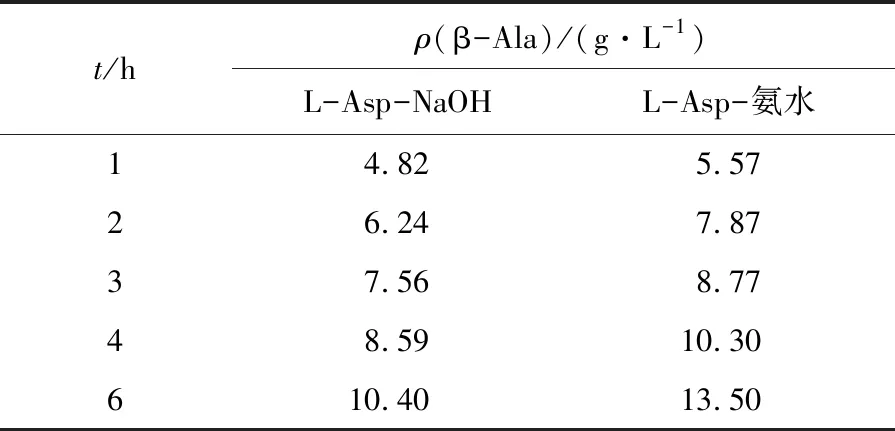
表1 pH调节剂对转化反应的影响Tab.1 Effects of pH regulators on biotransformation
2.1.2 温度对转化反应的影响
全细胞催化反应的本质是酶促反应,因此温度也是影响其催化效率的关键因素之一[13]。由表2可知,随着温度的升高,β-丙氨酸质量浓度呈现逐渐升高再降低的趋势。当温度到达60 ℃时,其浓度达到最大;当温度超过60 ℃,β-Ala质量浓度呈现下降趋势。原因可能是温度的升高增加了细胞膜的通透性,酶活性中心和底物结合的概率升高,合成的产物可以更快渗透到细胞外,但过高的温度会影响酶的活性,造成酶的变性和失活,使催化反应速率降低。因此,本实验选择60 ℃用于β-Ala 的合成,这也与邓思颖[14]报道的温度相符合。

表2 反应温度对转化反应的影响Tab.2 Effect of temperature on biotransformation
2.1.3 底物初始pH对转化反应的影响
L-天冬氨酸为酸性氨基酸,pI为2.77,微溶于水。由表3可以看出,随着pH的升高,β-丙氨酸质量浓度也不断增大,当底物初始pH为6.5时,β-丙氨酸质量浓度最大,而初始pH超过6.5后,β-丙氨酸产量明显减少,说明虽然pH升高有助于L-天冬氨酸溶解,但对酶活性的影响也不可忽视,因此选择底物初始pH为6.5最佳。

表3 底物初始pH对转化反应的影响Tab.3 Effect of initial pH on biotransformation
2.1.4 金属离子对转化反应的影响
金属离子在酶的催化反应过程中发挥着重要作用,其作用机制可能是使底物直接结合到酶的活性部位,或者通过可逆的改变金属离子的氧化态从而调节氧化还原反应,或者通过静电稳定及屏蔽负电荷等途径参与酶的催化[15]。在最佳优化条件下,选取Na+、Ca2+、Mg2+、Mn2+、Co2+5种金属离子,考察金属离子对全细胞催化L-天冬氨酸产生的影响,如图1所示。从图1中可以看出,添加了Na+、Ca2+、Co2+3种金属离子后,β-Ala 的质量浓度与对照组相比无明显差别,而Mg2+、Mn2+虽然有助于提高β-Ala产量,但相比于对照组仅提高了4.7%和7.6%,作用不明显。

图1 金属离子对转化反应的影响Fig.1 Effect of metal ions on biotransformation
2.1.5 辅酶添加量对转化反应的影响
磷酸吡哆醛可以参与氨基酸的转氨和脱酸反应,是氨基酸代谢过程的辅酶,在脱羧反应中添加PLP可以促进酶的催化速率[15]。通过添加不同浓度的PLP,考察辅酶对全细胞催化反应的影响。由图2可知,随着辅酶添加量的增加,β-Ala的质量浓度并没有发生明显的变化,推测可能5′-磷酸吡哆醛对L-天冬氨酸-α-脱羧酶的脱羧反应没有辅助作用或者5′-磷酸吡哆醛不是L-天冬氨酸-α-脱羧酶的辅酶,在催化过程中不需要添加。

图2 辅酶添加量对转化反应的影响Fig.2 Effect of coenzyme content on biotransformation
2.1.6 底物浓度对转化反应的影响
酶催化反应中,底物浓度对酶的活性不产生作用,而是影响酶促反应速率,高浓度的底物有利于增加酶与底物碰撞的概率,但底物浓度过高容易造成资源浪费。通过配制不同浓度的L-天冬氨酸溶液,考察底物浓度对全细胞催化过程的影响,如表4所示。

表4 底物质量浓度对转化反应的影响Tab.4 Effect of substrate concentration on biotransformation g/L
由表4可知,随着底物质量浓度的增加,β-Ala 产量也随之增加,当底物质量浓度为100 g/L时,β-Ala产量达到最高(20.6 g/L)。当L-Asp质量浓度继续增加,β-丙氨酸产量基本不变,甚至略有下降,说明底物质量浓度过高,对L-天冬氨酸-α-脱羧酶有一定的抑制作用,多余的底物没有充分利用,造成不必要的浪费。综合考虑,底物质量浓度为100 g/L较为合适。
通过全细胞催化条件的优化,得到优化条件:以氨水调节底物pH至6.5,温度60 ℃,底物质量浓度为100 g/L,不添加金属离子和辅酶,该条件下转化10 h后β-丙氨酸产量最大可以达到24.0 g/L。与优化前(氢氧化钠调节底物pH至6.5,底物质量浓度60 g/L,温度37 ℃,不添加金属离子和辅酶,转化4 h)相比,β-丙氨酸的产量增加了近3倍。
2.2 底物流加工艺初探
由于该转化反应是一个脱羧过程,L-天冬氨酸在L-天冬氨酸-α-脱羧酶的作用下,脱去羧基生成CO2和β-丙氨酸,同时底物中的氨水和释放的CO2发生化学反应,生成(NH4)2CO3和NH4HCO3,这两种盐均为弱酸弱碱盐,在水中发生水解和电离而呈碱性,综上导致pH不断升高。而文献中报道L-天冬氨酸-α-脱羧酶的最适pH通常在6.0~8.0,当pH过高时酶活受到抑制,由此,解决反应过程中pH的升高是问题解决的关键,可以通过在催化过程中不断流加底物L-Asp,既解决了pH的变化问题,又可以避免底物抑制,使反应能够持续进行。
从表5可以看出,因前期pH变化较快,底物质量浓度呈不断增加的趋势,β-丙氨酸质量浓度也随之增加,当转化7 h时底物质量浓度达到96.2 g/L,β-丙氨酸生成量达到最大(24.2 g/L),延长转化时间,pH不再变化,此时无须继续流加底物,产物生成量也基本保持不变。采用控制pH流加底物工艺,可以发现与最优催化结果相比,二者底物质量浓度接近,转化时间上前者仅用7 h就达到了相同的产物浓度。由此可见,流加底物控制pH工艺的方法可行,可以很大程度上缩短转化时间,提高β-Ala的生产效率,这在工业化生产中,能够避免因延长转化时间而增加的成本以及浪费的人力物力。

表5 底物流加催化合成结果Tab.5 The results of fed-batch enzymatic catalysis g/L
3 结 论
将重组细胞用于催化合成β-丙氨酸的研究中,确定最佳反应条件:氨水调节底物pH至 6.5,转化温度60 ℃,底物质量浓度100 g/L,该条件下转化10 h,β-丙氨酸的产量最大可以达到24.0 g/L。由于转化过程pH升高的影响,采用底物流加的方式控制pH在6.5左右,该条件下96.2 g/L的L-天冬氨酸仅转化7 h,就可以合成24.2 g/L的β-丙氨酸,生产效率提高了43%。采用全细胞催化合成β-丙氨酸,不仅操作简便,无须破碎细胞,酶的稳定性好,还减少了反应杂质,便于菌体使用后的回收利用以及β-丙氨酸的分离纯化,而本实验所采用的底物流加工艺更是在全细胞催化的基础上,能够让酶始终保持在最适反应条件,缩短转化时间,提高产物的生产效率,为工业上利用重组大肠杆菌细胞催化合成β-丙氨酸提供了一定的参考价值。

