精制南极磷虾油品质分析及其微囊化表征
张 晶, 宋 亮,2, 赵 泓 博, 刘 玉 欣,2, 赵 琪,2, 周 大 勇,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034; 2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
0 引 言
南极磷虾油富含磷脂型多不饱和脂肪酸,尤其是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),具有健脑益智、促进视力发育等功能[1]。有机溶剂法是工业上常用的南极磷虾油提取方法,但其制得的南极磷虾油杂质较多,酸价较高,且高于国家现有食用油及鱼油的酸价标准。此外,南极磷虾油腥味较重,所含磷脂遇水膨胀,这些都限制了其在食品领域的应用[2]。
本实验以干燥粉碎研磨后的南极磷虾粉为原料,采用有机溶剂法提取南极磷虾油,经食品级硅酸钠吸附脱酸[3]、溴化钾脱除不皂化物[4]、低温沉降去除不溶性杂质[5],制得精制南极磷虾油。将精制的南极磷虾油经高速剪切乳化、高压均质成稳定的南极磷虾油乳液,再将乳化液经喷雾干燥制得南极磷虾油微胶囊。对精制南极磷虾油及其微胶囊的品质进行分析,旨在为其在食品领域的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
南极磷虾,大连辽渔集团有限公司;将南极磷虾冷冻干燥、粉碎,冻干粉置于-20 ℃备用。正己烷、硅酸钠、酪蛋白酸钠、脱盐乳清蛋白、单甘酯均为食品级,溴化钾为光谱纯,正己烷、甲醇为色谱级;其他试剂均为分析纯。
1.2 仪器与设备
MK-6s棒状薄层色谱仪,日本雅特隆公司;Agilent 7890A气相色谱质谱联用仪,美国Agilent 公司;T-25型匀浆机,德国IKA集团;PandaPLUS 2000高压均质机,意大利GEA公司;SU-8010型冷场发射电子扫描显微镜,日本日立集团;Mastersizer 2000激光粒度仪,英国马尔文集团;u-SC差示扫描量热仪,法国赛塔拉姆公司;SP8激光共聚焦显微镜,德国徕卡公司。AFM5500M原子力显微镜,日本日立集团;Frontier 型傅里叶变换红外光谱仪,PerkinElmer;YC-1800低温喷雾干燥机,上海雅程仪器设备有限公司。
1.3 方 法
1.3.1 南极磷虾油的提取
采用张建润等[6]的方法提取南极磷虾油,得到的南极磷虾油充氮密封,-30 ℃保存备用。
1.3.2 南极磷虾油精制
称取10 g虾油,溶解于40 mL食品级正己烷,加入质量比5∶2的硅酸钠于40 ℃中等转速搅拌1 h,脱除游离脂肪酸;加入质量比10∶1的溴化钾于40 ℃下恒温摇动2 h,脱除不皂化物;低温(4±1) ℃沉降12 h,脱除不溶性杂质。处理后虾油经10 000 r/min离心10 min,上清液于40 ℃ 下真空浓缩,测定所得虾油的酸值、不皂化物以及不溶性杂质质量分数。
1.3.3 精制南极磷虾油理化指标、脂质组成、脂肪酸组成及其相对含量检测
采用GB/T 5530—2005热乙醇法测定南极磷虾油的酸值;采用GB/T 5535.2—2008己烷法测定不皂化物质量分数;采用GB/T 15688—2008测定不溶性杂质质量分数;采用GB/T 5532—2008测定碘值;采用GB/T 5009.37—2003第二法比色法测定过氧化值。利用棒状薄层色谱分析仪(TLC-FID)检测油脂中的脂质组成[7]。采用张建润等[6]的方法检测并分析精制南极磷虾油的脂肪酸组成及其相对含量。
1.3.4 精制南极磷虾油微胶囊制备
称取37.00 g酪蛋白酸钠和42.75 g脱盐乳清粉溶解于150 mL去离子水中,在40 ℃下搅拌30 min,将所得溶液与20 g南极磷虾油和0.25 g单甘酯充分混匀,经高速剪切(10 000 r/min,10 min)后,在高压均质机下均质3次,均质压力为600 bar,形成稳定乳化液;将乳化液经喷雾干燥,进风温度130 ℃,出风温度90 ℃,速率设定为6 mL/min,制得南极磷虾油微胶囊。
1.3.5 精制南极磷虾油微胶囊粒径和Zeta电位检测
将南极磷虾油微胶囊溶于去离子水中,质量浓度0.05 mg/mL。将样品装入相应的样品池,在温度25 ℃、探测角90°进行检测[8]。每个样品重复实验3次。
1.3.6 精制南极磷虾油微胶囊微观形态观察
冷场发射高分辨扫描电镜(Cryo-SEM):取适量制备好的南极磷虾油微胶囊进行扫描电镜分析。在3 kV的加速电压下观察南极磷虾油微胶囊形态[9]。
原子力显微镜(AFM):取5 μL制备好的南极磷虾油微胶囊乳液滴在云母片上晾干,在PM模式下观察[10]。
激光共聚焦扫描显微镜(LCSM):经质量浓度为0.1 mg/mL尼罗红溶液(油脂-红色)和0.2 mg/mL FITC(蛋白-绿色)染料染色,染色过程为:取1 mL样品,加入50 μL FITC染料,加入50 μL尼罗红溶液,室温避光静置10 mini涂片,63×油镜观察,FITC激发波长为488 nm,尼罗红激发波长为543 nm[11]。
1.3.7 精制南极磷虾油微胶囊负载率和包封率检测
表面油质量测定:根据Deshmukh[12]的方法稍作修改,测定游离(表面)油的质量分数。采用有机溶剂直接萃取法测定粉末油脂的表面油,具体方法:将3 g微胶囊样品置于带螺旋盖的烧瓶中,加入27 mL石油醚以提取未微胶囊化的游离(表面)磷虾油。使用恒温振荡器在室温条件下进行提取,100 r/min振荡10 min。萃取后,使用滤纸过滤分散体并用10 mL石油醚洗涤螺旋盖的烧瓶和滤纸2次。收集含有游离(表面)油的滤液并在旋转蒸发仪下蒸干,干燥至恒重。通过重量分析测定游离(表面)油质量。
总油质量测定:根据Deshmukh[12]的方法稍作修改,测定总油质量分数。总油包括游离(表面)和微囊化油。为了分解南极磷虾油微胶囊,将1 g样品与15 mL HCl (4 mol/L)在恒温振荡器中在室温条件以200 r/min混合30 min。为了提取总油,加入30 mL石油醚。在恒温振荡器中以150 r/min提取12 h。萃取后,使用滤纸过滤分散体并用10 mL石油醚洗涤螺旋盖的烧瓶和滤纸2次。收集含有总油的滤液并在旋转蒸发仪下蒸干,干燥至恒重。通过重量分析测定总油质量。
分别计算南极磷虾油微胶囊负载效率(mg/g)和包封率(mg/g)[13]:
负载效率=(wt-wf)/w
(1)
包封率=(wt-wf)/wt
(2)
式中:wt为总油质量,g;wf为表面油质量,mg;w为微胶囊的质量,mg。
1.3.8 精制南极磷虾油微胶囊傅里叶变换红外光谱(FTIR)分析
采用KBr压片法,称取样品与KBr 1∶100的比例混合研细后于7.0×107Pa下压成透明薄片,以KBr空白压片作参比,装入压片于4 000~500 cm-1进行扫描,分辨率4 cm-1,扫描次数32,得到平均数据[14]。
1.3.9 精制南极磷虾油微胶囊差示扫描量热(DSC)分析
称取样品5~10 mg于铝制坩埚内,压紧用冲模密封放入量热池。以空铝锅作为空白对照,重复3次测定。设置升温程序:样品平衡2 min,从10 ℃逐渐升温加热至150 ℃,再逐渐冷却到10 ℃,升温和降温速率均为10 ℃/min[15]。
1.3.10 精制南极磷虾油微胶囊电子鼻风味图谱检测
电子鼻是由10个不同的金属氧化物传感器(表1)和识别分析软件组成的仪器[16]。称取南极磷虾油和微胶囊各1 g (精确至0.01 g),放入10 mL 顶空瓶中,加盖密封,载气为干燥洁净空气,气体体积流量80 mL/min,数据采集时间120 s,数据采集延迟时间300 s,手动顶空进样。每个样品做10次平行实验。

表1 电子鼻传感器性能Tab.1 Performance description of electronic nose sensor
1.3.11 精制南极磷虾油微胶囊热稳定性分析
将南极磷虾油微胶囊分别溶解在25、62、100 ℃ 去离子水中,质量浓度为0.05 mg/mL。水浴孵育30 min,冷却至室温。分别进行粒径、电位、微观形态等指标检测。
1.3.12 精制南极磷虾油微胶囊pH稳定性分析
将微胶囊粉溶解在62 ℃水中,质量浓度为0.05 mg/mL。样品通过加入0.01~2 mol/L HCl或NaOH调节pH至2~9,采用磁力搅拌器在500 r/min条件下连续搅拌1 h。分别进行粒径、电位等指标检测。
1.3.13 数据处理方法
实验数据均以(平均值±标准偏差)表示,并采用SPSS16.0软件对所得数据进行单因素方差分析,在P<0.05时认为有显著性差异。
2 结果与讨论
2.1 精制南极磷虾油品质
精制南极磷虾油品质分析结果见表2。理化指标分析可知,其酸值、不皂化物、不溶性杂质均符合水产行业标准中精制鱼油标准。对脂质组成分析可知,与Li[17]、Tandy[18]等的研究结果相比,本实验精制得到的南极磷虾油磷脂含量高,而游离脂肪酸含量低。脂肪酸组成及相对含量分析可知,与Ali-Nehari等[19]的研究结果相比,本实验精制得到的南极磷虾油营养品质显著提高。

表2 南极磷虾油精制后的理化指标Tab.2 Indicators of refined Antarctic krill oil %
2.2 精制南极磷虾油微胶囊的粒径及Zeta电位表征
由图1(a)可知,南极磷虾油微胶囊的粒径分布范围较窄,平均粒径为337.7 nm,本实验制得的磷虾油微胶囊粒径小易于人体胃肠道消化吸收。由图1(b)可知,南极磷虾油微胶囊带负电荷,且电位绝对值为37.5 mV,大于30 mV,而Zeta电位绝对值大于30 mV被认为是液滴聚集和聚结稳定性的指示值[20],因此,本实验制得的磷虾油微胶囊复水后,其乳液稳定性较好。
2.3 精制南极磷虾油微胶囊的微观形态观察
南极磷虾油微胶囊在Cryo-SEM下表面形态如图2所示。从图2(a)可以看出,磷虾油微胶囊呈圆球形,表面相对光滑,囊壁比较完整,分布较均匀,无聚集现象,表明南极磷虾油被封装到以脱盐乳清粉和酪蛋白酸钠为壁材的囊壳中。图2(b)原子力显微镜检测显示,南极磷虾油微胶囊呈圆球形,3D图分析表明,磷虾油微囊的囊壳具有一定硬度,经探针碰撞并未破坏微囊结构,表明南极磷虾油微胶囊具有良好的稳定性[21]。
2.4 精制南极磷虾油微胶囊的负载率和包封率测定
由公式(1)、(2)计算可知,本实验制得的南极磷虾油微胶囊负载率为(190.29±0.05) mg/g,包封率为(960.45±0.74) mg/g。Shi等[22]通过复凝聚法制备的南极磷虾油微囊的负载率为130 mg/g,包封率为800 mg/g,本实验制得的南极磷虾油微胶囊负载率相对较高,表明所选壁材对南极磷虾油具有很好的承载性能,使得磷虾油具有较长的持效性。包封效果较好,表明所选壁材适合用于包封磷虾油。结果表明,本实验制得的南极磷虾油微胶囊兼具速效性和持效性。

(a) 粒径
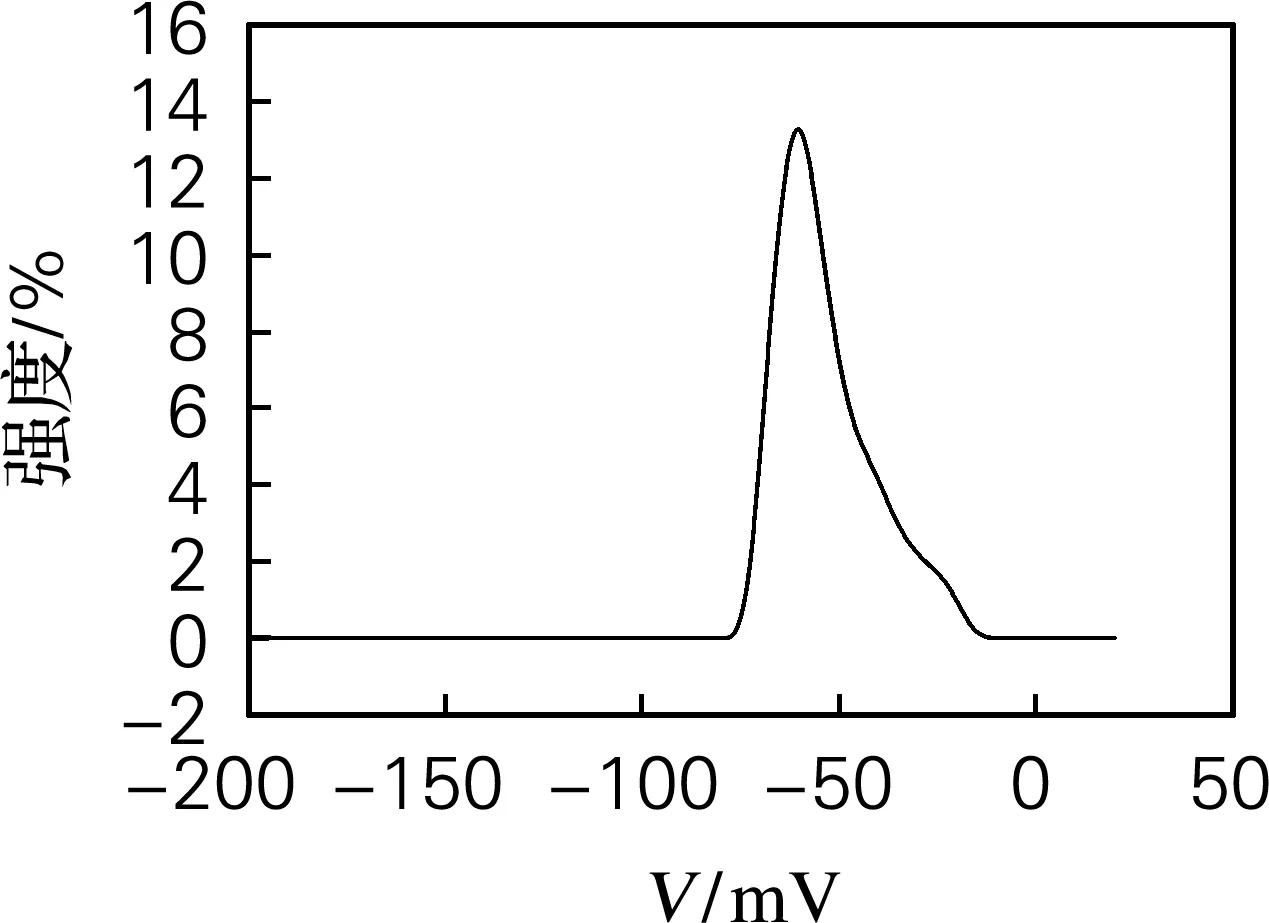
(b) Zeta电位
图1 南极磷虾油微胶囊粒径及Zeta电位
Fig.1 Particle size and Zeta potential of Antarctic krill oil microcapsules


(a) Cryo-SEM

(b) AFM
图2 南极磷虾油微胶囊微观形态
Fig.2 Microstructure of Antarctic krill oil microcapsules
2.5 精制南极磷虾油及其微胶囊的红外光谱分析


图3 南极磷虾油及其微胶囊傅里叶变换红外 光谱Fig.3 FTIR of Antarctic krill oil and its microcapsules
2.6 精制南极磷虾油微胶囊的差示扫描量热分析
如图4所示,南极磷虾油微胶囊在58 ℃前,曲线基本无变化,表明微胶囊仍处于玻璃态,性质较稳定;当温度超过58 ℃时,出现第一个吸热峰,峰值为74 ℃,即微胶囊的玻璃化转变温度[23]。此阶段反应为微胶囊壁材成分在高温下受热溶胀,有序晶体结构向无序晶体结构转变,发生吸热现象。随着温度的升高,在86 ℃出现第2个吸收峰,峰值为125 ℃,此阶段微胶囊成分开始发生热分解反应。结果表明,本实验制得的磷虾油微胶囊具有良好的温度耐受性,能满足一般食品加工的条件,并保证其结构完整[24]。

图4 南极磷虾油微胶囊差示扫描量热曲线Fig.4 DSC of Antarctic krill microcapsules
2.7 精制南极磷虾油及其微胶囊风味雷达图谱
如图5所示,南极磷虾油在传感器W1S响应值最大,为11.90;在W3S响应值最小,为0.10。而南极磷虾油微胶囊响应值最大为1.43。南极磷虾油在W1C、W5S、W1S、W1W、W2S、W2W响应值均显著大于南极磷虾油微胶囊,即南极磷虾油具有极性大的芳香成分气味。通过传感器雷达图可以直观地显示出南极磷虾油和南极磷虾油微胶囊风味在传感器上的响应差异[25]。结果表明,磷虾油经微胶囊化后,挥发性成分减少,特征风味减弱,明显改善了南极磷虾油产品的不良气味。
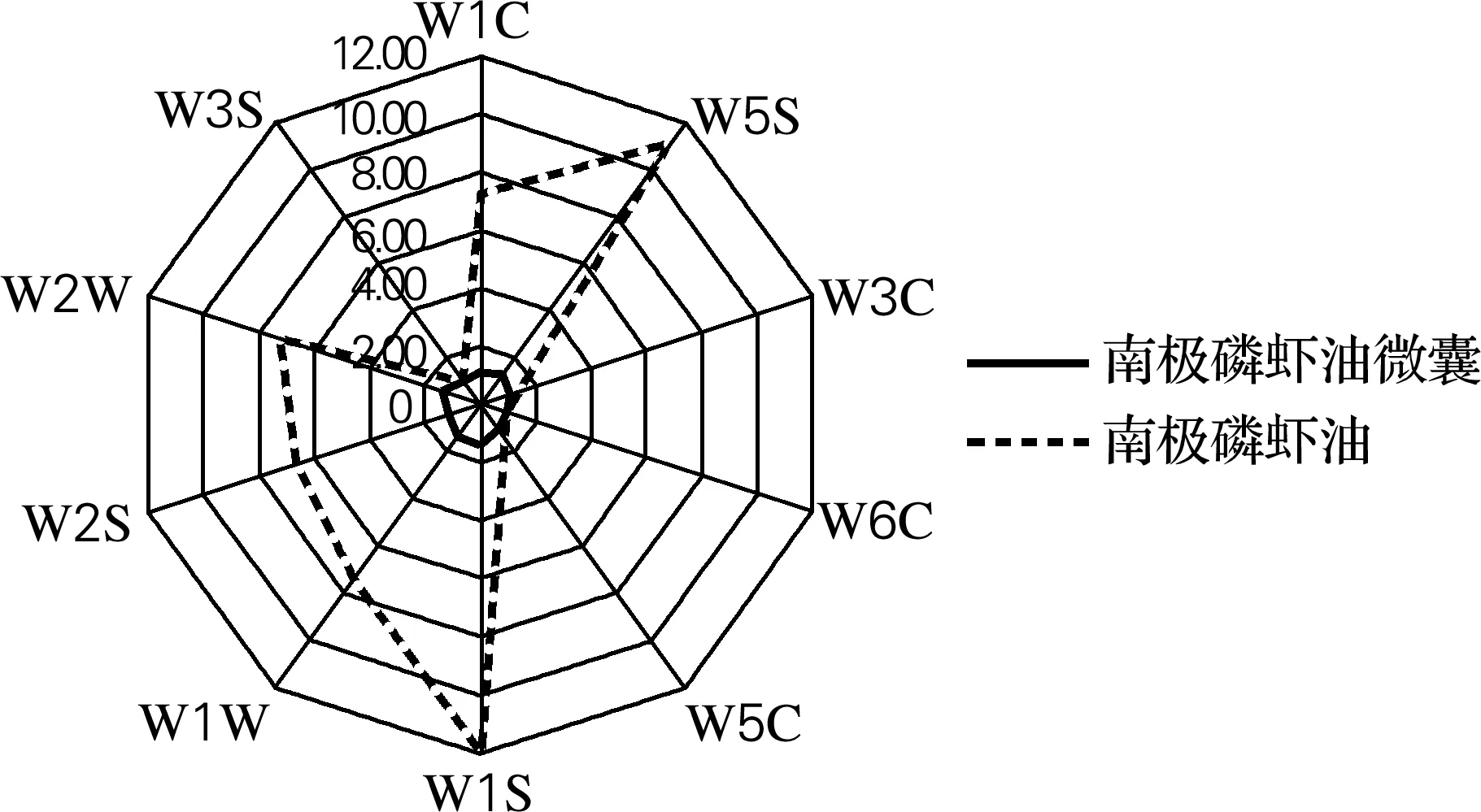
图5 南极磷虾油及其微胶囊传感器雷达响应图Fig.5 Sensor radar response of Antarctic krill oil and its microcapsules
2.8 精制南极磷虾油微胶囊热稳定性
由图6(a)可知,南极磷虾油微胶囊在25 ℃下呈球形,表面相对光滑,分布较均匀;在62 ℃条件下微囊仍保持完整,略有粘连现象;在100 ℃下观察到南极磷虾油微囊仍呈球形,粒径变大且分布不均匀。由图6(b)可知,在25 ℃下南极磷虾油微胶囊分布较均匀;在62 ℃条件下未有红色油滴出现,说明微囊仍保持完整;在100 ℃下其粒径变大,可能由于蛋白溶胀作用[26],但微囊的结构并未被破坏,未发现红色油滴破囊释放。
由表3可知,南极磷虾油微囊在62 ℃平均粒径变化不显著(P>0.05);在100 ℃下,平均粒径显著变大(P<0.05),与图6结果一致。Zeta电位绝对值在不同温度下均大于30 mV,表明微囊复水乳液均处于稳定状态。上述结果均表明,本实验制得的南极磷虾油微胶囊在较高温度下仍可保持稳定状态。
2.9 精制南极磷虾油微胶囊pH稳定性
由图7可知,当pH=2~3,南极磷虾油微胶囊复水乳液的平均粒径减小,复水乳液带有正电荷且Zeta电位变大;当pH=4,乳液出现相分离,有絮状沉淀,这可能由于此时pH接近酪蛋白酸钠的等电点,此结果与Khalid等[27]结果相似;当pH为5~9,复水乳液粒径保持相对稳定,Zeta电位逐渐变大且均大于30 mV。结果表明,南极磷虾油微胶囊化后,磷虾油具有良好的pH稳定性,对油脂有保护作用。

(a) Cryo-SEM

(b) LCSM
图6 不同温度下南极磷虾油微胶囊微观形态变化
Fig.6 Microstructure changes of Antarctic krill oil microcapsules at different temperatures
表3 不同温度下南极磷虾油微胶囊粉末平均粒径及Zeta电位变化
Tab.3 Mean particle size and zeta potential changes of Antarctic krill oil microcapsules at different temperatures

θ/℃d/nmV/mV25337.70a-37.50a62341.33a-41.86b100413.13b-46.33c注:不同小写字母表示具有显著性差异(P<0.05)。

图7 不同pH下南极磷虾油微胶囊的平均粒径和Zeta电位
Fig.7 The particle size and zeta potential changes of Antarctic krill oil microcapsules at different pH
3 结 论
采用硅酸钠吸附脱酸、溴化钾脱除不皂化物、低温沉降等方法去除不溶性杂质,制备得到了酸值(1.34±0.19) mg/g、不皂化物(0.65±0.05)%、不溶性杂质(0.04±0.01)%的精制南极磷虾油,其磷脂含量较高,游离脂肪酸含量较少。将精制南极磷虾油经喷雾干燥工艺,制备得到了负载率为(190.29±0.05) mg/g、包封率(960.45±0.74) mg/g的南极磷虾油微胶囊。经表征,微胶囊呈圆球形,表面相对光滑,囊壁比较完整,分布较均匀,无聚集现象,具有较高的耐受温度;微囊化后的南极磷虾油挥发性成分减少,磷虾油气味强度减弱,产品稳定性较好,可以达到保护油脂的目的,为在烘焙食品、固体饮料方面的应用奠定基础。

