白细胞介素-11对肿瘤促进作用的研究进展
潘德燊 ,李 登,邵 怡
1.上海交通大学附属第一人民医院泌尿外科,上海200080;2.上海交通大学附属第一人民医院临床医学院,上海200080
恶性肿瘤是危害人类健康的重要疾病之一。据统计,2018年全世界范围内约有1 810万恶性肿瘤新发病例和960万恶性肿瘤死亡病例[1]。在我国,2015年新发恶性肿瘤病例约392.9万,发病率为285.83/10万,恶性肿瘤死亡病例约233.8万,死亡率为170.05/10万,与历史数据相比,总体发病率和死亡率呈现上升趋势,癌症防治形势严峻[2]。
在肿瘤的发生发展过程中,细胞因子充当重要的信息传递者。作为细胞因子中的一员,白细胞介素-11(interleukin-11,IL-11)传统上被认为是一种抗炎因子,然而有研究[3]表明它也能表现出促炎特性,在肿瘤的发展中起到重要的作用。肿瘤微环境(tumor microenvironment)由肿瘤细胞和肿瘤间质组成,间质包括细胞外基质和肿瘤相关细胞如巨噬细胞、中性粒细胞、成纤维细胞等。最近研究表明,IL-11也能在肿瘤微环境中发挥重要的作用。本文主要就IL-11在肿瘤及其微环境中的作用及分子机制进行综述,并探讨IL-11在肿瘤的治疗和预后中的价值。
1 IL-11的来源及功能
IL-11最早于1990年从灵长类动物基质细胞系PU-34的培养上清液中分离得到[4]。后续的研究[5]发现,人IL-11基因序列位于染色体19q13.3-19q13.4带上,其长度为7 000 bp,由5个外显子和4个内含子组成。IL-11被认为有利于促进巨核细胞的成熟[4],临床上用于治疗血小板减少症。此外,IL-11还具有免疫调节活性[6],可以通过抑制核因子κB(nuclear factor κB,NF-κB)向细胞核的转运,从而减少单核细胞和巨噬细胞中促炎因子如IL-1β、IL-12、IL-6和肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)的产生,以及调节活化的CD4+T细胞产生细胞因子的能力,上调IL-4和IL-19,下调γ-干扰素(interferon γ,IFN-γ)和IL-12,最终发挥抑制炎症反应的作用。IL-11是IL-6细胞因子家族中的一员,该家族的共同特征是它们的受体均含有跨膜糖蛋白β受体亚基gp130,而这些细胞因子的不同生理性质则由α受体亚基决定。人IL-11受体α(interleukin-11 receptor α,IL-11Rα)定位于染色体9p13,其长度为10 000 bp,含有13个外显子[7]。IL-11结合IL-11Rα及gp130后启动信号转导,在不同部位发挥不同功能。最近研究[8]表明,IL-11也可激活不表达IL-11Rα的细胞,其机制为金属蛋白酶ADAM10(a disintegrin and metallopeptidase domain 10)切割IL-11Rα,释放可溶性IL-11R(soluble interleukin-11 receptor,sIL-11R),即IL-11R胞外域,与配体结合后,形成IL-11/sIL-11R复合物,继而激活表达gp130受体的细胞,发挥功能。
2 IL-11在肿瘤中的作用
IL-11在肿瘤的发生发展中发挥着重要的作用。任丽等[9]检测乳腺癌患者的外周血样本和肿瘤组织后发现,发生骨转移的患者与无骨转移的患者相比,其IL-11的表达水平更高,生存时间更短;表明高表达IL-11的乳腺癌可能更容易发生骨转移。Pan等[10]检测了193名肾透明细胞癌患者的肿瘤样本中IL-11的表达水平,发现IL-11表达与患者的复发风险呈正相关,与患者的生存率呈负相关,提示IL-11具有促进肿瘤进展的作用。研究表明IL-11受到转化生长因子-β/Smad蛋白(transforming growth factor-β/drosophila mothers against decapentaplegic protein,TGF-β/Smad)通路的调控,并可通过多种通路,包括Janus激酶/信号转导转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)通路等促进恶性肿瘤的增殖、侵袭和转移。
2.1 TGF-β/Smad通路
IL-11在肿瘤形成中受到TGF-β/Smad通路的调控(图1)。Kang等[11]选用人类乳腺癌细胞系MDA-MB-231中具有高转移活性的细胞亚群进行研究,发现IL-11在该细胞系中高表达,且在添加TGF-β后,表达水平进一步提高。其机制为TGF-β通过促进Smad2/3和Smad4与IL-11启动子结合,促进IL-11的转录;抑制Smad4的表达后,TGF-β对IL-11的诱导作用几乎完全被抑制[12]。IL-11响应TGF-β后其mRNA显著增加,并且这种作用可以被Smad7和TGF-β受体抑制剂SB431542所阻止[13]。Smad7作为一种抑制蛋白,可以与TGF-β受体结合,抑制TGF-β/Smad信号的细胞内转导。此外,Zhang等[14]发现转录因子Runx2(runt-related transcription factor 2)可以与Smad形成Runx2-Smad复合物增强TGF-β对IL-11的诱导作用,在晚期前列腺癌细胞中增加IL-11基因的表达,促进癌症相关的溶骨性骨病。在肝细胞癌中,TGF-β还可激活长链非编码RNA(long noncoding RNA,lncRNA)-ATB,后者竞争性结合miR-200家族上调ZEB1(zinc finger E-box-binding protein 1)和ZEB2,诱导EMT和侵袭;lncRNA-ATB还可结合IL-11mRNA增加后者的稳定性,从而促进IL-11的表达增加,诱发STAT3信号转导促进肿瘤细胞的远处转移[15]。
2.2 JAK/STAT通路
人们在结肠癌、胃癌、子宫内膜癌中均发现IL-11可通过激活JAK/STAT3信号转导途径促进肿瘤的发生发展。IL-11促进肿瘤进展的作用被认为与IL-6/JAK/STAT3信号转导途径相似。STAT3通过下游信号发挥促上皮间质转化(epithelial-mesenchymal transition,EMT)、促血管生成、促细胞增殖和逃避细胞凋亡的功能[3]。近来的研究表明,在人类胃肠道癌症中IL-11与STAT3活化水平的升高有更强的相关性。Putoczki等[16]使用氧化偶氮甲烷和葡聚糖硫酸钠诱导小鼠结肠炎相关结直肠癌模型,实验结果发现,与野生型小鼠相比,IL-6缺陷型小鼠发生结肠腺瘤的频率较低,而IL-11缺陷型小鼠、IL-6与IL-11均缺陷型小鼠几乎没有结肠肿瘤发生。他们还进一步使用表达gp130(Y757F)的纯合gp130F/F突变小鼠进行实验;gp130(Y757F)不能与gp130的负调节因子——细胞因子信号抑制物3(suppressor of cytokine signaling 3,SOCS3)相互作用,导致IL-6家族介导的STAT3活化增强。在gp130F/F突变小鼠中,通过敲除IL-11Rα1抑制IL-11的信号转导,并诱导结肠炎相关结直肠癌模型,结果发现STAT3的活化减少,肿瘤细胞的增殖生长和侵袭能力受到抑制。此外,Wu等[17]发现高迁移率族蛋白A2(high-mobility gene group A2,HMGA2)可以作为转录激活因子,结合纤维连接蛋白1(fibronectin 1,FN1)基因的启动子和IL-11的启动子,促进FN1基因和IL-11基因的转录,后者通过使STAT3磷酸化,促进EMT和结直肠癌转移(图1)。Buzzelli等[18]使用胃上皮细胞过表达IL-11(K19-IL11Tg)的转基因小鼠模型,发现IL-11可以促进STAT3过度活化并促进胃癌前病变,包括胃体的炎症、萎缩、肠上皮化生和上皮增生的发生。另外一项研究[19]发现,IL-11mRNA和活化的STAT3在幽门螺杆菌感染的胃炎中显著增加,提示IL-11的表达及STAT3的活化可能是幽门螺杆菌相关胃癌发生的潜在机制。在子宫内膜上皮癌细胞株Ishikawa和HEC1A中,IL-11Rα抗体可以显著降低细胞的增殖和侵袭活性[20]。
另有一项研究揭示了IL-11在缺氧环境中促进肿瘤发展的不同机制。Onnis等[21]研究发现,缺氧可诱导IL-11mRNA和蛋白质表达,其表达受到肿瘤抑制基因的调节并且至少部分依赖于缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)。HIF-1和激活蛋白1(activator protein 1,AP-1)形成转录复合物,可介导IL-11启动子的转录激活。低氧条件下诱导表达的IL-11通过自分泌方式作用于肿瘤细胞,引发p38和STAT1活化,导致肿瘤发生与发展(图1);而抑制IL-11的表达可显著消减缺氧对肿瘤细胞非贴附性生长的促进作用,并抑制异种移植模型中的肿瘤生长。然而,传统观点认为STAT1和STAT3分别具有抗癌和致癌活性。如在非小细胞肺癌的研究[22-23]中,IL-27和抑瘤素M(oncostatin-M,OSM)均通过活化STAT1来抵消甚至逆转与肿瘤细胞增殖、转移和血管生成相关的STAT3活化。因此在缺氧环境中,IL-11所介导的促癌作用有待进一步的研究。
除了与肿瘤的发生发展相关以外,Zhou等[24]发现,IL-11介导的JAK/STAT通路在肿瘤耐药形成中也发挥着重要的作用。在对卵巢癌使用抗肿瘤药铂剂进行化学治疗(化疗)的过程中,治疗失败常由铂耐药引起;而肿瘤耐药性的产生机制与铂剂诱导肿瘤细胞DNA损伤,产生活性氧(reactive oxygen species,ROS)有关,后者通过促进FOS相关抗原-1(FOS-related antigen 1,FRA1)表达,促进肿瘤细胞以自分泌方式分泌IL-11,激活JAK2/STAT5通路(图1)。IL-11的中和抗体可以抑制JAK2/STAT5通路,改善肿瘤对铂类药物的耐药性。这为进一步了解IL-11的功能以及为耐药性肿瘤的治疗提供思路。
2.3 PI3K/AKT通路
PI3K/AKT通路抗细胞凋亡和促增殖作用已在多发性骨髓瘤的细胞模型中得到充分证实[25]。有研究[26-27]表明,IL-11可以通过PI3K/AKT途径促进肿瘤进展和转移。Nakayama等[27]发现重组人IL-11(recombinant human interleukin-11,rhIL-11)通过激活PI3K/AKT途径促进人胃癌细胞系SCH的迁移,PI3K抑制剂wortmannin可降低rhIL-11对趋化性运动和侵袭性活性的促进作用。在甲状腺未分化癌中,缺氧通过激活HIF-1α促进IL-11表达,后者激活PI3K/AKT/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)途径诱导甲状腺未分化癌细胞的EMT,促进肿瘤细胞的侵袭与转移(图1);而敲低HIF-1α或IL-11,或使用PI3K/AKT抑制剂处理肿瘤细胞后,EMT现象以及肿瘤细胞侵袭转移的能力均下降[28]。
2.4 其他机制
LncRNA在肿瘤的发生、增殖与转移中发挥重要作用。Chen等[29]发现,与正常邻近组织相比,膀胱癌组织中lncRNA-DANCR表达上升;与无淋巴结转移肿瘤相比,发生淋巴结转移的肿瘤lncRNA-DANCR表达水平更高。进一步的研究表明,lncRNA-DANCR能与富含亮氨酸的三角状五肽重复结构蛋白(leucine-rich pentatricopeptide repeat containing,LRPPRC)发生相互作用,调节后者稳定细胞周期蛋白D1(cyclin D1,CCND1)、纤溶酶原激活剂尿激酶(plasminogen activator urokinase,PLAU)和IL-11的mRNA,从而使IL-11表达水平升高,并通过自分泌方式作用于肿瘤,通过JAK2/STAT3途径,促进膀胱癌的增殖与转移(图1)。而在胆囊癌患者中,lncRNAHEGBC在胆囊癌组织中表达上升,并与患者的不良预后相关;进一步研究表明,lncRNA-HEGBC定位于细胞核,与IL-11启动子结合促进其转录,后者使STAT3磷酸化,磷酸化的STAT3易位至细胞核,与lncRNA-HEGBC启动子结合促进其表达,从而形成正反馈通路,放大了正反馈环路中分子的表达以及STAT3介导的胆囊癌的发生和转移[30](图1)。
有研究[31-32]表明,肿瘤对放射治疗(放疗)、化疗的抵抗可能和IL-11的表达有关。Louria-Hayon等[31]发现,当造血干细胞和祖细胞(hematopoietic stem and progenitor cell,HSPC)发生衔接蛋白LNK缺陷时,比野生型HSPC更能抵抗辐射的伤害作用,并且这种抗辐射作用是白血病发生的基础。LNK蛋白可能通过其SH2结构域与JAK2和Src同源域酪氨酸磷酸酶2(Src homology domain tyrosine phosphatase 2,SHP2)上的相关酪氨酸磷酸化位点结合,抑制IL-11诱导的JAK2/STAT3和SHP2/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路活化,抑制辐射相关的B细胞恶性肿瘤的发展(图1)。当使用IL-11抗体注射LNK缺陷型小鼠后,与不注射IL-11抗体的对照组相比,其体内LNK缺陷型HSPC的抗辐射能力受到抑制[31]。另一项研究表明,IL-11的高表达促进了乳腺癌细胞对内分泌治疗的抵抗。miR-30c能负性调节肌动蛋白结合蛋白TWF1(twinfilin actin binding protein 1),后者可上调IL-11的mRNA和蛋白质水平的表达,因此miR-30c最终使得IL-11低表达,增加乳腺癌对化疗的敏感性;然而TWF1调节IL-11的具体机制还有待阐明[32]。
3 IL-11在肿瘤微环境中的作用
肿瘤微环境对于肿瘤生长的重要性逐渐被人们所重视。IL-11不仅在肿瘤细胞中以自分泌的方式发挥作用,还在肿瘤基质细胞和肿瘤细胞之间充当重要的媒介。在结直肠癌中,人们发现TGF-β刺激肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)分泌IL-11引发肿瘤细胞中的gp130/STAT3信号转导,并最终促进肿瘤的转移[33]。Wang等[34]也发现了类似的结果:当CAF与胃癌细胞共培养后,IL-11在CAF和胃癌细胞中的蛋白表达量均增加,同时促进胃癌细胞的侵袭转移;当IL-11抗体加入共培养系统后,这种作用被显著抑制。此外,在胃癌患者中CAF过量分泌的IL-11也通过JAK2/STAT3通路促进胃癌细胞的耐药[35]。另一篇文章阐述了IL-11促进肿瘤转移的不同机制。研究[36]表明,表达gp130(Y757F)的纯合gp130F/F突变小鼠和野生型小鼠相比,胃癌的黏膜下侵袭增加,IL-11的表达也同时增加,其机制可能是由IL-11水平升高而激发的基质金属蛋白酶9(matrix metalloproteinase,MMP-9)和MMP-13表达上升,导致细胞外基质降解,基质完整性受损,上皮细胞更易于侵袭黏膜下层和血管。其中MMP-13的表达只限于肿瘤基质,可见IL-11可以促使肿瘤基质产生MMP,从而促进肿瘤的侵袭转移。除了肿瘤基质释放细胞因子对肿瘤细胞发挥作用以外,肿瘤细胞也能反过来影响肿瘤基质中信息的传递。Wysoczynski等[37]研究发现,肺癌细胞可以分泌微泡(microvesicle,MV)并且在缺氧或者γ辐射时分泌增加,这些微泡刺激CAF和内皮细胞分泌包含IL-11在内的多种促血管生成因子,这种肿瘤微环境和肿瘤细胞的交互作用可能促进了肿瘤的发生发展(图1)。
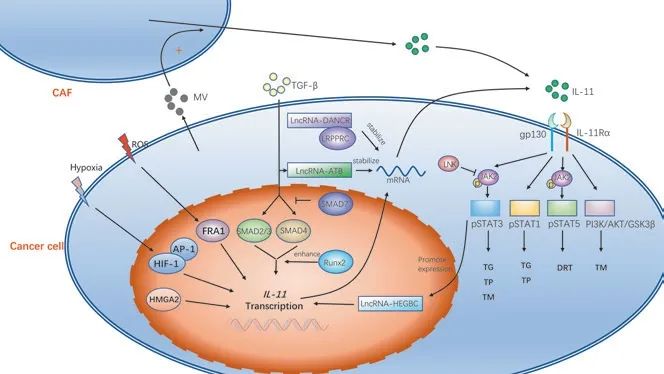
图1 IL-11促进肿瘤进展的相关通路Fig 1 Related pathways of IL-11 promoting tumor progression
4 IL-11在肿瘤治疗与预后中的价值
鉴于IL-11及其通路在肿瘤中的作用,靶向抑制IL-11及其下游信号通路IL-11Rα、gp130、JAK将成为抑制肿瘤进展的方法之一。其中靶向gp130可能抑制IL-6家族的其他细胞因子,因此抑制IL-11和IL-11Rα是抑制该信号通路的最直接方法。目前已有研究[16]表明,应用IL-11信号转导抑制剂IL-11突变蛋白(IL-11 mutein,mIL-11)可以降低胃癌的肿瘤负荷。此外,在新兴的嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CART-T)中,IL-11Rα也可以作为治疗的靶点:在小鼠模型体内注射IL-11Rα-CAR+T细胞可以使骨肉瘤肺转移消退[38]。然而这些成果应用于人体后是否有效还需要进一步的研究。IL-11在部分肿瘤患者的血液和肿瘤组织中显示高表达,且IL-11的高表达与预后不良有关,提示IL-11可以作为预后不良的独立预测因子[9-10,39],然而需要更多的临床样本观察来验证其应用价值。
5 结语与展望
IL-11受 到TGF-β/Smad通路的调控,或通过JAK/STAT通路、PI3K/AKT通路等参与肿瘤及其微环境的相互作用,促进肿瘤发生、增殖与转移。对于IL-11及其通路的研究有利于寻找抑制肿瘤发展的靶点,为治疗肿瘤提供新思路。当然,IL-11在肿瘤发展阶段的机制还需要更进一步的研究,以更好地了解IL-11在不同肿瘤中的差异及机制,为临床开发抗肿瘤药物提供依据。随着对肿瘤的了解加深,区分不同肿瘤亚型和患者亚群,可能使IL-11信号转导抑制剂能够更加精准和高效地治疗肿瘤。

