调强放射技术与切线野三维适形技术在乳腺癌保乳术后的应用价值
童 薇, 郑 杰, 沈学明, 雍 翔
(1.皖北煤电集团总医院,安徽 宿州 234011 2.蚌埠医学院第一附属医院放疗科,安徽 蚌埠 233004)
乳腺癌为女性群体多发恶性肿瘤疾病,针对早期患者,外科手术可取得良好效果,且为保证术后美观效果与生存质量,近年来保乳手术已成为疾病主要治疗措施[1]。研究指出,乳腺癌保乳术可避免全乳切除对女性造成的巨大心理打击,利于保证患者心理健康[2]。但保乳术后实施有效放疗治疗,不仅可提升局部肿瘤控制率,且可延长生存期限,是避免疾病复发、保证预后的重要因素[3]。传统乳腺癌放疗主要采取全乳两切线野照射,但其会造成乳腺靶区照射剂量分布不均,高剂量区多分布于臂丛组织、腋窝等乳腺外区域,易造成上肢水肿、皮肤溃疡等[4]。而调强放射技术及切线野三维适形技术均为临床重要放射治疗措施,可使等剂量曲线分布接近靶区,在提升肿瘤区照射剂量的同时,有效减少正常组织照射剂量[5]。但关于调强放射技术与切线野三维适形技术在乳腺癌保乳术后对患者整体治疗效果及miR-765、miR-21表达影响的研究较少,基于此,本研究选取我院乳腺癌保乳术后患者82例,探讨其治疗价值。报告如下。
1 资料与方法
1.1 一般资料:选取2017年11月至2019年11月我院乳腺癌保乳术后患者82例,依据简单随机数字表法将患者分为调强组与适形组,各41例。两组年龄、患侧、临床分期、病理类型、肿瘤位置、体质量指数(BMI)等基线资料比较无显著差异(P>0.05)。见表1。
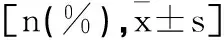
表1 两组一般资料比较
1.2 选取标准:纳入标准:①经手术病理检查确诊为乳腺癌;②临床分期为Ⅰ~Ⅱ期;③年龄<65岁;④均采取乳腺癌保乳术;⑤知晓本研究,签署同意书;⑥单侧发病。排除标准:①合并其他良恶性肿瘤疾病;②合并肾肝等脏器器质性病变;③合并心脑血管病变;④既往有恶性肿瘤病史;⑤纳入研究前1个月内发生感染;⑥免疫功能异常;⑦纳入研究前采取影响免疫功能的治疗。
1.3 方 法
1.3.1 治疗方法:设备选取Elekta Synergy型医用电子直线加速器,配套40对多叶准直器,治疗计划系统为Monaco;指导患者取平卧位,两臂交叉,以体膜进行固定,经Philips 64排大孔径CT机实施自由呼吸CT扫描,扫描范围:下颌至全胸廓,层厚:0.5cm,包括正常器官组织:食管、脊髓、双侧乳腺、心脏、双肺及甲状腺,于Monaco治疗计划系统工作站勾画皮肤轮廓及临床靶区体积(CTV)、食管、脊髓、心脏、健侧乳腺、双侧肺;CTV前侧界限内收至皮肤下0.3cm,以此为基础左右及后界各外扩0.2cm,上下各外扩1cm,后侧界限移至患侧肺外缘,获取计划靶区体积(PTV);肿瘤靶区处方剂量:50Gy/25 f,保证45Gy剂量分布能包绕患侧肺外缘,且健侧乳腺最大剂量应<500cGy,避免腋窝出现高剂量区;适形组采取切线野三维适形技术,采取Monaco治疗计划系统制作切线野三维适形治疗计划,肿瘤体积尽量控制于多叶准直器适形范围中,最大程度减少患侧肺受照射体积,并考虑患者呼吸所致轮廓起伏,适度调节两个射野权重及角度,处方剂量覆盖≥95%靶区体积;调强组采取调强放射技术,于切线野三维适形治疗计划基础上,Monaco计划系统把两个切线野作主野,降低腋窝区高剂量照射权重,减少靶区最大剂量,并减少靶区覆盖剂量,调强放射治疗在此基础上把靶区剂量<50 Gy区域导出,同时增加1~2个适当偏转角度小子野进行适形,拉动铅门包围该区域,避免大范围穿胸野,调节射野权重与加速器;若剂量分布不理想,则参照上述方式添加1~2个子野进行欠量区域适形,重复多次调节子野角度及射野权重,适度拖动多叶准直器叶片遮挡剂量热点区。
1.3.2 检测方法:抽取空腹静脉血4mL,离心处理(3000r/min,10min),经Trizol法提取血液样本内总mRNA,经分光光度仪A260 nm/280nm测定吸光度,若为1.8~2.2则为合格,实施下一步逆转录;TaqMan MicroRNA RT kit试剂盒逆转录反应:30 min 16℃、30 min 42℃、5 min 85℃,所生成cDNA放于-70℃环境中储存;实时荧光定量PCR仪采取TaqMan MicroRNA assay试剂盒实施扩增反应,以U6作内参,miR-765及miR-21反应体系如下:7.5ul H2O、1 ul20×SYBRI、0.5 ul PCR primer、1 ul cDNA、10 ul 2×Master mix;U6体系内去除PCR primer,增加H2O至8 ul,反应条件为60℃30 s、95℃15 s、95℃10 min(40个循环),溶解曲线1个循环,计算miR-765及miR-21相对表达量;经美国贝克曼Quanta SC流式细胞仪测定T细胞亚群指标(CD3+、CD4+、CD8+、CD4+/CD8+)。
1.4 观察指标:①统计两组全乳靶区剂量分布情况[适形指数(CI)、均匀性指数(HI)、平均剂量(Dmean)、最小剂量(Dmin)、最大剂量(Dmax)],CI值越大,适形度越好;HI值越小,靶区剂量均匀性越好。②统计两组全肺受量[平均剂量(Dmean)、全肺接受5 Gy剂量照射的体积百分比(V5)、V20]。③统计两组心脏受量(Dmean、V20、V40)。④统计两组治疗前后血清miR-765及miR-21相对表达量。⑤统计两组治疗前后T细胞亚群指标水平。⑥统计两组毒副反应发生情况。
2 结 果
2.1 全乳靶区剂量分布情况:调强组CI、Dmean高于适形组,HI、Dmax小于适形组(P<0.05),两组Dmin比较无显著差异(P>0.05)。见表2。
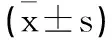
表2 两组全乳靶区剂量分布情况比较
2.2 全肺受量:调强组Dmean及V5小于适形组(P<0.05),两组V20比较无显著差异(P>0.05)。见表3。
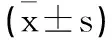
表3 两组全肺受量比较
2.3 心脏受量:调强组Dmean及V20、V40小于适形组(P<0.05)。见表4。
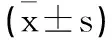
表4 两组心脏受量比较
2.4 miR-765及miR-21血清相对表达量:治疗前两组miR-765及miR-21血清相对表达量间无显著差异(P>0.05),治疗后两组miR-765血清相对表达量较治疗前增高,miR-21血清较治疗前降低,且调强组miR-765血清相对表达量高于适形组,miR-21血清低于适形组(P<0.05)。见表5。
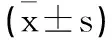
表5 两组miR-765及miR-21相对表达量比较
注:与本组治疗前比较,aP<0.05
2.5 T细胞亚群指标:治疗前两组CD3+、CD4+、CD8+、CD4+/CD8+间无显著差异(P>0.05),治疗后两组CD3+、CD4+、CD4+/CD8+较治疗前降低,CD8+较治疗前增高,但调强组CD3+、CD4+、CD4+/CD8+高于适形组,CD8+低于适形组(P<0.05)。见表6。
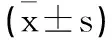
表6 两组T细胞亚群指标比较
注:与本组治疗前比较,aP<0.05
2.6 毒副反应:调强组放射性肺炎、放射性食管炎发生率与适形组间无显著差异(P>0.05),调强组骨髓抑制(29.27%)、急性皮肤反应(63.41%)发生率低于适形组(53.66%、82.93%)(P<0.05)。见表7。

表7 两组毒副反应比较n(%)
3 讨 论
乳腺癌保乳手术为疾病重要治疗措施,可减少手术创伤,保证乳房完整外形,因能满足患者对美观的需求而得到普遍应用。同时,为保证乳腺癌保乳术后预后效果、避免疾病复发,通常需实施放射治疗。相关研究表明,放射治疗为保乳治疗中重要组成部分,术后联合放射治疗相较于根治术,不仅能取得同等效果,且肿瘤局部控制率高,还可保留乳房外形[6]。
乳腺癌保乳术后放射治疗设计原则在于确保乳腺靶区所受剂量均匀、准确,并最大程度降低肺、心脏等正常器官组织受照射剂量及体积[7]。研究指出,全乳照射50 Gy后追加瘤床电子线补量10~16 Gy,可有效降低局部复发风险[8]。切线野三维适形技术在乳腺癌术后辅助治疗中较常用,但由于乳腺外形轮廓较复杂,且乳腺不同位置宽度存在差异性,其虽能达到治疗剂量,但靶区适形度是否较高、照射剂量是否会导致肺、心脏等正常器官组织剂量与体积超量仍存在一定争议。随放射治疗技术不断提升,调强放射治疗得到广泛应用,其不仅能显著改善靶区适形度与乳腺内照射剂量分布均匀性,且可极大程度减少周边正常组织器官照射剂量与体积,以此减少放射性损伤,降低放射性肺损伤等相关并发症发生率。国内外相关研究显示,乳腺癌保乳术后照射区域范围主要是自胸壁至弧形偏离机体中心的非规则靶区,常规放射治疗难以保证靶区剂量的均匀性及合理性,且会将胸壁内侧正常肺组织规划入照射范围,以致患侧肺遭受照射后,可直接造成肺损伤,影响疾病预后及患者生存质量,而调强放射技术治疗过程中,靶区各个点位输出剂量参照需求进行调节,靶区三维剂量布局合理性及适形性更高,可减少正常组织器官受照射剂量,保证治疗有效率及安全性[9]。李振淼等[10]研究结果显示,乳腺癌保乳术后患者采取X射线调强放疗后,其无瘤生存期明显延长,5年无瘤生存率高达98.55%。魏世鸿等[11]研究证实,左侧乳腺癌保乳术后应用调强放疗,在计划靶区照射剂量、处方剂量覆盖率及适形度等方面优于三维适形放疗,还可在一定程度上保护甲状腺功能。本研究分别采取切线野三维适形技术及调强放射技术对乳腺癌保乳术后患者进行治疗发现,调强组全乳靶区剂量、全肺受量、心脏受量优于适形组,且骨髓抑制、急性皮肤反应发生率低于适形组,表明相较于切线野三维适形技术,调强放射技术在保证计划靶区及周边正常器官组织照射剂量合理性、均匀性等方面更具显著优势,适形性、均匀性较高,并能减少相关并发症发生。分析原因可能在于:调强放射技术适用于肿瘤组织和周边重要正常器官组织交互错杂、使靶体积立体形态向内凹陷或不规则的情况,可使等剂量曲线和靶区形状基本一致,从而提升靶区照射剂量,减少正常组织照射剂量,避免相关并发症发生。
乳腺癌保乳术后放射治疗效果的评估不应仅局限于剂量学等优势,还可通过评估治疗前后免疫功能状态进行对应评定,主要是因放射治疗可对机体免疫功能产生负相损伤作用。而本研究中,治疗后两组T细胞亚群指标均较治疗前降低或增高,但调强组各指标水平优于适形组,提示调强放射技术还可减轻对乳腺癌保乳术后患者机体免疫功能造成的损伤,与其照射剂量合理性更高等具有密切相关性。此外,microRNA为非编码小分子RNA片段,保守性较高,可与靶基因mRNA相结合,于转录后调控靶基因表达情况,影响细胞生命活动内诸多信号转导途径,于细胞发育及增殖、凋亡等过程中具有重要作用,并能于肿瘤发病及进展中起到抑癌基因或促癌基因作用。Asia A等[12]研究表明,肿瘤细胞内microRNA能进入血液循环,并稳定分布于血清,具备耐RNA酶降解、长期保存等优势。miR-765表达可促进细胞凋亡,其潜在靶基因EMP3可能为肿瘤增殖及侵袭、转移的重要癌基因,于乳腺癌中具备抑癌基因功能。miR-21编码基因定位于染色体17q23.2,其在诸多恶性血液疾病、实体瘤中均呈高表达状态,miR-21过表达可增强乳腺癌转移潜能,于对应治疗后其表达情况可显著降低,故还可用于疗效及预后评估。本研究结果表明,治疗后调强组miR-765相对表达量高于适形组,miR-21低于适形组,提示调强放射技术不仅在剂量学方面优于切线野三维适形技术,且能调节miR-765、miR-21表达,进一步证实其应用价值更高,利于改善预后。
综上所述,采取调强放射技术治疗乳腺癌保乳术后患者效果优于切线野三维适形技术,可保证各区域照射剂量合理性,对患者免疫功能影响小,并能调节miR-765及miR-21相对表达,且可在一定程度上降低毒副反应发生风险,保证安全性。

