减肥胶囊对3T3-L1细胞增殖与分化的影响研究
金小琴,赵璐,孟长海
(1.河南中医药大学,河南 郑州;2.河南中医药大学第三附属医院,河南 郑州)
0 引言
肥胖是一种慢性代谢紊乱性疾病,一般认为是由于能量摄入和消耗失衡引起,且与遗传和环境因素相关[1]。随着社会的进步、人民生活水平的提高,肥胖的发病率逐年上升。肥胖不仅与2型糖尿病、高血压、心血管疾病及其他代谢性疾病有关,还参与肿瘤的生长、侵袭和转移等过程,是多种肿瘤预后不良因素[2]。另有研究表明肥胖与低程度的炎症、认知功能障碍、术后感染以及内皮功能障碍等相关[3-4]。肥胖已经成为严重影响人民生活质量的慢性疾病之一。世界卫生组织调查发现,2014年世界上已有超过19亿成年人(39%成年人)超重,有多于6亿的成年人(13%成年人)肥胖。2015年,中国居民营养与慢性病调查报告中显示,18岁及以上成人超重率为30.1%,肥胖率为11.9%[5]。大多数肥胖的治疗方法都着眼于减少能量摄入和体育锻炼。此外,另外一种替代治疗方法,即提高细胞的能量代谢,开始逐渐被人们所关注。然而,当前的证据表明,减轻体重的治疗措施由于治疗后会出现体重的快速回升,其治疗效果有着很大的限制。迄今为止,治疗肥胖的有效药物都伴有一些严重的副作用[6]。因此,寻找积极、有效、安全的治疗方法,具有最重要的理论依据和现实意义。
肥胖的根本原因是能量摄入和能量消耗之间不平衡,导致过度或异常的脂肪堆积。早期研究认为成体内脂肪细胞数量是恒定的,体积增大是脂肪细胞在肥胖时的主要病理变化[7]。近年来,脂肪细胞在成年人体内更替状况的研究表明,成人脂肪细胞存在每年约10%的更新[8],这提示成人脂肪组织中也存在前体细胞向成熟脂肪细胞的分化。脂肪的体积与脂肪细胞的数量和体积有关,脂肪细胞数量由前脂肪细胞的数量决定,同时还取决于前脂肪细胞向脂肪细胞分化的速率,脂肪细胞的体积取决于前脂肪细胞向脂肪细胞分化的程度。因此,抑制前脂肪细胞的增殖与分化可以减少脂肪组织质量,减少肥胖的发生[9]。
减肥胶囊是导师根据多年临床经验总结所得的有效方剂,前期研究证实减肥胶囊可降低患者体重指数(BMI)、腰臀围、空腹瘦素和胰岛素水平,结合饮食、运动治疗单纯性肥胖症(胃热湿阻证)效果良好[10]。减肥胶囊可通过对肥胖大鼠脂肪组织瘦素受体后JAK-STAT信号转录系统的影响来发挥减肥作用[11]。本研究将从分子层面进一步研究减肥胶囊通过抑制前脂肪细胞的增殖与分化的减肥机理。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞
3T3-L1细胞,购自上海中科院细胞库。
1.1.2 实验用药
生大黄10g、生何首乌12g、黄芩15g、泽泻15g、荷叶15g、生山楂15g,购于河南中医学院第一附属医院。将以上六味药制成水煎溶液,含生药1mg/mL。
1.2 所需主要试剂(盒)、耗材和仪器
1.2.1 所需试剂
DMEM培养基;无支原体胎牛血清(FBS);胰岛素(Insulin);地塞米松(Dexamethasone,D.x.m);3-异丁基-1-甲基-黄嘌呤(IBMX);四甲基偶氮噻唑蓝(MTT);PBS磷酸盐缓冲液;异丙醇;油红0染色剂;多聚甲醛;台盼蓝;二甲基亚砜(Dimethyl Sulfoxide,DMSO);胰蛋白酶;甲醛等。
1.2.2 所需耗材及仪器
电子计重称;低温高速离心机;电热恒温水浴锅;恒温CO2培养箱;生物洁净工作台。
倒置显微镜;低速台式大容量离心机;架盘药物天平;冰箱;液氮罐;75%医用酒精;96孔细胞培养板;25cm2细胞培养瓶;2.0mL细胞冻存管;孔径0.22um 25mm2一次性滤器;10ul、100ul、1000ul移液器;台式水浴恒温振荡器(TSHZ-A);EH型高压消毒锅;恒温烤箱;酶标仪等。
1.3 实验方法
1.3.1 减肥胶囊水溶性提取物的制备
将生大黄10g、黄芩12g、何首乌15g、泽泻15g、山楂15g、荷叶15g在800mL纯水中浸泡30min,药物在砂锅中煮沸30min,滤布过滤,再用800mL纯水煮沸30min,滤布过滤将两次药物溶液混合后4000n/min离心15min,取上清,弃沉淀;将药物水溶性提取物沸腾浓缩后放入蒸发皿中置于水浴锅上进一步浓缩成膏状,将蒸发皿置于小型真空干燥箱中干燥成干膏,计算出药物的出膏率,用粉粹机粉碎成粉末状,放入真空袋中备用。
1.3.2 减肥胶囊对3T3-L1前脂肪细胞增殖的影响
光镜下观察细胞分化进程减慢,进行油红“O”染色,观察形成脂肪颗粒的多少等。
1.3.3 减肥胶囊对3T3-L1前脂肪细胞分化的影响
3T3-L1前脂肪细胞在含10%胎牛血清的DMEM培养基中培养,当细胞融合后2天时,培养基换成诱导液1(DMEM+10%胎牛血清+0.5mmol/L M3-异丁基-1-甲基黄嘌呤+1umol/L地塞米松+10mg/L重组人胰岛素),48h后换成将培养基换成诱导液2(DMEM+10%胎牛 血清+10mg/L重组人胰岛素),48h后将培养基再换成含10%胎牛血清的DMEM培养基中,再培养四天。将细胞用PBS洗3次,用含10%福尔马林在室温下固定1h,用PBS洗3次,之后用油红O染色1h,即可在镜下观查细胞形态,拍照。用PBS洗3次,洗掉多余的油红O,用100%异丙醇萃取20min,在分光光度计490nm波长比色,记录A值。比较A值的差异反映药物对细胞分化的影响。分化程度与油滴大小、吸光度成正相关。根据公式计算抑制率。抑制率/%=(A对照组一A实验组)/A对照组×100%。
注:每次换液的同时加入0.1µg/mL、1µg/mL、10µg/mL、100µg/mL、1000µg/mL的药物,设3孔重复,同时设调零孔(不加细胞、药物)、对照孔(不加药物),板的周边用用PBS缓冲液填充。
1.4 统计学处理
2 结果
2.1 减肥胶囊水溶性提取物对3T3-L1前脂肪细胞增殖的影响
用含不同浓度药物的培养基作用于3T3-L1前脂肪细胞,分别在培养24h、48h、72h后用MTT比色法测定细胞增殖情况。显微镜下观察细胞,对照组细胞增殖旺盛, 0.1µg/mL药物组细胞增殖与对照组无明显差异,1µg/mL 药物组与对照组差异不明显,10µg/mL、100µg/mL、1000µg/mL药物组细胞增殖缓慢,部分细胞在2天后出现大部分凋亡。统计学分析,所有数据用(±s)表示,如表1。
表1 不同浓度药物对细胞增殖的影响

表1 不同浓度药物对细胞增殖的影响
注:与对照组比较,☆表示P<0.05,★表示P<0.01
组别 例数(n)剂量(ug/mL) 24h 48h 72h 1 3 0.1 0.94±0.07 1.55±0.13☆ 2.05±0.01★2 3 1 0.85±0.01★ 1.34±0.07★ 1.75±0.01★3 3 10 0.49±0.06★ 0.80±0.07★ 0.80±0.01★4 3 100 0.32±0.03★ 0.43±0.07★ 0.32±0.00★5 3 1000 0.16±0.06★ 0.21±0.10★ 0.21±0.01★6 3 0 0.95±0.06★ 1.58±0.02★ 2.31±0.01★
(1)药物作用24h后,0.1µg/mL药物组与对照组比较无统计学意义(P>0.05),与其他药物组比较均有显著统计学意义(P<0.01);其他药物组之间比较、与对照组比较均有显著统计学意义(P<0.01);(2)药物作用48h后,0.1µg/mL药物组与对照组比较有统计学意义(P<0.05),与其他药物组比较有显著统计学意义(P<0.01),其他药物组与各组比较均有显著统计学意义(P<0.01);(3)药物作用72h后,各药物组与对照组比较均有显著统计学意义(P<0.01),各药物组之间比较也有显著统计学意义(P<0.01)。
使用不同浓度药物处理后,随着时间和剂量的增加,药物对细胞增殖的抑制率升高,成有一定的时间-剂量依赖关系。如图2所示:

图2 药物对细胞增殖的抑制作用示意图
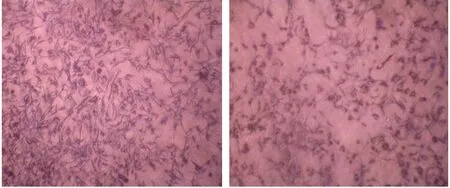
图3 药物作用前后细胞增殖图
2.2 减肥胶囊水溶性提取物对3T3-L1前脂肪细胞分化的影响
3T3-L1前脂肪细胞在诱导分化的第2天细胞体积开始变大,分化的第3天开始,细胞内可见散在的脂质小颗粒,随后脂肪颗粒开始增多、增大,细胞形态有原来的梭形变为椭圆形或圆形,到分化第8天,大部分细胞分化成熟,小脂肪滴融合为较大脂肪滴。
油红0是脂肪特异性染色剂,能与脂肪结合,使脂肪细胞中的脂滴着色,因此常用来染色分化成熟的脂肪细胞,以观察脂肪细胞中脂肪的含量。光镜下,3T3-L1前脂肪细胞形态与成纤维细胞相似,呈长梭型,细胞内没有脂肪积聚,油红O染色后细胞不着色。诱导分化后,细胞形态变圆,胞浆出现脂滴,随着分化程度的加深,脂滴积聚增多。
表2 不同浓度药物对细胞分化的影响

表2 不同浓度药物对细胞分化的影响
注:与对照组比较,☆表示P>0.05,★表示P<0.01
组别 1 2 3 4 5 6例数 3 3 3 3 3 3剂量(ug/mL) 0.1 1 10 100 1000 0±s 1.11±0.00☆ 0.94±0.00★ 0.80±0.01★ 0.50±0.01★ 0.10±0.00★ 1.12±0.00★
在显微镜下观察细胞分化,其中0.1µg/mL药物组对细胞分化影响与对照组比较不明显,1µg/mL、10µg/mL、 100µg/mL药物组与对照组比较细胞分化进程减慢,形成脂肪颗粒比对照组减少,1000µg/mL药物组脂肪细胞形态有所变但无脂肪颗粒分泌。所有数据用(±s)表示,如表2所示。
根据结果分析,1µg/mL、10µg/mL、100µg/mL、1000µg/mL 药物组对3T3-L1前脂肪细胞分化有显著影响,抑制率较高,有显著统计学意义(P<0.01);0.1µg/mL药物组对3T3-L1前脂肪细胞分化无明显影响,抑制率较低,结果无统计学意义(P>0.05)。
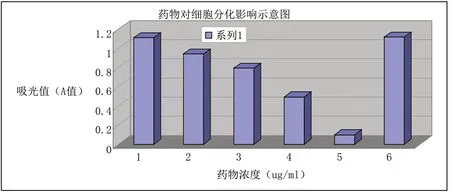
图4 不同浓度药物组对细胞分化影响示意图
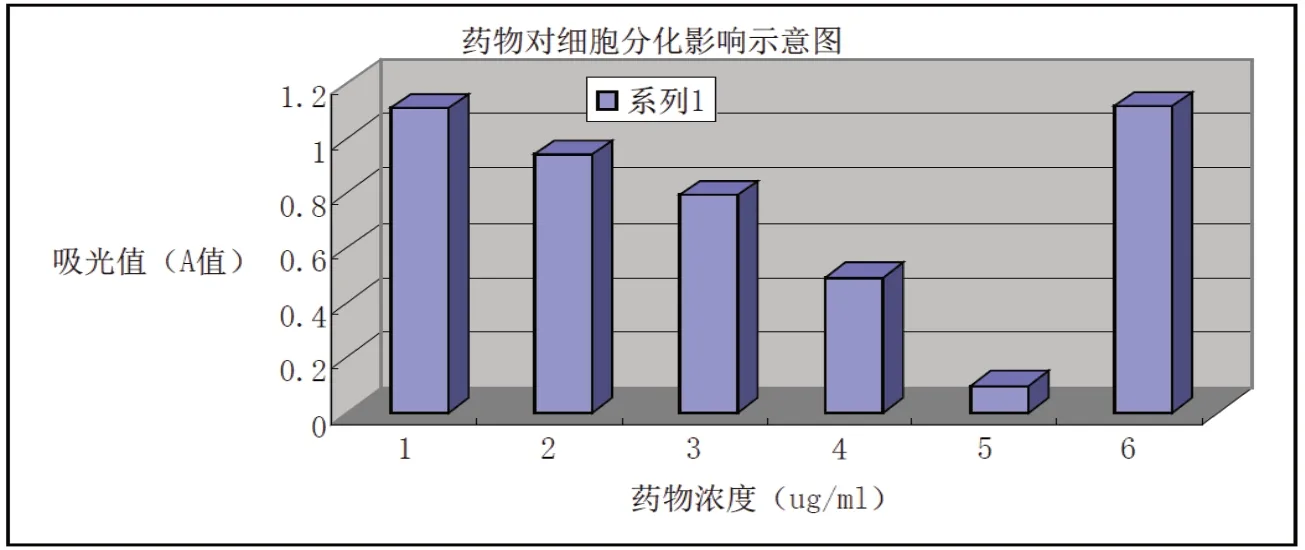
图5 不同浓度药物对细胞分化抑制率示意图

图6 药物作用前后细胞分化示意图
3 减肥胶囊作用机理的探讨
减肥胶囊是宰军华导师根据祖国医学理论并结合临床观察、实验研究等,组成的经验用方,主要用于胃热湿阻是单纯营养性肥胖病治疗。其药物组成有生大黄、山楂、荷叶、泽泻、何首乌、黄芩等。方中生大黄清热泻下,活血化瘀,为君药;何首乌补肝肾益精血,润肠通便,使痰湿膏脂易于排出体外;黄荃清热燥湿、泻火解毒;泽泻渗湿清热,祛痰湿膏脂,三者共为臣,助大黄清热化湿,润肠通便,祛痰化浊。荷叶疏肝健脾、除湿化痰、调脂减肥;山楂健脾开胃、促进消化,既善消油腻肉食积滞、又能行气散疲,二药共为佐,祛痰癖、除脂膏。诸药共用,清胃泻热、去痰浊、化瘀血。以往通过减肥胶囊对肥胖大鼠脂肪组织瘦素受体后JAK-STAT信号转录系统的影响的研究表明:不同浓度的减肥胶囊水煎液能够提升肥胖大鼠下丘脑和脂肪组织中JAK1,STAT3,STAT6基因表达水平,减肥胶囊的作用机制可能是通过对下丘脑和脂肪组织中瘦素受体后信号转录系统的影响而发挥作用[12]。减肥胶囊减肥作用明显,能够有效的控制肥胖大鼠的体重增长,降低肥胖大鼠脂肪细胞的体积和平均湿重[13]。经过前期动物实验发现,本方颗粒制剂能明显延缓肥胖大鼠体重增长速度,降低脂肪系数,减轻体重和脂肪含量,增强下丘脑OB基因及UCP2基因表达,抑制NPY基因表达,降低血浆神经肽Y含量;并可减轻“瘦素抵抗”,调节瘦素基因表达水平,从而增强靶器官对瘦素的敏感性[14]。而相关临床研究也证实,服用减肥胶囊后,患者的BMI、腰臀围降低的同时,其瘦素、胰岛素水平较治疗前亦有明显下降,还有明显的降脂、降糖作用,显著优于单纯饮食运动疗法[15]。
总之,本方紧扣临床实际和肥胖病的发病特点,合用诸药,共奏清胃泻热,通腑利湿之功效而达到治疗目的。减肥胶囊对3T3-L1前脂肪细胞增殖、分化的实验研究证明减肥胶囊能够抑制3T3-L1前脂肪细胞增殖,使细胞增殖速度减慢;能够抑制3T3-L1前脂肪细胞的分化,能使细胞分化速度减慢,使脂肪细胞分泌脂肪颗粒减少。减肥胶囊的作用机制是多方面的,可能与影响信号转导通路、脂肪细胞分泌功能等有密切的关系。但是否是特异性对应关系,需要进一步研究;其抑制前脂肪细胞增殖与分化的机制需要进一步探讨。

