少突胶质细胞及其相关疾病的研究进展
周婷婷,姜亚军
(1.南京中医药大学,江苏 南京;2.江苏省中医院,江苏 南京)
0 引言
中 枢 神 经 系 统(central nerve sytem,CNS)主要由神经元和神经胶质细胞组成。少突胶质细胞(oligodendrocytes, OLs)是中枢神经系统中唯一的成髓鞘细胞,包绕神经纤维的轴突而形成髓鞘。OLs膜上不仅分布有大量的兴奋性氨基酸受体和转运体,同时OLs还分泌各种神经营养因子。少突胶质细胞与异染性白质脑病(MLD)、多发性硬化(MS)、阿尔兹海默症(AD)等疾病密切相关。因此,了解少突胶质细胞的发育、增殖、分化、信号传导及生物学功能,不仅对于CNS脱髓鞘疾病机制的认识而且对于探索研究神经损伤后修复措施具有重大指导意义。
1 少突胶质细胞的生物学特征
1.1 少突胶质细胞的分布和来源
OLs布于中枢神经系统灰质区、白质的神经纤维束之间以及血管周围等区域,成行排列。在胎儿和新生儿时期含量较多,而在髓鞘形成过程中迅速减少。从组织发生学看,OLs起源于胚胎神经管的神经上皮细胞,是由少突胶质前体细胞(oligodendrocyteprecursor cells,OPCs)经过增殖、迁移、分化而形成。从神经干分化为OLs要经历复杂的细胞变化(图1),少突胶质祖细胞(oligodendrocyte preprogenitors,OLP)原又称为前少突胶质-2型星形细胞前体细胞即(O-2A)祖细胞,由神经干细胞发育而来,有很强增殖能力和迁移能力[1]。
1.2 OLs发育过程中的转录因子及信号通路
1.2.1 转录因子
OLs发育过程受一系列转录因子调控,转录因子对OLs 的发育分化及髓鞘再生修复的调节有着非常重要的作用。Olig属于碱性螺旋-环-螺旋(bHLH)类转录因子,有两个主要成员Olig1和Olig2,其中Olig1促进OLs的分化成熟,Olig2决定OLs的早期定向分化, Olig1与Olig2基因相互作用还可促进OPCs的形成及OLs的成熟。研究发现Olig2的147位丝氨酸残基磷酸化可促进运动神经元形成,该位点的去磷酸化可促进离体神经干细胞增殖,并促使NPCs更多地向OPCs发育[2]。目前认为Olig2调控了Smarca4/Brgl的染色质重塑复合物的功能特异性和活性,以及转录相关染色质的修饰。这对于精确地启动和建立转录程序,促进OLs的分化和随后的髓鞘形成至关重要[3]。Olig2的另一个直接作用靶基因是转录因子Sipl,Sipl能够与Id2、Id4和Hes5的启动子区域结合,拮抗P300/SMAD复合物,同时Sipl诱导Smad7的产生。 Sipl还可通过抑制BMP信号通路的效应分子Id4以及通过抑制Notch信号通路的下游分子Hes5等,从而促进OL分化、髓鞘形成与再生[4]。在OLs发育过程中存在正性协同作用因子,同时也存在很多抑制性作用因子,如BMP、ID2、ID4等,这些抑制因子通过抑制Olig2来抑制OLs分化的启动、抑制OLs的成熟。另外,大量临床实验还发现Nkx6.2、MyTI、Sox8、Sox9、Sox17 等都对OLs的成熟具有不同的促进作用[5]。
1.2.2 信号通道
OLs发育过程还受一系列信号通路的调控如Notch 通路、Wnt 通路、Sonic Hedgehog( Shh) 通路等。Notch信号通路由Notch受体、Notch配体、细胞内效应器分子三部分组成,OPCs能与Notch受体结合,激活下游信号传导,来抑制OLs成熟分化,r分泌酶是Notch信号的抑制酶,它可以阻止Notch信号的传导,从而来促进OLs的成熟,适合运用于损伤后的修复[6]。研究表明,经典的Wnt信号通路在髓鞘形成过程中发挥双重的作用。当OPC无法生成时,Wnt/β-catenin信号通路激活抑制神经祖细胞向0PC发育。当OPC生成时,Wnt/β-catenin信号通路激活可促进OL分化和髓鞘形成[7]。Shh信号分布在CNS不同的区域,与CNS的生长发育有密切的关系,OLs特化表达均有Shh参与,Shh信号通路可诱导OPCs增殖、存活及分化[8]。
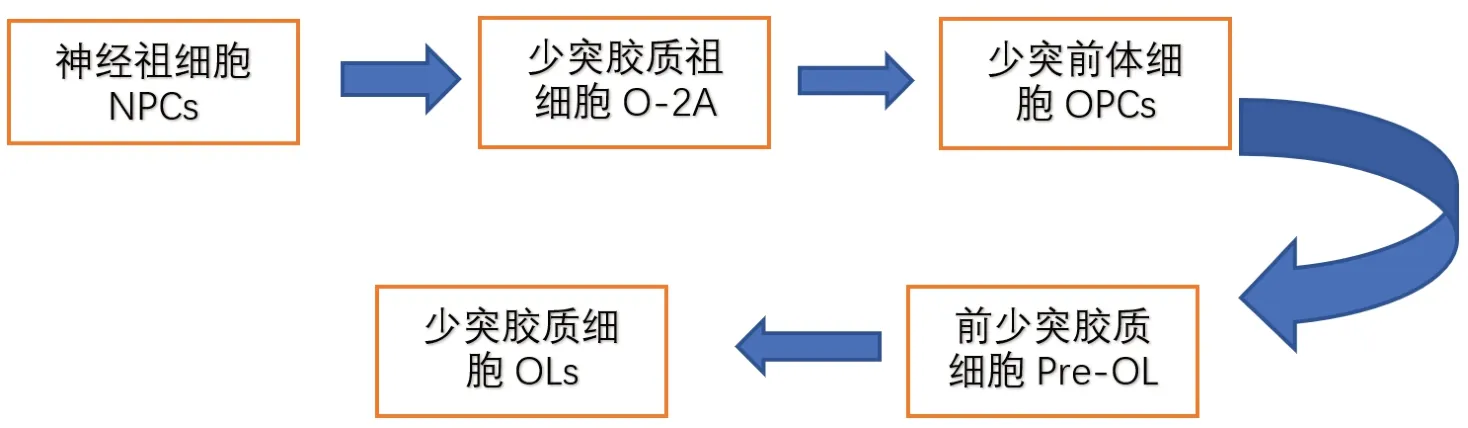
图1
1.3 少突胶质细胞的功能
1.3.1 形成髓鞘
OLs最主要的功能就是形成髓鞘包绕CNS轴突。在这个阶段,细胞表达特定的髓鞘蛋白,即髓鞘碱性蛋白、髓磷脂相关糖蛋白、髓鞘少突胶质细胞糖蛋白、髓鞘碱性蛋白(MBP、MAG,MOG,和PLP),这些蛋白的参与保证了髓鞘的结构完整性[9]。
1.3.2 营养支持神经元
OLs可以分泌神经营养因子,促进神经元和胶质的存活,并保障神经元功能发挥。Wilkins, Majed[10]等人的研究还发现来自OLs的条件培养基(CM)可激活神经元MAPK/Erk途径,从而使神经元轴突的长度增加。相关阻断试验也得出BDNF、NT-3以及胰岛素样生长因子-1(IGF-1)等生长因子能够促进少突胶质细胞生长。
1.3.3 调节神经元生长
OLs可以表达抑制性蛋白,已分化的OLs通过接触抑制,阻止神经纤维过度生长。星形胶质细胞和OLs均能产生一些具有抑制性作用的蛋白,如硫酸软骨素蛋白多糖(CSPGs)、硫酸软骨素蛋白多糖-2(NG-2)。已有研究表明[11],MAG 、Nogo-A 和OMgp 可能通过与神经元上的一个共同受体Nogo66受体(NgR)结合并传导信号级联反应,抑制神经元轴突的生长。CNS损伤后OPCs迅速聚集在受损伤的部位, OPCs产生多种具有抑制性作用的蛋白,抑制了神经的再生。
2 少突胶质细胞相关病变
与少突胶质细胞有关的病变可分为两大类:一类是原发性髓鞘形成障碍,如异染性白质脑病(MLD)、脑白质海绵样变性、肾上腺白质营养不良等;一类是继发性髓鞘损伤后发生的髓鞘破坏型脱髓鞘疾病,如多发性硬化(MS)、阿尔兹海默症(AD)、创伤性脊髓损伤(SCI)等。
2.1 异染性脑白质营养不良(metachromatic leukodystrophy, MLD)
MLD是一种常染色体隐性遗传性的神经鞘脂沉积病,为髓鞘形成障碍中比较常见的一种疾病。该病是由于22号染色体上芳基硫酸酯酶A(arylsulphatase A,ARSA)基因缺乏,导致芳基硫酸酯酶A不足,不能催化溶酶体内硫脑苷脂水解而在体内沉积,引起少突胶质细胞功能障碍、硫酸脑苷脂的聚集、髓鞘脱失和进行性神经退行性变等一系列的中枢神经系统脱髓鞘疾病。
2.2 多发性硬化(multiple sclerosis,MS)
MS的发病机制主要为明显髓鞘脱失、炎性细胞浸润、胶质细胞增生及轴索损伤。部分患者可以同时累及周围神经系统,在脊神经根主要发生脱髓鞘改变,在远端轴突可继发轴索损害。MS 是Th1 细胞介导的自身免疫病。免疫发病环节包括:抗原、抗原递呈细胞、介导脱髓鞘病变的主要细胞及其效应[12]。在抗原呈递细胞(APC)表面,同时表达MHC-Ⅱ Ag 、MBP 等抗原的表位, T 细胞对其进行双识别后,分泌IFN-γ、TNF-α、TNF-β, 破坏髓鞘的结构。激活的T细胞通过血脑屏障(BBB)后,与APC呈递的靶抗原结合后引起炎症反应,直接或通过损伤OLs而间接造成髓鞘损伤[13]。
2.3 阿尔茨海默病(Alzheimer’s disease,AD)
AD是一种进行性认知功能减退为主要特征的中枢神经系统退行性疾病。AD除了神经炎性斑和神经原纤维缠结外,还具有多种病理改变,其中髓鞘损伤与AD的发生关系密切[14]。各个时期的AD中均存在明显的白质微结构损伤。白质微结构损伤主要包括髓鞘和轴突密度降低、少突胶质细胞丢失等,其中髓鞘损伤尤为明显。AD中OLs过早功能失调可能是髓鞘损伤的主要原因。
3 少突胶质细胞病变的治疗
髓鞘慢性脱失会导致神经的退行性变,最终导致永久、严重的神经功能丧失,理论上尽快恢复髓鞘是治疗脱髓鞘疾病的最佳途径,但效果难以令人满意。因此脱髓鞘疾病的治疗,从基础研究角度来看,髓鞘修复大体分为体外补充和体内诱导。体外补充是通过体外细胞移植;体内诱导则是通过外源性因素诱导激发内源性生长。
3.1 体外补充OPCs
OLs细胞不再具有增殖、迁移能力,并不适合体外移植。1996年Targett[15]等人将人类CNS提取的OLs植入鼠脑内脱髓鞘部位,结果显示移植的细胞不能产生髓鞘,后来人们就将更多的关注集中在OPCs的移植上。大量基础实验发现不论是髓鞘形成障碍还是髓鞘形成后发生的髓鞘破坏型脱髓鞘疾病,都可以通过体外OPCs移植来实现髓鞘的恢复,改善患者的症状。Shiverer鼠是临床常用的一种脱髓鞘的动物模型,剔除了小鼠的髓鞘碱性蛋白(myelinbasic protein,MBP)基因,小鼠髓鞘缺失预期寿命仅为20~22周。目前,多能干细胞的神经诱导已经相对成熟和稳定,Chambers[16]等人发现可以通过双重抑制BMP和TGFβ信号通路可以在7d左右将hESCs稳定分化为神经上皮细胞,而进一步诱导神经上皮细胞向OPCs分化仍然需要进一步的实验探索。目前有很多实验室尝试通过改进培养方法缩短从hESCs或iPSCs到OPCs的分化时间,提高分化效率。
3.2 体内诱导OPCs
3.2.1 诱导机制
通过在体调节OLs相关转录因子、分子、膜受体等靶点,或通过特定的手段来调控机体的OPCs,促进内源性髓鞘再生成为另一条重要的治疗CNS脱髓鞘疾病的方向和思路。Brinkmann[17]等人发现NRG1-ErbB信号转导系统参与CNS髓鞘的形成,通过基因工程过度表达Ⅰ型和Ⅲ 型NRG1 之后,髓鞘形成显著。在2013年张壮等人发现GPRl7对OPCs早期分化起正向调节作用,对OLs后期发育及成熟呈负向调节作用。因此GPRl7可能是脱髓鞘性疾病治疗的潜在靶点[18]。
3.2.2 中药诱导
大量研究结果表明,中医药能促进神经损伤后神经元再生。刘杨[19]等人的实验显示大鼠脊髓损伤(spinal cordinjury,SCI) 后给予丹参注射液治疗,不仅可以有效促进脊髓神经功能的恢复,而且会引起大量神经胶质细胞的增生,这主要和升高磷脂酰肌醇3-激酶( PI3K) /蛋白激酶B ( Akt) /mTOR信号转导通路活性有关。张力[20]等人研究发现黄芪可促进神经干细胞增殖及定向分化,从中提取的单体或有效成分对中枢神经系统再生与修复具有保护作用,形成功能性神经元。人参皂苷Rg1和Rb1能显著提高SVZ和NSCs存活率,增加STAT3表达,对NSC及神经元均有不同程度的保护作用[21]。郑衍芳[22]等人发现冬虫夏草中含有多种氨基酸,参与NPCs的分化调节,还可以和各种生长因子结合,促进NSCs增殖及分化。张一帆[23]通过研究发现,从淫羊藿中提取出的有效单体成分淫羊藿苷可以增加神经生长因子在额叶皮层神经元中的表达,促进髓鞘再生及轴突修复,可作为治疗神经退行性疾病的潜在药物。楼小亮[24]等人发现养血清脑颗粒(主要成分川芎、当归、细辛、熟地等)在NPCs的增殖期,能够促进nestin的表达,从而促进神经再生。杨娜[25]等人通过大鼠局灶性脑缺血再灌注实验发现三七总皂苷可通过上调Bcl-2、Nestin、BDNF、EGF蛋白的表达,同时抑制凋亡基因的表达,从而促进NPCs增殖分化。总之,大量基础实验发现中药对神经再生有促进作用,为神经系统损伤后的治疗提供治疗新方法。
4 小结
髓鞘是保证CNS结构及功能完整的重要结构,OLs是CNS唯一的成髓鞘神经胶质细胞。通过OPCs移植或体内诱导治疗脱髓鞘疾病也成为了可能,大量研究数据表明中药可以调控与神经再生修复相关的内源性神经营养因子,促进轴突的再生与修复,同时促进OLs分化及髓鞘的形成。但是相关研究近几年却很少,中医药对于神经再生的促进十分值得去探讨,相信在不久的将来随着研究的深入,中西医结合修复将为髓鞘病变的治疗提供更多可靠的方法。

