牙龈卟啉单胞菌蛋白酶Ltp1的表达、纯化及酶学性质研究
顾前程,夏 荣,孔文文
牙周病是人类口腔的常见病和多发病。牙菌斑生物膜的形成和堆积是牙周病的直接原因,菌斑微生物可通过自身代谢产物引起组织破坏;也可通过刺激或改变宿主的自身免疫反应间接危害宿主[1]。牙龈卟啉单胞菌是目前公认的牙周致病菌[2]。其致病性主要体现在:表面结构和蛋白酶直接起着黏聚分子的作用;可产生多种胞外蛋白酶、内毒素、磷酸酶,均可对牙周组织产生破坏作用[3]。而酪氨酸蛋白酶(tyrosine protein phosphatase, PTPs)正是这些毒力因子中的一种。Maeda et al[4]发现,在牙龈卟啉单胞菌基因组中,存在PG1641基因,推测它表达了一种低分子量Ltp1。关于该蛋白酶的酶学性质研究,Maeda et al[4]采用了突变法表达此蛋白;并以孔雀石绿检测法,证实其为酪氨酸磷酸酶蛋白,同时检测不同金属离子对酶活性质的影响,但未对目的蛋白的反应温度和相应pH做相应检测。该研究通过生物学技术对目的基因进行直接合成,并以原核表达系统表达出数量较多、纯度较高的目的蛋白,简化步骤方法,同时对其进行活性检测及晶体学初筛,为后续蛋白结构研究奠定基础。
1 材料与方法
1.1 实验材料与仪器大肠杆菌BL21(DE3)(上海Invitrogen);pET29a载体改造后的p29载体(北京Novagen);质粒抽提试剂盒 (美国Axygen);PCR回收试剂盒 (美国Axygen)。引物与目的基因:PCR扩增引物、目的基因PG1641由通用生物系统(安徽)有限公司合成 ;序列测定:上海生物工程技术服务公司、通用生物系统(安徽)有限公司。化学试剂:克隆位点(5’ NdeI和3’Xhol)、Luria-Bertani(LB)培养基、琼脂、卡那霉素、异丙基-β-d-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside, IPTG)(美国Merck公司)、HEPES缓冲液(pH7.4)、1 mol/L 咪唑、5 mol/L NaCl、Buffer:50 mm HEPES pH7.4 150 mm NaCl 、蛋白纯化洗脱液:50 mm HEPES pH7.4 150 mm NaCl 40 ml、20 A:20 mm咪唑30 ml(5 mol/L咪唑120 μl加buffer至30 ml)、20B:20 mm咪唑30ml(5 mol/L咪唑120 μl加buffer至30 ml)、300 mm咪唑6 ml(5 mol/L咪唑360 μl buffer 5640 μl)、小鼠抗His标签单抗、辣根过氧化物酶标记山羊抗小鼠IgG、ECL底物发光显影定影试剂盒(以上实验材料均来自美国Sigma公司)。
1.2 实验方法
1.2.1基因合成 参考GeneBank上PG1641目的基因序列(编号为:NC_002950.2),对PG1641目的基因序列分析后进行密码子优化,使其适合于原核表达系统,交于通用生物系统(安徽)有限公司合成(合同编号G0131961),将PG1641构建于pET19-b载体上,克隆位点分别是NdeI-XhoI。
1.2.2LTP1蛋白重组质粒的构建 将合成的基因载体,用CloneExpress同源重组方法重新构建质粒表达系统pET29-PG1641-His。在设计引物时要设计目的基因以及载体线性化的引物,目的基因的正反向引物要和载体的线性化引物有15~20 bp的同源序列,这样可以在重组酶ExnaseⅡ的催化下发生同源重组。根据Ltp1 PG1641(513 bp)基因序列设计上下游引物,上游引物PG1641-S:5’-AGGAGATATACATATGAAGCCGCATAAAATTCTGTT-3’;下游引物PG1641-A:5’- GGTGGTGGTGCTCGAGATCGCAGGCGCTCAGACTAC-3’。
1.2.3重组质粒载体的扩增与鉴定 ① 将同源重组法构建的pET29-PG1641-His载体,转化至大肠杆菌BL21(DE3)感受态中,将转化后产物均匀涂在含卡那霉素抗性的LB固体培养基上,置于37 ℃恒温培养箱过夜。② 筛选阳性克隆并进行菌液PCR,同时将菌液做琼脂糖电泳检测,并送测序(上海生工生物有限公司),在NCBI上以Blast软件进行序列对比和分析,将正确结果的菌液进行质粒返还,将回收的质粒进行琼脂糖电泳。
1.2.4Ltp1蛋白的表达与纯化
1.2.4.1Ltp1的转化与表达 将返还验证后的重组质粒转化至大肠杆菌BL21(DE3)感受态中,之后将转化的菌液加入LB液体培养基中(卡那霉素抗性),37 ℃摇床培养至吸光度(optical density,OD)600 nm: 0.6~0.8时,加入IPTG,16 ℃摇床上诱导过夜表达。Beckman离心机(4 000 r/min,15 min)收菌。每罐菌体以20 ml 20 mm Tris-HCl pH7.5 150 mm NaCl 重悬,分装至10个15 ml试管中,-30 ℃冰箱保存。
1.2.4.2菌液破碎与制样 取上述菌液,化冻后倒出半管菌液至50 ml小烧杯中,加入50 mm HEPES pH7.4 150 mm NaCl至30 ml。将小烧杯放置冰上,进行冰浴超声破碎(功率42%,总时间30 min,破2 s,停2 s),破碎后菌液离心(12 000 r/min, 30 min),沉淀用buffer重悬,将上清液和沉淀分别制样。
1.2.4.3Ltp1镍柱层析粗纯化 将上清液样品进行镍离子亲和层析:先用10倍柱体积50 mm HEPES pH7.4 150 mm NaCl冲洗平衡镍柱,然后加入上清液样品,设置流速5~6 s 1滴,流完后先用40 ml上述buffer流速设置2~3 s 1滴,之后分别用2管30 ml 20 mm咪唑洗脱杂蛋白流速2~3 s 1滴,最终用6 ml 300 mm咪唑洗脱下目的蛋白(流速5~6 s 1滴),并且分别制样,和上述上清液、沉淀进行SDS-PAGE电泳分析。
1.2.4.4Ltp1分子筛细纯化 将300 mm咪唑洗脱下的目的蛋白分装在6个1.5 ml EP管中,12 000 r/min离心10 min,之后用分子筛层析进一步分离细纯化。先用配置好且已经超声除气好的buffer(50 mm HEPES pH7.4 150 mm NaCl )冲洗S75凝胶层析柱,平衡柱子,流出速度为1.0 ml/min,柱压为0.7 MPa,冲洗体积为120~140 ml。然后将6 ml 150 mm咪唑洗脱下且离心好的蛋白质样品通过注射器上样,设置流速1.0 ml/min,柱压0.7 MPa,每管接样体积1.4 ml,紫外灯280 nm进行检测。大约当冲洗体积是70~90 ml时紫外OD值发生变化,软件上出现一个尖锐峰,收集此峰范围内EP管所接样品并标记。对所收集样品紫外分光光度仪测浓度并分别制样跑电泳检测。
1.2.5Western blot鉴定重组蛋白 将上述细纯化收集的目的蛋白样品加入浓缩管(美国Millipore),截留分子量大小10 ku蛋白质,4 ℃、3 200 r/min 离心机离心10 min。紫外分光光度仪测OD值,直至蛋白质浓度浓缩达10 mg/ml以上。采用Western blot法对浓缩样品进行检测:一抗为小鼠抗His标签单抗,二抗为稀释为1 ∶3 000的HRP标记的羊抗小鼠IgG,将细纯化浓缩后的目的蛋白进行SDS-PAGE电泳,用PVDF膜转模,脱脂牛奶37 ℃封闭1 h,洗3次;加入小鼠抗His标签单抗(一抗)(1 ∶2 000),室温结合1 h,洗膜5次;加入辣根过氧化物酶标记山羊抗小鼠 IgG(二抗)(1 ∶3 000),室温结合45 min,洗5次,ECL底物发光显影定影试剂盒显色,使用X线曝光分析结果。
1.3 Ltp1酶学研究
1.3.1OD变化 室温下,以对硝基苯磷酸二钠为显色底物溶液,与纯化所得目的蛋白反应,以NaOH终止反应,使用DU800监测A405 nm OD变化[5]。实验组为底物对硝基苯磷酸盐(p-nitrophenyl phosphate,p-NPP)溶液同时加入PG1641目的蛋白参与反应,空白组为单独底物p-NPP溶液不加目的蛋白PG1641。
1.3.2不同反应温度对蛋白活性影响 将1.3.1中温度分别设为37、50、75 ℃,加入目的蛋白,其他条件不变,进行显色反应。
1.3.3不同pH对蛋白活性影响 配置不同pH反应液,pH分别为5.0、6.0、7.4、9.0,加入目的蛋白,其他条件不变进行显色反应。
1.3.4酶活测定 在室温下,50 mm HEPES 150 mm NaCl pH7.4条件下,将细纯化目的蛋白与不同浓度对p-NPP反应,测OD值,最后应用双倒数作图计算Km和Vmax值。
2 结果
2.1 Ltp1表达载体的构建图1为琼脂糖电泳结果:从NCBI上得知PG1641目的基因为513 bp,琼脂糖电泳结果与目的基因大小基本一致,在500多bp左右;图2显示,质粒回收后琼脂糖电泳结果也与实际结果一致。图3以生物学信息软件ExPAsy软件生物学信息软件分析知Ltp1蛋白PI值约为4.99,理论相对分子量约为18.75 ku。

图1 p29-PG1641菌液PCR后DNA琼脂糖电泳
M:DNA Marker;1、2、3、4、5、6:均是菌液PCR后目的基因PG1641

图2 质粒回收后琼脂糖电泳
M:DNA Marker;1、2、3、4:回收的PG1641目的基因

图3 ExPASy软件分析结果
2.2 Ltp1蛋白的大量表达将构建成功的原核表达载体p29-PG1641-His转化至大肠杆菌BL21(DE3)感受态细胞中,经过IPTG诱导表达,收菌、离心破碎、纯化后,SDS-PAGE结果显示:与理论值18.75 ku大小基本符合,且粗纯化和细纯化后在上清液和300 mm咪唑洗脱液中均存在目的蛋白Ltp1。图4为镍柱亲和层析粗纯化SDS-PAGE结果:可以观察到上清液和300 mm咪唑洗脱液条带范围大约在18.4~25.0 ku之间;图5为分子筛细纯化样品SDS-PAGE结果:可以观察到管数51、53、55、57、61、63、65均有目的蛋白。
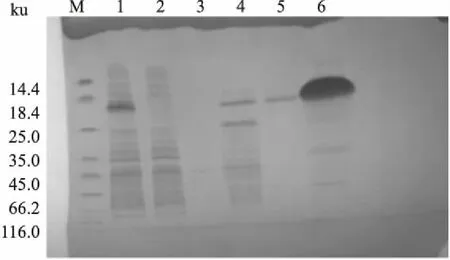
图4 镍柱层析样品粗纯化SDS-PAGE
M:蛋白Marker;1:上清液;2:流穿;3:buffer;4:20 mm咪唑洗脱液;5:20:mm咪唑洗脱液;6:300 mm咪唑洗脱液

图5 分子筛尖峰下细纯化样品SDS-PAGE
M:蛋白Marker;51、53、55、57、59、61、63、65:分别为分子筛A280尖峰下对应样品管数
2.3 Western blot测定将分子筛细纯化样品浓缩后的目的蛋白进行Western blot分析,显色后在PVDF膜上出现单一条带(图6),表明表达的目的蛋白确实是带有His标签的Ltp1目的蛋白。
M:蛋白Marker(Easy-see marker);1、2、3、4:均是分子筛样品浓缩后PG1641蛋白
2.4 Ltp1酶学检测结果Ltp1可催化p-NPP产生黄色产物p-NP。纯化后所得目的蛋白具有典型磷酸酶活性(图7),且在pH 5.0~6.0均具有较高催化活性(图8),随着pH升高,活性逐渐降低;37~50 ℃时,活性最高(图9)。

图7 酶活反应
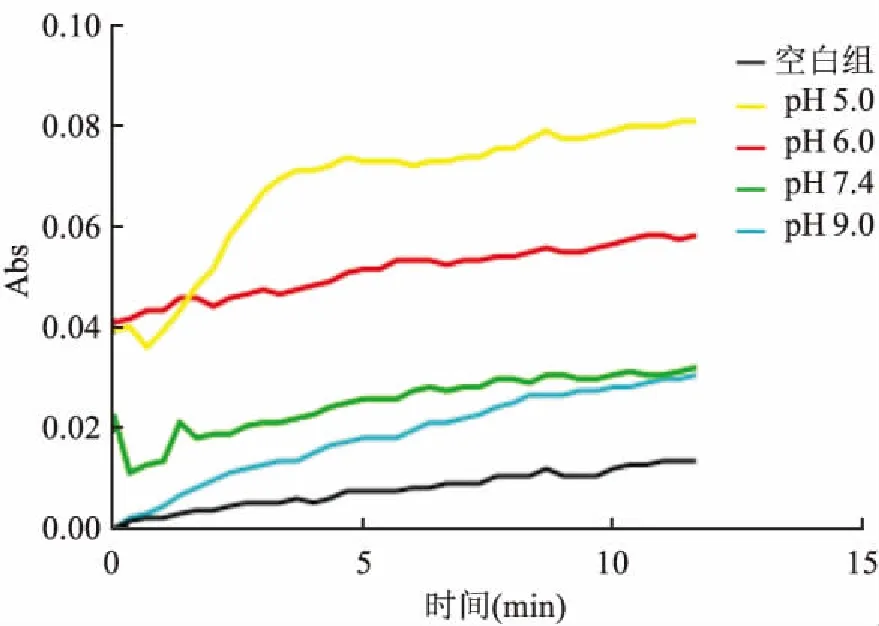
图8 pH检测

图9 温度检测
2.5 酶活结果在不同浓度p-NPP底物条件下,与重组目的蛋白反应,测定其初速度(1/V),以1/V和1/S做双倒数图,求得重组蛋白的Km和Vmax分别为:70.4 μmol和51.1 μmol/(L·min)。
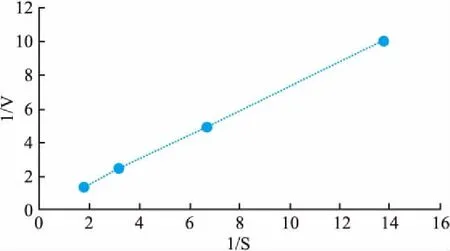
图10 米氏常数Km和最大反应速度Vmax测定1/V:反应速度倒数;1/S:底物浓度倒数
3 讨论
牙龈卟啉单胞菌是口腔中一种革兰阴性厌氧菌,与齿垢密螺旋体、福赛坦氏菌共称为“红色复合体”,和晚期牙周病变密切相关[6]。具有对牙周组织高度破坏性,这主要归因于其特有的毒力因子库。而Ltp1正是毒力因子库的多功能调节剂:首先这种病原体不产生铁载体, 相反,它以特定的菌毛蛋白,促进Ltp1释放,以此来加速血红素的摄取,最终调节胞外多糖合成[7];Ltp1还可以促进牙龈素(RgpA、RgpB或Kgp)等蛋白酶的产生,这些蛋白酶为糖酵解提供了肽底物,用于降解牙龈纤维和宿主产生的免疫效应分子,并且牙龈素已被公认为是生物体的主要毒力决定因素[8-9];Ltp1还可参与约束单种菌斑生物膜和异型菌斑微生物膜的累积,例如在牙龈卟啉单胞菌和戈登链球菌异型微生物社区中,第一步就是由2个不同的黏附素受体介导的共价黏附作用[10];除此之外,Ltp1还可干扰细菌种间AI-2信号的传导,主要是通过负调节LuxS的转录,从而使细菌黏附受到干扰[11]。
本研究将牙龈卟啉单胞菌目的基因PG1641重组至带有His标签的pET29载体上,利用大肠杆菌BL21进行诱导表达。SDS-PAGE电泳检测到相对分子量约为18.75 ku的目的蛋白,Western blot鉴定了该重组蛋白。通过与其底物p-NPP反应得知其酶活Km和Vmax分别为70.4 μmol、51.1 μmol/(L·min),在pH 5.0~6.0和37~50 ℃具有较高活性,后续实验将对其进行进一步优化,以期获得纯度更高且不含标签的的目的蛋白。为下一步晶体学初筛,晶体条件的探索奠定基础,这样就可以从结构生物学角度明晰其致病机理,也可为牙周炎的免疫治疗、靶向药物研究提供方向。

