丁苯酞激活Hedgehog信号通路抑制缺氧复氧心肌细胞氧化应激、炎症、凋亡的机制研究
邓瑞,王威
心肌缺血再灌注(I/R)是临床常见心肌损伤的病理过程[1]。I/R损伤导致局部心肌炎症和细胞凋亡,最终导致心肌不可逆转的损伤甚至死亡。因此,需要减少心肌I/R损伤的新疗法来改善患者的临床结局。丁苯酞(NBP)来源于芹菜种子,属于苯酞类化合物,临床主要用于缺血性脑卒中的治疗,有研究发现[2,3]丁苯酞对大鼠心肌缺血以及I/R导致的损伤具有抑制作用。Hedgehog信号通路促进心肌细胞的增殖[4],激活Hedgehog可以改善心肌凋亡及促进细胞增殖[5],然而丁苯酞对心肌I/R损伤的作用机制是否与Hedgehog信号通路有关,目前尚未可知。因此,本研究以心肌细胞为实验对象,利用缺氧复氧(H/R)处理构建心肌I/R损伤模型,考察丁苯酞对心肌细胞增殖、凋亡、炎症、氧化应激和Hedgehog信号通路的影响,旨在探索其潜在的作用机制。
1 材料与方法
1.1 主要试剂 NBP(含量为99.8%)购自中国食品药品检定研究院,心肌细胞购自中国科学院典型培养物保藏委员会细胞库,DMEM培养基(Dulbecco,s modified eagle medium)、胎牛血清购自美国GIBCO公司,异硫氰酸荧光素标记的膜联素Ⅴ/碘化丙啶(annexin Ⅴ-FITC/PI)细胞凋亡检测试剂盒购自江苏凯基生物公司,噻唑蓝(MTT)、抑制剂HPI-4购自美国Sigma公司,胰酶、RIPA裂解液、二甲基亚砜(dimethyl sulfoxide,DMSO)购自北京索莱宝公司,细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(CDK2)、活化的多聚ADP-核糖聚合酶(cleaved PARP)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)、β肌动蛋白(β-actin)抗体购自美国Cellular Signaling Technology公司,PTCH、Smoothened(SMO)、Gli-1抗体购自上海艾博抗公司,辣根过氧化物酶标记二抗购自博士德生物有限公司,超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)检测试剂盒、活性氧(ROS)检测试剂盒、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)酶联免疫(ELISA)试剂盒购自碧云天生物技术公司。
1.2 细胞培养与分组 心肌细胞在含10%胎牛血清的DMEM培养基中,于37℃、5% CO2的培养箱中培养。选取生长状态良好的心肌细胞,将其分为Blank组(空白组,未作任何处理的心肌细胞),H/R组(缺氧处理心肌细胞复氧3 h,复氧处理6 h[6]),不同浓度NBP[7]组:NBP-L组(NBP低浓度组,心肌细胞使用2 μmol/L NBP和H/R处理),NBP-M组(NBP中浓度组,心肌细胞使用10 μmol/L NBP和H/R处理)、NBP-H组(NBP高浓度组,心肌细胞使用50 μmol/L NBP和H/R处理)。H/R+NBP组(心肌细胞进行NBP和H/R处理),H/R+NBP+HPI-4组(心肌细胞进行NBP、H/R和5 μmol/L HPI-4[8]处理)。其中,NBP处理心肌细胞24 h。
1.3 MTT检测心肌细胞增殖 在96孔细胞板中接种密度为1×105个/ml的心肌细胞,培养48 h后,每孔细胞加入20 μl 5 mg/ml的MTT溶液,37℃孵育 4 h,弃上清,加入150 μl DMSO,37℃摇床振荡孵育10 min,于酶标仪测定心肌细胞在490 nm处的吸光(OD)值,计算细胞存活率。细胞存活率(%)=实验组OD值/对照组OD值×100%
1.4 流式细胞术检测心肌细胞凋亡 调整各组心肌细胞密度为1×106个/ml,参照细胞凋亡试剂盒说明书的指示,在细胞中加入500 μl缓冲液重悬细胞,加入5 μl Annexin V-FITC混匀,加入5 μl PI混匀,室温避光反应15 min,置流式细胞仪进行细胞凋亡的检测。
1.5 炎症因子TNF-α、IL-6、IL-1β、氧化应激指标ROS、SOD、MDA检测[9]收集各组心肌细胞上清液,严格按照ELISA试剂盒说明书的指示,检测炎症因子TNF-α、IL-6、IL-1β水平。按照ROS、SOD、MDA检测试剂盒说明书的指示,检测氧化应激指标ROS、SOD、MDA水平。
1.6 蛋白质印迹法(W e s t e r n b l o t)检测cyclinD1、CDK2、cleaved PARP、cleaved caspase-3、PTCH、SMO和Gli-1蛋白表达 心肌细胞加入RIPA裂解液,以提取总蛋白,蛋白样品经沸水变性10 min,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至聚偏二氟乙烯(PVDF)膜,5%脱脂奶粉常温封闭1 h,加入1:1000稀释的一抗,4℃孵育过夜,次日用Tris-HCl-Tween缓冲盐溶液(TBST)洗膜3次×10 min,加入1:5000稀释的二抗,室温孵育1 h,TBST洗膜3次×10 min,经化学发光液显色、显影,以β-actin作为内参蛋白,分析目的蛋白表达。
1.7 统计学分析 实验数据采用SPSS 22.0软件进行统计与分析,数据以平均值±标准差()表示。两组间数据比较采用t检验,多组间数据比较用单因素方差分析,组间多重比较用SNK-q检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度的丁苯酞对缺氧复氧心肌细胞存活的影响 MTT和Western blot检测结果显示,与空白组比较,H/R诱导的心肌细胞存活率、cyclin D1和CDK2蛋白表达量明显减少(P<0.05)(表1、图1);与H/R组比较,不同浓度的NBP显著提高H/R心肌细胞存活率、cyclinD1和CDK2蛋白表达量(P<0.05)(表1、图1)。
2.2 不同浓度的丁苯酞对缺氧复氧心肌细胞凋亡的影响 流式细胞术和Western blot检测结果显示,与空白组比较,H/R组心肌细胞凋亡率、cleaved PARP、cleaved caspase-3蛋白表达量增加(P<0.05)(表2、图2);与H/R组比较,不同浓度的NBP显著降低心肌细胞凋亡率、cleaved PARP、cleaved caspase-3蛋白水平(P<0.05)(表2、图2)。
2.3 不同浓度的丁苯酞对缺氧复氧心肌细胞炎症的影响 对炎症因子分泌的检测结果显示,与空白组比较,H/R组心肌细胞中TNF-α、IL-6、IL-1β水平明显升高(P<0.05)(表3);与H/R组比较,不同浓度NBP显著降低H/R诱导的心肌细胞中TNF-α、IL-6、IL-1β水平(P<0.05)(表3)。
2.4 不同浓度的丁苯酞对缺氧复氧心肌细胞氧化应激的影响 对氧化应激的检测结果表明,与空白组比较,H/R组心肌细胞的ROS、MDA水平明显升高,SOD活性显著降低(P<0.05)(表4);与H/R组比较,不同浓度NBP明显降低心肌细胞的ROS、MDA水平,而显著提高SOD活性(P<0.05)(表4)。
表1 不同浓度的丁苯酞对缺氧复氧心肌细胞存活及cyclinD1和CDK2蛋白表达的影响()
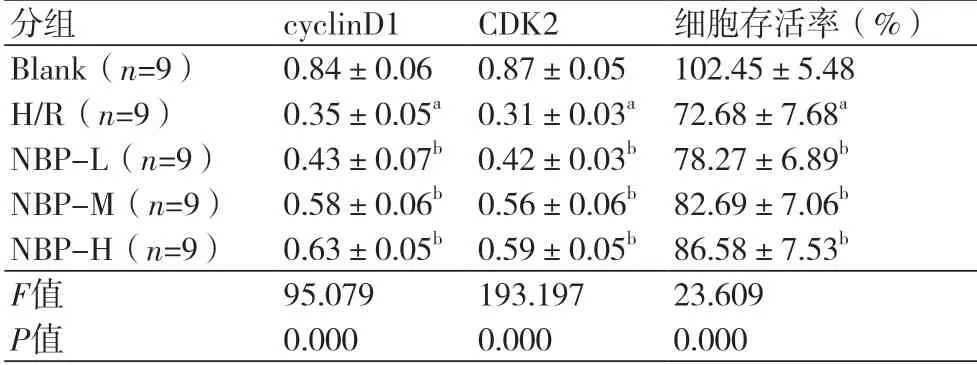
表1 不同浓度的丁苯酞对缺氧复氧心肌细胞存活及cyclinD1和CDK2蛋白表达的影响()
注:与空白组比较,aP<0.05;与H/R组比较,bP<0.05
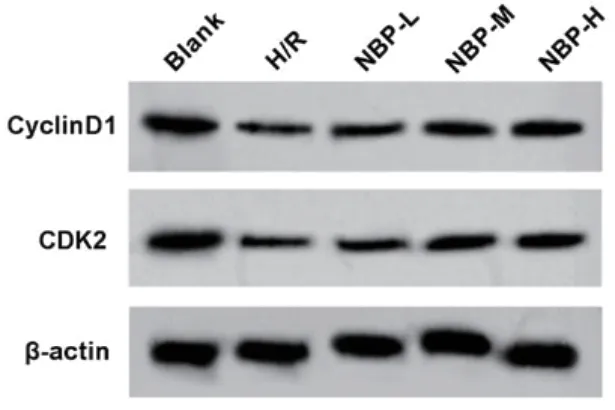
图1 Western blot检测缺氧复氧心肌细胞cyclinD1和CDK2蛋白表达
表2 不同浓度的丁苯酞对缺氧复氧心肌细胞凋亡及cleaved PARP和cleaved caspase-3蛋白的表达()

表2 不同浓度的丁苯酞对缺氧复氧心肌细胞凋亡及cleaved PARP和cleaved caspase-3蛋白的表达()
注:与空白组比较,aP<0.05;与H/R组比较,bP<0.05

图2 不同浓度的丁苯酞对缺氧复氧心肌细胞凋亡的影响
表3 不同浓度的丁苯酞对缺氧复氧心肌细胞炎症因子分泌的影响 ()
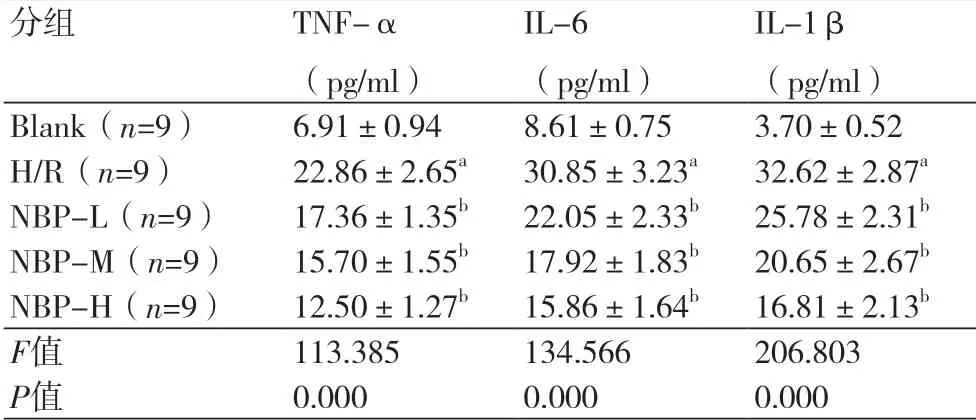
表3 不同浓度的丁苯酞对缺氧复氧心肌细胞炎症因子分泌的影响 ()
注:TNF-α:肿瘤坏死因子-α;IL-6:白介素-6;IL-1β:白介素-1β;与空白组比较,aP<0.05;与H/R组比较,bP<0.05
IL-1β(pg/ml)Blank(n=9) 6.91±0.94 8.61±0.75 3.70±0.52 H/R(n=9) 22.86±2.65a 30.85±3.23a 32.62±2.87a NBP-L(n=9) 17.36±1.35b 22.05±2.33b 25.78±2.31b NBP-M(n=9) 15.70±1.55b 17.92±1.83b 20.65±2.67b NBP-H(n=9) 12.50±1.27b 15.86±1.64b 16.81±2.13b F值 113.385 134.566 206.803 P值 0.000 0.000 0.000分组 TNF-α(pg/ml)IL-6(pg/ml)
2.5 不同浓度的丁苯酞对缺氧复氧心肌细胞Hedgehog信号通路的影响 Western blot检测结果发现,与空白组比较,H/R组心肌细胞中PTCH、SMO和Gli-1蛋白表达量明显降低(P<0.05)(表5、图3);与H/R 组比较,N B P-L、NBP-M、NBP-H组明显提高PTCH、SMO和Gli-1蛋白水平(P<0.05)(表5、图3)。
2.6 Hedgehog信号通路抑制剂HPI-4部分逆转丁苯酞对缺氧复氧心肌细胞的保护作用 与H/R+NBP组比较,H/R+NBP+HPI-4组心肌细胞的存活率、cyclinD1、CDK2、PTCH、SMO和Gli-1蛋白表达量明显降低,细胞凋亡率、cleaved PARP、cleaved caspase-3蛋白水平显著升高(P<0.05)(表6、图4)。
表4 不同浓度的丁苯酞对缺氧复氧心肌细胞氧化应激的影响()

表4 不同浓度的丁苯酞对缺氧复氧心肌细胞氧化应激的影响()
注:ROS:活性氧;SOD:超氧化物歧化酶;MDA:丙二醛;与空白组比较,aP<0.05;与H/R组比较,bP<0.05
表5 不同浓度的丁苯酞对缺氧复氧心肌细胞Hedgehog信号通路PTCH、SMO和Gli-1蛋白表达的影响()
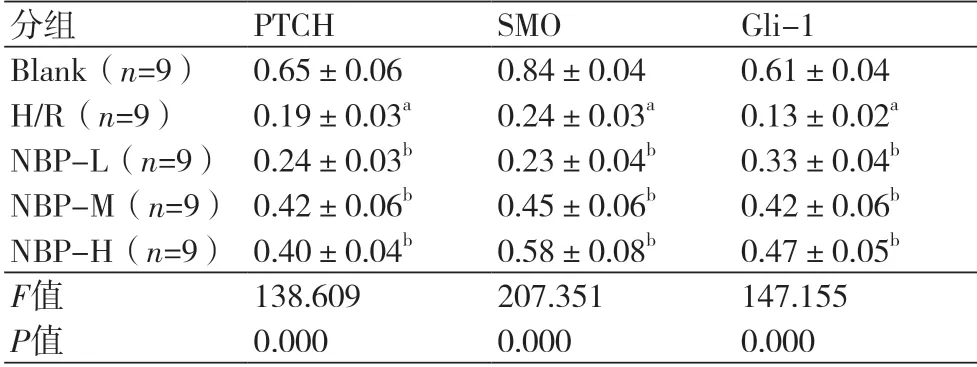
表5 不同浓度的丁苯酞对缺氧复氧心肌细胞Hedgehog信号通路PTCH、SMO和Gli-1蛋白表达的影响()
注:与空白组比较,aP<0.05;与H/R组比较,bP<0.05
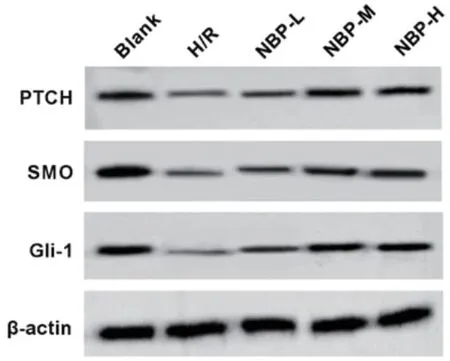
图3 Western blot检测缺氧复氧心肌细胞PTCH、SMO和Gli-1蛋白表达
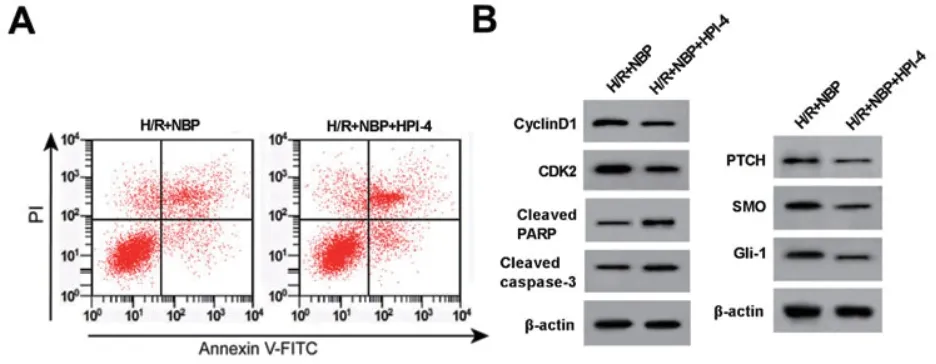
图4 HPI-4和丁苯酞对缺氧复氧心肌细胞凋亡以及蛋白表达的影响
3 讨论
缺血性心脏病,包括冠心病,是全世界范围内导致死亡的主要原因之一[10]。冠心病的影响通常是由急性心肌缺血引起的[11]。缺血会产生细胞应激,导致不可逆的组织损伤。为了确保细胞存活和维持器官功能,缩短缺血时间是必须的,但再灌注时大量的氧气和营养物质的重新引入会产生过度的氧化应激,从而进一步增加细胞损伤和心肌细胞死亡[12]。目前,心肌I/R损伤的机制是复杂的,多方面的,涉及氧化应激、过度炎症和/或程序性细胞死亡,细胞内钙失衡,线粒体功能障碍等[13-15]。因此,防止氧化应激、炎症和心肌细胞凋亡可能是治疗冠心病的有效途径。H/R损伤可显著促进心肌细胞凋亡,增加炎症和氧化应激[16]。本研究考察了丁苯酞对心肌细胞H/R损伤的作用,结果表明,丁苯酞促进心肌细胞增殖,降低炎症因子分泌,改善心肌细胞的氧化应激。值得注意的是,丁苯酞对H/R损伤心肌细胞有明显的抗凋亡作用。另外,丁苯酞通过Hedgehog信号通路在H/R损伤心肌细胞模型中调节心肌细胞的存活。
细胞凋亡被认为是心肌损伤的重要机制。凋亡过程中心肌细胞数量减少,心肌成纤维细胞增殖,导致心肌肥厚,收缩力下降,最终发展为心力衰竭[17]。根据报道,几个重要的分子参与细胞凋亡的进展,包括PARP和caspase-3[17]。炎症是心脏缺氧-复氧损伤最常见的特征之一,预防炎症可以有效地预防心肌缺血再灌注损伤[18]。氧化应激是心脏H/R损伤的另一诱因,过量的ROS会引起一系列的病理变化,如氧化还原酶的激活等[19]。在本实验中,H/R处理明显降低心肌细胞存活率、cyclinD1、CDK2蛋白表达、SOD活性,而显著提高心肌细胞凋亡率、磷酸化PARP、磷酸化caspase-3蛋白表达量、TNF-α、IL-6、IL-1β、ROS、MDA水平,表明缺氧复氧导致心肌细胞增殖抑制,炎症、氧化应激和细胞凋亡增加。资料显示,丁苯酞在大鼠心肌细胞缺血再灌注损伤中发挥保护作用,可以有效降低大鼠心肌梗死面积和细胞凋亡[20]。在异丙肾上腺素诱导的大鼠心肌损伤模型中,丁苯酞能够减轻缺血心肌损伤,提高SOD活性,降低MDA含量[21]。本项研究中,使用不同浓度的丁苯酞处理可以显著改善缺氧复氧心肌细胞的损伤程度,显著提高心肌细胞存活率、cyclinD1、CDK2蛋白表达量、SOD活性,并降低心肌细胞凋亡率、cleaved PARP、cleaved caspase-3蛋白、TNF-α、IL-6、IL-1β、ROS、MDA水平,发挥保护缺氧复氧心肌细胞的作用,与前述报道相符。
表6 HPI-4和丁苯酞对缺氧复氧心肌细胞增殖和凋亡以及Hedgehog信号通路蛋白表达的影响
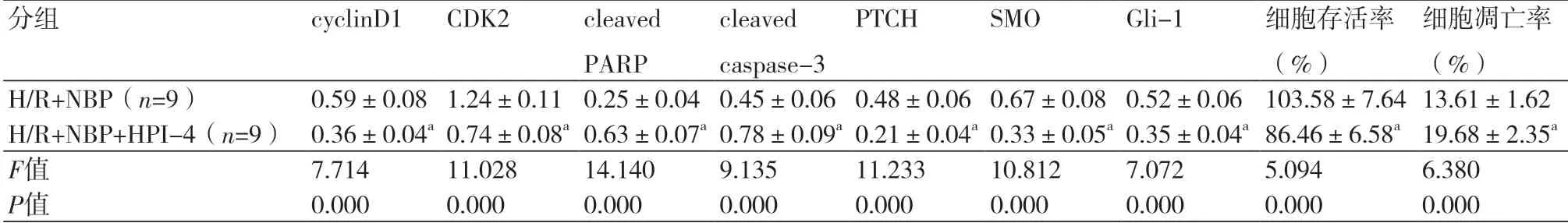
表6 HPI-4和丁苯酞对缺氧复氧心肌细胞增殖和凋亡以及Hedgehog信号通路蛋白表达的影响
注:与H/R+NBP组比较,aP<0.05
细胞凋亡率(%)H/R+NBP(n=9) 0.59±0.08 1.24±0.11 0.25±0.04 0.45±0.06 0.48±0.06 0.67±0.08 0.52±0.06 103.58±7.64 13.61±1.62 H/R+NBP+HPI-4(n=9) 0.36±0.04a 0.74±0.08a 0.63±0.07a 0.78±0.09a 0.21±0.04a 0.33±0.05a 0.35±0.04a 86.46±6.58a 19.68±2.35a F值 7.714 11.028 14.140 9.135 11.233 10.812 7.072 5.094 6.380 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000分组 cyclinD1 CDK2 cleaved PARP cleaved caspase-3 PTCH SMO Gli-1 细胞存活率(%)
成年哺乳动物心肌细胞在受到损伤时几乎没有增殖能力,然而,在组织损伤时,一些在胚胎发生时活跃而在成年期沉默的通路被激活,其中一个例子就是Hedgehog信号[22]。Hedgehog信号通路参与调节胚胎心脏冠状动脉血管的生成和发育。Hedgehog信号通路主要包括信号肽(Shh等)、跨膜受体(PTCH、SMO等)、下游核转录因子(Gli等)3个部分[23]。近年来,Hedgehog信号通路成为促进心肌细胞增殖、抑制心肌细胞死亡和凋亡、向心肌缺血部位募集内皮祖细胞、引导干细胞向心肌谱系分化的重要调控因子[24]。本研究中,缺氧复氧处理显著抑制Hedgehog信号通路PTCH、SMO和Gli-1蛋白表达,而丁苯酞可以促进PTCH、SMO和Gli-1蛋白表达。此外,Hedgehog信号通路抑制剂HPI-4部分逆转丁苯酞对缺氧复氧心肌细胞的保护作用,表明Hedgehog信号通路激活可能是丁苯酞保护缺氧复氧心肌细胞损伤的重要途径之一。
综上所述,不同浓度的丁苯酞可以促进缺氧复氧诱导的心肌细胞增殖,减轻其凋亡、炎症和氧化应激,其作用机制与Hedgehog信号通路激活有关,这为心肌缺血再灌注损伤的治疗提供了新的见解。

