水稻Ossp1基因的亚细胞定位及其干旱条件下的表达
腾海艳

摘要:sp1基因是叶绿体蛋白质输入调控的关键基因,本研究通过生物信息学分析、Real time PCR分析、瞬时表达分析等方法,对sp1在水稻中的同源基因Ossp1进行了结构和功能预测、组织表达和干旱响应性分析以及亚细胞定位分析。生物信息学分析结果显示,水稻Ossp1基因位于7號染色体,基因登录号为Os07g0647800,序列全长1 032 bp,SP1蛋白由343个氨基酸残基组成,信号肽序列位于氮端,蛋白质分子中有2个跨膜区域。Real time PCR分析结果显示,Ossp1在水稻叶片中表达量最高,其次为叶鞘,根中最低,此外,Ossp1在叶片中的表达具有明显的干旱响应性,受到干旱胁迫诱导后,表达量显著提高。采用瞬时表达进行亚细胞定位结果显示,SP1蛋白定位于水稻叶绿体。上述结果显示了Ossp1基因与水稻叶绿体及干旱胁迫响应的关系,为Ossp1基因功能的深入研究提供了基础。
关键词:水稻;Ossp1基因;亚细胞定位;干旱胁迫;基因表达
中图分类号:Q786文献标识码:A文章编号:1000-4440(2020)03-0529-06
Subcellular localization and expression under drought conditions of rice Ossp1 gene
TENG Hai-yan
(School of Chemistry and Bioengineering, Yichun University, Yichun 336000, China)
Abstract:The sp1 is a key gene for the regulation of chloroplast protein import, and Ossp1 is the homologous gene of sp1 in rice. In this study, the structure and function prediction, tissue expression, drought-responsiveness analysis and subcellular localization analysis of Ossp1 were carried out by bioinformatics analysis, realtime PCR analysis and transient expression analysis. The results of bioinformatics analysis showed that Ossp1 was located on chromosome 7(gene accession number: Os07g0647800), and the sequence was 1 032 bp in length. The SP1 protein was composed of 343 amino acid residues, the signal peptide was located at the N-terminus, and there were two transmembrane regions. The results of real time PCR analysis showed that the expression level of Ossp1 was highest in rice leaves, followed by leaf sheaths, and lowest in roots. In addition, the expression of Ossp1 could be significantly induced by drought stress, showed obvious drought responsiveness. Subcellular localization analysis of SP1 protein was performed by transient expression assay, and the results indicated that the SP1 protein was localized in rice chloroplasts. The above results show the relationship between gene Ossp 1 and rice chloroplast and drought responsiveness, and provide the basis for further research on the function of gene Ossp 1.
Key words:rice;Ossp1;subcellular localization; drought stress;gene expression
植物叶绿体含有大约3 000种蛋白质,其中绝大部分由核基因编码,少数由叶绿体自身基因组编码。核基因编码的叶绿体蛋白质在细胞质合成后,经叶绿体外膜和内膜上的转运蛋白TOC(Translocon of the outer membrane of chloroplasts)和TIC(Translocon of the inner membrane of chloroplasts)转运到叶绿体内发挥功能[1-2]。研究结果[3-4]表明,拟南芥是通过控制外膜TOC蛋白的降解进行叶绿体蛋白输入调控的,降解由SP1(Suppressor of ppi1 locus1)、SP2(Suppressor of ppi1 locus2)及CDC48(Cell division cycle 48)蛋白协作完成,其中,SP1蛋白负责催化TOC发生泛肽化,再由SP2和CDC48介导泛肽化的蛋白质由叶绿体外膜回到细胞质,被细胞质中的泛肽-蛋白酶体系统(Ubiquitin-proteasome system,UPS)降解,这个对TOC蛋白进行识别、泛肽化和降解的机制称为叶绿体相关蛋白降解(Chloroplast-associated protein degradation,CHLORAD)[4]。CHLORAD机制不仅参与正常生长条件下的叶绿体蛋白输入调控,还与植物的胁迫响应有关。在氧化胁迫条件下,拟南芥通过提高sp1基因表达促进TOC蛋白降解,从而降低叶绿体蛋白输入量,减慢叶绿体内光反应速率和氧气生成,避免加剧氧化胁迫[5-6]。在拟南芥中过表达sp1后,植物的抗逆能力相比野生型明显增强,而相同条件下的sp1突变体则表现出发育滞后,抗逆性下降等表型,TOC等蛋白质的含量变化与SP1含量也表现出直接相关性,表明SP1是蛋白质由细胞质向叶绿体输入的重要调节因子,与植物的生长发育和逆境响应机制密切相关[4,7]。
sp1在水稻中的同源基因目前尚未见报道。水稻是中国最重要的粮食作物之一,也是单子叶植物研究的模式植物,本研究选择sp1在水稻中的同源基因(命名为Ossp1)作为研究对象,通过生物信息学分析、组织表达、干旱响应性分析和亚细胞定位,确定Ossp1基因在水稻基因组的序列信息、组织表达和干旱响应特性及SP1蛋白的亚细胞定位情况,以期为后续深入研究该基因的功能和阐明水稻叶绿体蛋白的输入调节机制奠定基础。
1材料与方法
1.1试验材料
本研究所用水稻(Oryza sativa L.)品种为粳稻品种中花11,试验材料种植于宜春学院苗圃温室,常规管理。
1.2水稻sp1基因(Ossp1)及其编码蛋白质的生物信息学分析
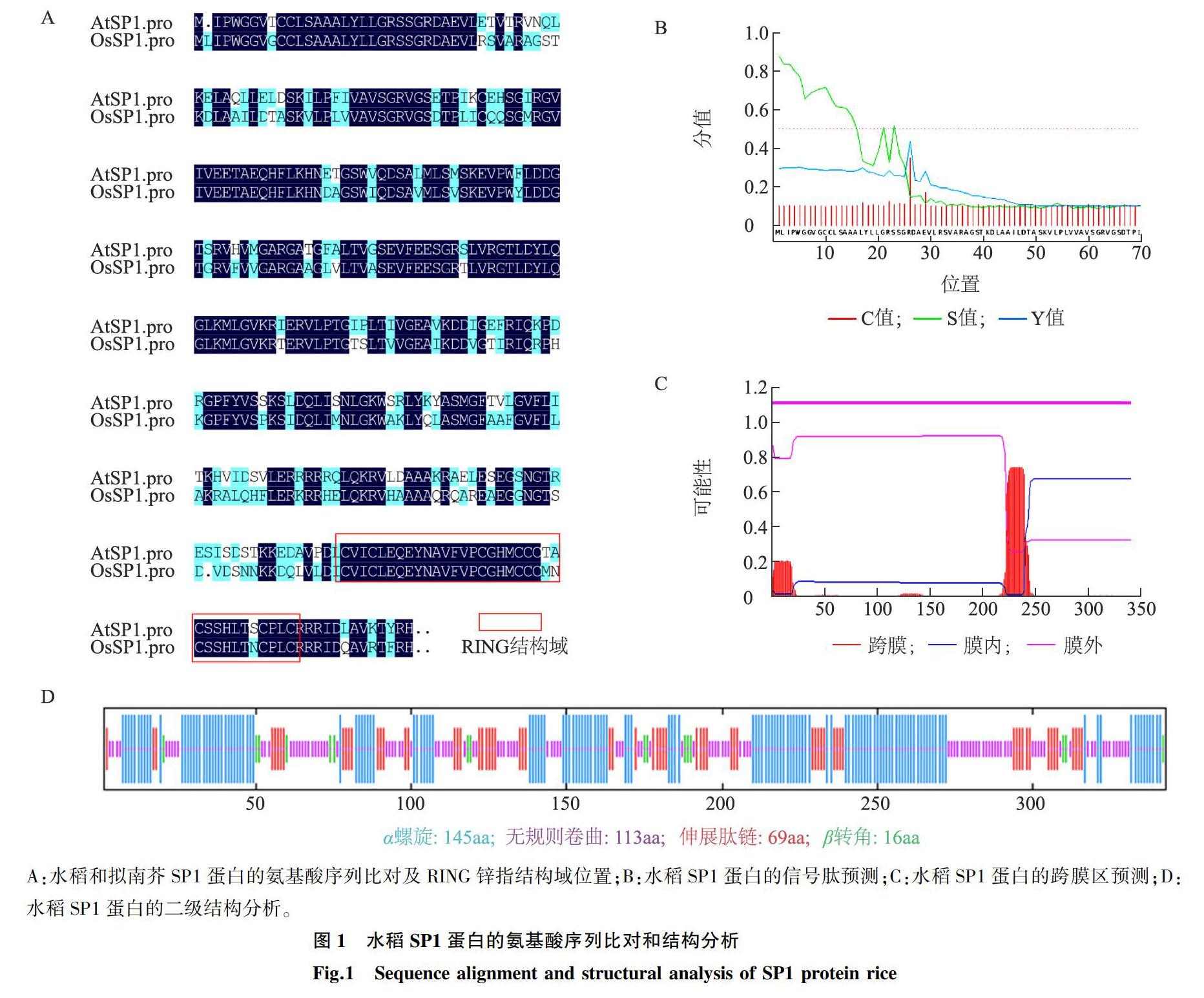
参照拟南芥(Arabidopsis thaliana)的sp1基因(AT1G63900)编码序列和蛋白质氨基酸序列,在NCBI(https://www.ncbi.nlm.nih.gov/)网站通过BLAST功能查找其在水稻基因组中的同源序列。通过DNAMAN软件进行水稻和拟南芥SP1蛋白氨基酸序列同源性分析。利用SignalP软件进行水稻SP1蛋白信号肽位置分析,TMHMM软件进行跨膜区位置预测,SOPMA软件进行二级结构预测。
1.3RNA提取、反转录和Ossp1克隆
正常生长21 d的土培水稻苗,取倒数第二片叶,平行取样3份,混合后快速放入液氮中,然后置于-80 ℃冰箱保存,经Magen试剂盒提取总RNA,Vazyme反转录试剂盒反转录后,cDNA产物作为模板,根据Ossp1的上下游序列设计引物(Ossp1-F:5′-ATGTTGATCCCATGGGGCGG-3′,Ossp1-R:5′-TCAATGGCGGAAAGTTCTC-3′)进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测后,切胶回收目的条带,并将回收产物连接至pMD-18T载体,转化大肠杆菌TOP10感受态细胞,菌液PCR鉴定后,送生物公司测序。
1.4水稻植株的栽培和干旱处理
用于组织表达分析的中花11野生型水稻幼苗,木村营养液培养,每3 d更换1次营养液,培养至三叶一心,冲洗掉根部营养液成分,吸水纸吸干多余水分,每株分别剪下倒数第二片叶片、叶鞘、根,用于RNA提取和组织表达分析。
用于干旱处理的中花11野生型水稻幼苗,木村营养液培养至至一叶一心,栽种于砂土基质(砂与水稻种植用土各一半,施加适量尿素)中继续生长至三叶一心(从发芽起共约21 d),停止供水,开始进行干旱处理,至所有叶片完全卷起和叶片全卷后16 h各取样1次,每次3株,每株剪下倒数第二片叶后快速放入液氮中,然后置于-80 ℃冰箱保存,用于RNA提取和干旱响应性分析。
1.5Real time PCR分析
叶片、叶鞘和根样品按方法1.3的方法进行RNA提取和反转录,cDNA产物用ddH2O稀释10倍,作为模板,以OsActin1(基因登录号:Os03g07181000)作为内参基因,以未经干旱处理的样品作为对照,进行目的基因的Real-time PCR扩增,数据处理采用2-△△Ct法[8],Excel软件和Sigma Plot软件进行分析和作图。Real time PCR反应体系(10 μl):2×SYBR mix(TaKaRa) 50 μl,cDNA 10 μl,F、R引物各05 μl,ddH2O 30 μl。Real time PCR反应条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 30 s,40个循环。Real time PCR扩增使用引物:Ossp1-1210-F:5′-ACTTTCCGCCATTGACA-3′;Ossp1-1379-R:5′-TGCTTCGGCGCAATAC-3′;OsActin1-F:5′-CTTCATAGGAATGGAAGCTGCGGGTA-3′;OsActin1-R:5′-CGACCACCTTGATCTTCATGCTGCTA-3′。
1.6Ossp1-gfp瞬时表达载体的构建
以带有Ossp1编码序列的pMD-18T载体为模板,扩增不含终止密码子TGA的Ossp1编码序列(扩增引物及酶切位点:Ossp1-Spe I-F:5′-TGACACTAGTATGTTGATCCCATGGGGC-3′;Ossp1-Hind-R:5′-TCAGAAGCTTTAGGCGGAAAGTTCTCAC-3′),扩增产物经琼脂糖凝胶电泳检测后,用回收试剂盒回收DNA片段,限制性酶切后,將Ossp1序列连入到pOX载体的35S启动子和gfp序列之间,构建p35S-sp1-gfp-nos表达框。连接产物转化大肠杆菌TOP10菌株,经菌液PCR和核酸序列测定获得阳性克隆。
1.7原生质体的分离和瞬时表达分析
水稻叶鞘细胞原生质体的分离:取生长7 d状态良好的水稻苗,按Zhang等[9]的方法制备原生质体。带有p35S-sp1-gfp-nos表达框的质粒20 μl(总质量10 μg以上),采用PEG介导法[9]转入新鲜制备的水稻原生质体,同时转化带有p35S-gfp表达框的质粒作为对照,28 ℃避光孵育18 h,250 g离心5 min,保留沉淀和少许上清,轻轻摇匀,激光共聚焦显微镜(Carl Zeiss, LSM7 DUO)观察结果并拍照。
2结果与分析
2.1Ossp1基因碱基序列和SP1蛋白氨基酸序列特征
以拟南芥sp1基因的碱基序列和蛋白质氨基酸序列作为参照,经BLAST分析,确定水稻中的同源基因位于7号染色体,基因登录号为Os07g0647800,基因碱基序列全长1 032 bp。水稻SP1蛋白质氨基酸序列由343个氨基酸残基组成,与拟南芥SP1氨基酸残基数相同。DMAMAN等软件分析结果显示,水稻和拟南芥SP1蛋白的氨基酸序列相似度为7118%,其中靠近羧基端的35个氨基酸残基构成RING(Really interesting new gene)型锌指结构域(图1A),水稻SP1蛋白共有2个跨膜区,一个位于氨基端,含25个氨基酸残基(图1B,图1C),为SP1蛋白的信号肽序列,该信号肽与拟南芥SP1信号肽序列基本相同,只有2个氨基酸残基差异,推测SP1蛋白也定位于叶绿体外膜,另一个跨膜区域位于第220~250氨基酸残基处,2个跨膜区之间的肽段位于膜外,第二个跨膜区后的肽段(羧基端)位于膜内侧(图1C)。二级结构预测显示SP1蛋白中含有多段α螺旋结构,占4227%,其余为无规卷曲、伸展性结构以及少量β转角(图1D),分别占3294%、2012%和466%。
2.2Ossp1基因克隆
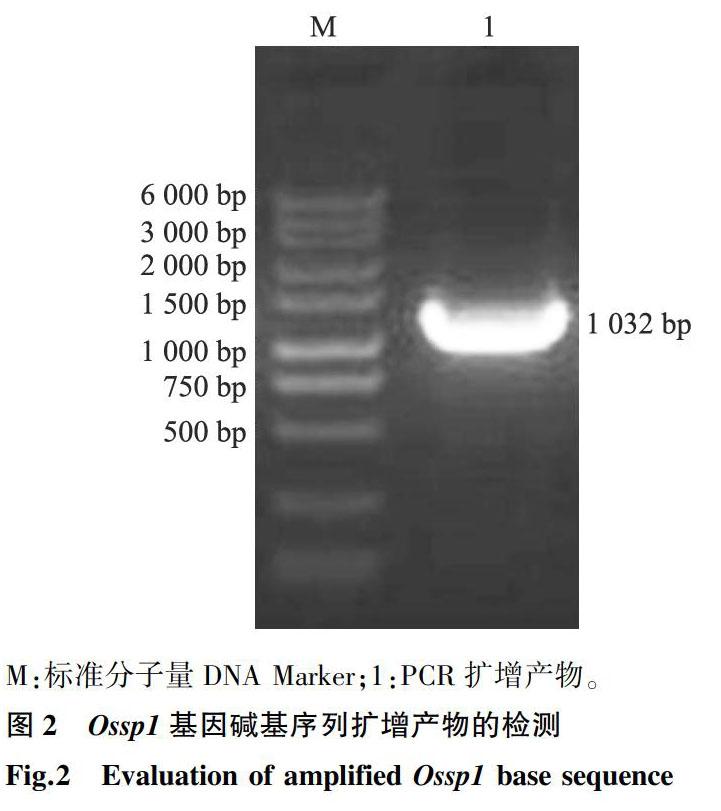
根据生物信息学分析结果,在开放读码框两侧设计特异性引物进行PCR扩增,以反转录获得的cDNA为模板,PCR扩增获得Ossp1的全长碱基序列,产物经回收和测序验证,确定该序列与BLAST分析获得的mRNA序列一致,片段长度为1 032 bp,电泳检测结果见图2。
2.3基因Ossp1的组织表达和干旱响应性分析
野生型水稻幼苗在自然生长条件下经营养液培养至三叶一心后,取根、叶鞘和倒数第二片叶片分析基因Ossp1的组织表达情况。Real time PCR结果显示,目的基因在3种组织中的表达存在差异,在叶片中的表达水平最高,而在根中表达水平最低。Ossp1在正常生长条件下的表达水平均低于内参基因OsActin1,叶中表达水平为OsActin1的0.27倍,叶鞘和根中的表达水平分别为OsActin1的011倍和004倍(图3A)。
在干旱条件下,基因Ossp1的表达水平显著提高。干旱处理至所有叶片完全卷叶时,基因Ossp1的表达水平接近内参基因OsActin1的表达水平,持续干旱至卷叶时间达到16 h时,基因Ossp1表达水平较叶片刚完全卷叶时有所下降,但相比对照仍然较高(图3B)。
2.4Ossp1-gfp载体的构建
为确定SP1蛋白在细胞内的定位情况,我们以绿色荧光蛋白基因gfp作为报告基因,构建了Ossp1与gfp融合的瞬时表达载体。根据SP1蛋白的信号肽分析结果,该蛋白的信号肽位于氨基端,因此我们构建了gfp碱基序列位于Ossp1碱基序列3′端的融合表达载体(羧基端融合),以防止GFP遮蔽信号肽而影响定位。经序列扩增、酶切、连接、转化大肠杆菌并测序后,获得Ossp1碱基序列(不含终止密码子TAG)插入到gfp上游的融合表达载体阳性克隆,载体结构见图4。
2.5水稻SP1蛋白的亚细胞定位
为了分析水稻SP1蛋白在细胞内的定位情况,用构建好的带有p35S-sp1-gfp-nos表达框的质粒转化水稻叶鞘原生质体,同时用p35S-gfp-nos质粒转化水稻叶鞘原生质体作为对照。激光共聚焦显微镜检测结果显示,作为对照的p35S-gfp-nos质粒转化后,GFP蛋白全部定位于细胞质,而p35S-sp1-gfp-nos转化后,SP1-GFP融合蛋白出现的区域与叶绿素自发荧光区域完全重合,表明融合蛋白已经定位到叶绿体(图5),可以确定SP1蛋白定位于叶绿体。
3讨论
叶绿体是植物最重要的细胞器之一,是植物进行光合作用的场所,此外还涉及植物的氨基酸代谢、脂肪酸代谢和胁迫信号ROS的产生[10]。叶绿体是半自主性细胞器,其自身基因组负责约100种蛋白质的合成,其余绝大多数蛋白质通过核基因编码,在细胞质合成后转运到叶绿体内[11]。
在过去的几十年里,核基因编码的蛋白质向叶绿体的转运过程已经大致研究清楚。叶绿体的外膜和内膜上共结合有十几种转运蛋白,外膜上的转运蛋白统称为TOC,内膜上的转运蛋白统称为TIC,两类蛋白均有多个成员,这些成员在分子量、分子结构和转运功能方面均有差别[12]。TOC和TIC形成的转运复合体可以识别叶绿体蛋白质的N端信号肽,引导蛋白质进入叶绿体,并进一步定位到叶绿体基质、类囊体膜、类囊体基质等部位[13]。
在植物生长发育过程中,以及对各种胁迫作出响应的过程中,叶绿体都需要对其蛋白质组及时进行动态调整,以适应体内体外生理生化条件的变化[14]。一直以来,尽管人们对叶绿体蛋白质的转入机制已经有深入研究,但是,对叶绿体蛋白质输入调控的过程了解较少。最近几年,Ling等[6-7]陆续报道了拟南芥叶绿体蛋白质输入调控基因sp1的功能,并于2019年报道了完整的拟南芥叶绿体蛋白质输入调控机制,确定植物对叶绿体蛋白质输入的调控是通过控制叶绿体外膜上TOC蛋白的降解实现的[4]。SP1蛋白对TOC蛋白的降解具有关键作用,sp1基因表达量的提高能够促进外膜上TOC数量的下降,并减少叶绿体蛋白质的输入量[4]。水稻Ossp1基因堿基序列长度、水稻SP1蛋白多肽链的长度均与拟南芥sp1基因和SP1蛋白相同,2种蛋白质的一级结构也具有高度相似性,BLAST分析结果显示,Ossp1是水稻基因组中唯一与sp1具有高度相似性的基因,因此,可以确定Ossp1为sp1在水稻中的同源基因。
拟南芥SP1蛋白是泛肽E3连接酶家族成员[15],并且属于RING(Really interesting new gene)型E3连接酶,酶分子中均含有RING结构域,这是一种锌指结构域,与酶分子和其他蛋白质的互作功能及泛肽化功能有关,多数RING型E3连接酶都参与植物的胁迫响应[16-17]。拟南芥sp1基因的表达可在胁迫诱导下提高,sp1过表达植株对盐胁迫耐受性高于野生型植株,而sp1突变植株则出现耐受性下降表型,表明该基因不仅参与正常生长条件下的叶绿体蛋白质输入调控,还参与植物的逆境胁迫响应。本研究通过序列对比,确定水稻SP1具有与拟南芥SP1相同的RING结构域,因此可以确定水稻SP1也属于RING型E3连接酶。转录分析结果表明,Ossp1的表达具有明显的干旱响应性特征,在干旱条件下,Ossp1的表达量可以提高到正常条件下的4倍左右,表明该基因参与了水稻的干旱响应过程。此外,根据亚细胞定位结果,结合信号肽预测结果,可以确定水稻SP1定位在叶绿体,并且信号肽位于肽链N端,与拟南芥SP1的信号肽位置和定位相同。
水稻是中国最重要的粮食作物之一,干旱、高盐等各类逆境条件对水稻的生长和产量影响严重[18-19]。本研究结果显示了基因Ossp1与水稻叶绿体及水稻干旱胁迫响应之间的关系,为进一步的基因功能研究和揭示水稻叶绿体蛋白质输入调控机制奠定了基础。目前,我们已经通过转基因技术开展了Ossp1基因过量表达植株和转基因植株的培育,以期通过转基因植株对Ossp1基因的功能进行更为深入的研究。
参考文献:
[1]JARVIS P, KESSLER F. Mechanisms of chloroplast protein import in plants[M].New York: Springer, 2014: 241-259.
[2]WATSON S J, SOWDEN R G, JARVIS P. Abiotic stress-induced chloroplast proteome remodelling: a mechanistic overview[J]. Journal of Experimental Botany, 2018, 69(11): 2773-2781.
[3]LEE S, LEE D W, LEE Y, et al. Heat shock protein cognate 70-4 and an E3 ubiquitin ligase, CHIP, mediate plastid-destined precursor degradation through the ubiquitin-26S proteasome system in Arabidopsis[J]. Plant Cell, 2009, 21(12):3984-4001.
[4]LING Q, BROAD W, TRSCH R, et al. Ubiquitin-dependent chloroplast-associated protein degradation in plants[J]. Science, 2019, 363(6429):4467.
[5]KESSLER F. Chloroplast delivery by UPS[J]. Science, 2012, 338(6107):622-623.
[6]LING Q, WEIHUA H, AMY B, et al. Chloroplast biogenesis is regulated by direct action of the ubiquitin-proteasome system[J]. Communicative & Integrative Biology, 2013, 338(2):655-659.
[7]LING Q, JARVIS P. Regulation of chloroplast protein import by the ubiquitin E3 ligase SP1 is important for stress tolerance in plants[J]. Current Biology, 2015, 25(19):2527-2534.
[8]SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nat Protoc, 2008, 3(6):1101-1108.
[9]ZHANG Y, SU J, DUAN S, et al. A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes[J]. Plant Methods, 2011, 7(1):30.
[10]BOSE J, MUNNS R, SHABALA S, et al. Chloroplast function and ion regulation in plants growing on saline soils: Lessons from halophytes[J]. Journal of Experimental Botany, 2017, 68(12): 3129-3143.
[11]LEE D W, HWANG I. Evolution and design principles of the diverse chloroplast transit peptides[J]. Molecules & Cells, 2018, 41(3):161-167.
[12]胥華伟,侯典云. 植物细胞中蛋白质向叶绿体转运的研究进展[J]. 植物学报, 2018, 53(2): 264-275.
[13]CHOTEWUTMONTRI P, REDDICK L E, MCWILLIAMS D R, et al. Differential transit peptide recognition during preprotein binding and translocation into flowering plant plastids[J]. Plant Cell, 2012, 24(7):3040-3059.
[14]JARVIS P, LPEZ-JUEZ E. Biogenesis and homeostasis of chloroplasts and other plastids[J]. Nat Rev Mol Cell Biol, 2013, 14(12): 787-802.
[15]PAN R, HU J. Sequence and biochemical analysis of Arabidopsis SP1 protein, a regulator of organelle biogenesis[J]. Communicative & Integrative Biology, 2017, 10(4): e1338991.
[16]LIM S D, YIM W C, MOON J C, et al. A gene family encoding RING finger proteins in rice: their expansion, expression diversity, and co-expressed genes[J]. Plant Mol Biol,2010, 72(4/5):369-380.
[17]BORJA B, JOSE J, ALBERTO C, et al. ABA inhibits myristoylation and induces shuttling of the RGLG1 E3 ligase to promote nuclear degradation of PP2CA[J]. The Plant Journal, 2019, 98(5): 813-825.
[18]刘艳,孙文涛,隽英华. 控水对水稻生长发育及产量的影响[J].江苏农业科学,2018,46(4):53-55.
[19]李婷,朱长波,李俊伟,等. 海水胁迫对海稻86种子萌发和幼苗生长的影响[J].南方农业学报,2018,49(7):1297-1303.
(责任编辑:陈海霞)

