红泡刺藤不同部位总黄酮提取及其抗氧化性
宋志姣 李志强 李建珊 李悦 杨丽华 章金龙 李晓娇

摘要:以紅泡刺藤叶片为材料,优化超声波辅助乙醇提取总黄酮的提取工艺;在最优提取条件下探讨红泡刺藤不同器官总黄酮含量和抗氧化性差异。通过正交试验,确定了红泡刺藤叶总黄酮最佳提取工艺:乙醇体积分数40%,料液比1∶30 (g/ml),超声波提取功率175 W,超声波提取时间45 min。在此条件下红泡刺藤根、茎、叶和果实总黄酮含量分别为24.66 mg/g、19.06 mg/g、28.07 mg/g和4.05 mg/g。红泡刺藤根、茎、叶和果实的总黄酮具有较强的抗氧化活性,对羟基自由基有很好的清除效果,其IC50值分别为1.620 mg/L、0.537 mg/L、3.655 mg/L和1.499 mg/L,清除能力排序为茎总黄酮>果实总黄酮>根总黄酮>叶总黄酮;其DPPH自由基的IC50值分别为7.856 mg/L、3.559 mg/L、5.481 mg/L和5.574 mg/L,清除能力大小为茎总黄酮>叶总黄酮>果实总黄酮>根总黄酮,抗氧化性均显著高于VC。
关键词:红泡刺藤;总黄酮;提取工艺;抗氧化活性
中图分类号:S567.9文献标识码:A文章编号:1000-4440(2020)03-0727-06
Extraction of total flavonoids from different parts of Rubus niveus and evaluation of antioxidant activity
SONG Zhi-jiao,LI Zhi-qiang,LI Jian-shan,LI Yue,YANG Li-hua,ZHANG Jin-long,LI Xiao-jiao
(College of Resources and Environmental Sciences, Baoshan University, Baoshan 678000, China)
Abstract:In this study, the leaves of Rubus niveus were used as test materials, and the extraction process of total flavonoids by ultrasound-assisted extraction(UAE) with ethanol was optimized. Herein, the comparison of the total flavonoids contents and antioxidant activities in different organs of R. niveus was carried out under the optimal conditions. Four factors (ethanol concentration, ratio of material to ethanol, ultrasonic power and extraction time) were evaluated to determine the optimal extraction conditions by using orthogonal design. The optimal extraction conditions were as follows: concentration of ethanol was 40%, material to ethanol ratio was 1∶30 (g/ml), ultrasonic power was 175 W, and extraction time was 45 min. Under the optimal extraction conditions, the total flavonoids contents in roots, stems, leaves and fruits of R. niveus were 24.66 mg/g, 19.06 mg/g, 28.07 mg/g and 4.05 mg/g, respectively. The total flavonoids extracted from roots, stems, leaves and fruits showed strong antioxidant activity and high hydroxyl radical scavenging activity, and IC50 values were 1.620 mg/L, 0.537 mg/L, 3.655 mg/L and 1.499 mg/L, respectively. Thus, the hydroxyl radical scavenging abilities of extracts followed the order of stems>fruits>roots>leaves. In the DPPH free radical scavenging assay, the IC50 values of these organs were 7.856 mg/L, 3.559 mg/L, 5.481 mg/L and 5.574 mg/L. The DPPH free radical scavenging abilities of extracts followed the order of stems>leaves>fruits>roots. The results also showed that the antioxidant activities of total flavonoids in these different organs were significantly higher than VC.
Key words:Rubus niveus Thunb.;total flavonoids;extraction process;antioxidant activity
红泡刺藤(Rubus niveus)是蔷薇科(Rosaceae)悬钩子属(Rubus)植物[1],是广泛分布于中国西南各省的一个小规模栽培利用种,其果实营养价值丰富[2]。悬钩子属植物因富含黄酮类、萜类、酚酸类和甾体等生物活性成分,近年来成为研究热点[3-5]。其中,总黄酮是2个具有酚羟基的苯环通过中央3个碳原子相互连接在一起的黄酮类化合物的总称,是植物重要的次级代谢产物[6-7]。黄酮具有抗炎症、抗过敏、抑制细菌、防治心脑血管疾病和抗肿瘤等功效[8-11],在食品工业、代谢工程和医药方面均有大量应用[12-14]。
悬钩子属植物总黄酮含量丰富:春、秋两季山莓(Rubus corchorifolius)叶的总黄酮含量分别为1.46 mg/g和2.03 mg/g[15];刺萼悬钩子(Rubus alexeterius)枝条的总黄酮含量为38.95 mg/g[16]。不同悬钩子植物总黄酮的单体组成和含量不同:从提取自多腺悬钩子(Rubus phoenicolasius)的总黄酮中分离得到了8种黄酮类单体成分[17];从掌叶复盆子(Rubus chingii)的粗提物中分离鉴定出18种化合物,包括7种黄酮类物质[18]。然而,对于分布广泛的红泡刺藤,其研究和利用仍主要集中在果实品质方面[19-20],总黄酮提取和抗氧化性评价研究尚未见报道。
本研究以乙醇水溶液为提取剂,在超声波辅助下以正交试验优化红泡刺藤总黄酮提取工艺,在研究红泡刺藤根、茎、叶、果实的总黄酮含量的同时比较不同部位粗提液的抗氧化活性,以期为红泡刺藤综合利用提供参考。
1材料与方法
1.1试验材料与主要试剂
2018年6至7月在保山市施甸县水长乡(北纬24°55′35″,东经99°04′41″,海拔1 590 m)采集红泡刺藤根、茎、叶和果实。其中,根、茎、叶在45 ℃条件下烘干至恒质量后粉碎,过60目筛,密封保存;果实由于含水和含糖量较高,在-20 ℃条件下冷冻干燥至恒质量后粉碎,过60目筛,密封存放于4 ℃冰箱。芦丁标准品,由北京索莱宝科技有限公司生产;DPPH(1,1-二苯基-2-三硝基苯肼,1,1-diphenyl-2-trinitrophenylhydrazine),由上海梯希爱化成工业发展有限公司生产;VC,由国药集团化学试剂有限公司生产。无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝、硫酸亚铁、水杨酸和过氧化氢皆为分析纯,试验所用水均为去离子水。
1.2主要仪器及设备
UV-2600紫外-可见分光光度计由日本岛津公司生产,SK250HP超声仪由上海科导超声仪器有限公司生产,DHG-9030A电热鼓风干燥箱由上海一恒科学仪器有限公司生产,FD-1冷冻干燥机由北京德天佑科技发展有限公司生产,TDL-5-A离心机由上海安亭科学仪器厂生产,CP214分析电子天平由奥豪斯仪器有限公司生产,HH-4数显恒温水浴锅由常州国华电器有限公司生产。
1.3试验方法
1.3.1总黄酮含量的测定以NaNO2-Al(NO3)3络合分光光度法测定总黄酮含量。为了避免粗提液颜色干扰总黄酮测定,以不加NaNO2的待测液作为参比[21]。显色剂用量参考梁爱军[22]的方法。
1.3.1.1标准溶液的制备准确称取芦丁标准品10.00 mg,用乙醇溶解并定容至25 ml,配制质量浓度为400 μg/ml的芦丁标准液。
1.3.1.2标准曲线的绘制准确量取0 ml、0.50 ml、1.00 ml、1.50 ml、2.00 ml、2.50 ml的芦丁标准液于10 ml容量瓶中,加0.3 ml 5%亚硝酸钠溶液,5 min后加入0.3 ml 10%硝酸铝溶液,5 min后加入3 ml 10%氢氧化钠溶液并定容至刻度线,显色40 min后取中间质量浓度样液和待测样品溶液于200~780 nm扫描波长,以确定最佳吸收波长。在最佳吸收波长下测定标准品的吸光度,绘制标准曲线。
1.3.1.3操作误差考察分别准确移取0.50 ml同质量浓度标准液6份,按标准曲线绘制操作步骤,分别在最大吸收波长下测定吸光度,考察操作误差。
1.3.1.4仪器读数误差及最佳显色时间考察准确量取标准溶液2.00 ml进行显色反应,分别在显色10 min、25 min、40 min、55 min、70 min和85 min時测定其吸光度,每次测定读数5次,考察仪器精密度,并确定最佳显色时间。
1.3.2提取工艺优化以干燥的红泡刺藤叶片粉末为材料优化总黄酮提取工艺。在单因素试验确定因素水平的基础上建立L9(34)正交试验,因素和水平见表1。具体提取步骤为:准确称取红泡刺藤叶片干样1.000 0 g,按正交试验设计表的参数提取红泡刺藤叶片总黄酮,提取液抽滤后定容至100 ml。准确移取5.00 ml粗提液按方法1.3.1.2进行显色和测定,每因素3重复。
1.3.3红泡刺藤各部位总黄酮的提取以最优工艺分别提取红泡刺藤根、茎和果实中的总黄酮并进行含量测定。
1.3.4抗氧化活性比较红泡刺藤根、茎、叶和果实总黄酮对羟基自由基和DPPH自由基清除能力测定参考荆常亮[23]和熊双丽等[24]的方法进行。
1.4数据处理
所有数据用Microsoft Excel 2016绘制图表,用SPSS16.0对数据进行统计分析。
2结果与分析
2.1总黄酮含量测定方法
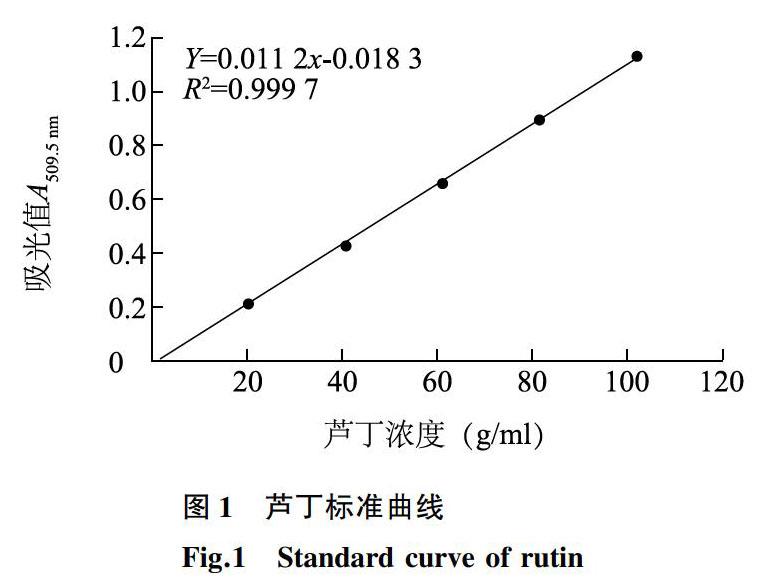
于200~780 nm范围内对芦丁标准液进行光谱扫描,结果显示标准溶液于509.5 nm波长处有较为平滑的吸收峰。因此,在509.5 nm波长下测定和绘制一元线性回归方程:Y=0.011 2x-0.018 3,R2=0.999 7(图1),说明黄酮类物质在质量浓度为0~120.00 μg/ml有良好的线性关系,标准曲线线性拟合较为理想,可以用来对总黄酮进行定量。
分别准确移取0.50 ml芦丁储备液6份于10 ml容量瓶,经显色、测定和计算,得到RSD值为3.84%,表明试验操作误差较小。最佳显色时间试验结果表明,在40 min之前由于反应尚未完全,吸光度随着时间的增大而增大,在40 min之后有色物质随着时间的推移逐渐分解,吸光度逐渐减小,故以40 min为最佳显色时间。精密度试验结果表明UV-2600双光束紫外-可见分光光度计精密度非常好,平均RSD仅为0.02%。说明试验所用方法稳定可靠,可以进行提取工艺优化试验。
2.2红泡刺藤总黄酮提取工艺优化
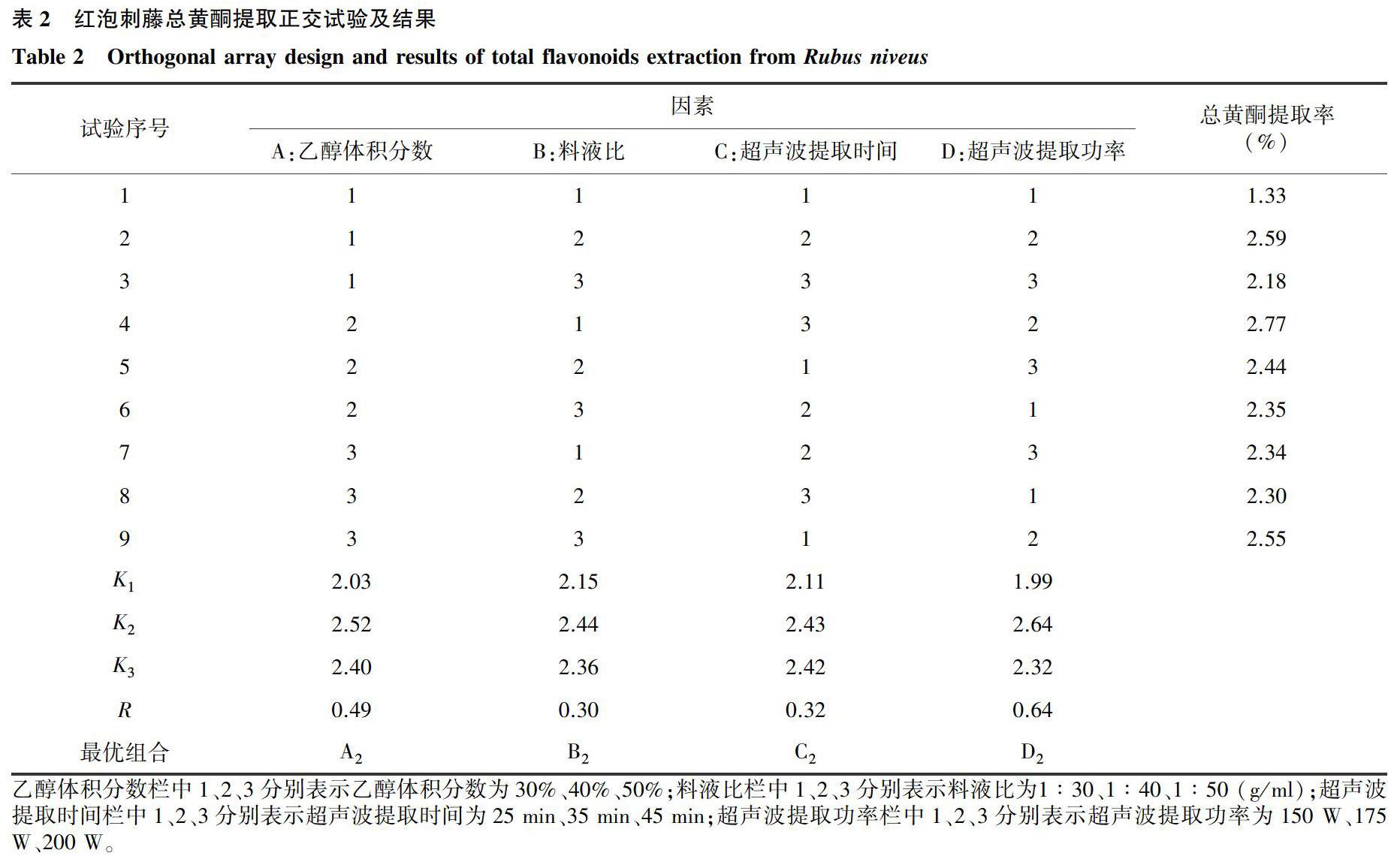
试验结果表明最优提取工艺条件为正交组合A2B1C3D2,而极差分析得出的最优组合条件为A2B2C2D2(表2)。在相同条件下对A2B1C3D2和A2B2C2D2分别进行3次提取以验证试验结果,得到红泡刺藤叶片总黄酮的提取率分别为2.81%和2.78%,无显著差异。从节约提取剂、减少污染和避免浪费的角度建议以A2B1C3D2工艺进行总黄酮提取。因此,最优提取工艺为:乙醇体积分数40%,料液比1∶30 (g/ml),超声波提取功率175 W,超声波提取时间45 min。
由极差分析和方差分析结果可知,在试验因素和水平范围内,各因素对红泡刺藤叶片总黄酮提取率影响的顺序为D>A>C>B(表2、表3)。方差分析结果表明:超声波提取功率和乙醇体积分数对提取率有显著影响,料液比和超声波提取时间对总黄酮提取率影响不显著。理论最优组合A2B2C2D2和试验最优组合A2B1C3D2 2个工艺,在2个显著影响总黄酮提取率的参数上一致,也从侧面说明了其余2个因素不显著影响提取率。由此可知,在红泡刺藤叶片总黄酮提取过程中,适宜的超声波提取功率和乙醇体积分数是总黄酮提取的关键。
2.3红泡刺藤根、茎、叶、果实总黄酮含量比较
以最优工艺提取红泡刺藤根、茎、叶、果实总黄酮。测定结果显示,红泡刺藤不同器官的总黄酮含量差异显著(图2),其中叶片总黄酮含量最高,为28.07 mg/g,根为24.66 mg/g,茎为19.06 mg/g,果实总黄酮含量最小为4.05 mg/g,约为叶片的1/7。因此,在以总黄酮为主的提取和应用过程中,建议以红泡刺藤叶片为原料。
乙醇體积分数栏中1、2、3分别表示乙醇体积分数为30%、40%、50%;料液比栏中1、2、3分别表示料液比为1∶30、1∶40、1∶50 (g/ml);超声波提取时间栏中1、2、3分别表示超声波提取时间为25 min、35 min、45 min;超声波提取功率栏中1、2、3分别表示超声波提取功率为150 W、175 W、200 W。
不同字母表示不同器官总黄酮含量显著差异(P<0.05)。
2.4红泡刺藤总黄酮抗氧化活性
2.4.1总黄酮对羟基自由基的清除羟基自由基是一种重要的活性氧[25-26],是氢氧根失去一个电子后形成的,羟基自由基可与水杨酸反应生成紫色的2,3-二羟基苯甲酸[27]。羟基自由基的清除过程是电子转移的过程,如果反应体系中存在着像总黄酮这样的抗氧化剂,总黄酮与羟基自由基反应生成的产物无色,反应体系吸光度下降。抗氧化剂的抗氧化能力越强,反应体系颜色越浅。对羟基自由基清除试验中,在最大吸收波长525.5 nm下,红泡刺藤根、茎、叶和果实总黄酮粗提液对羟基自由基清除能力都随总黄酮质量浓度增加而增大(图3)。红泡刺藤根、茎、叶、果实总黄酮及VC对羟基自由基清除的半数抑制质量浓度(IC50值)分别为1.620 mg/L、0.537 mg/L、3.655 mg/L、1.499 mg/L和40.776 mg/L,清除能力大小为茎总黄酮>果实总黄酮>根总黄酮>叶总黄酮>VC。相同质量浓度的红泡刺藤根、茎、叶和果实总黄酮提取物的羟基自由基清除能力之间均存在极显著差异(P<0.01)。
VC的质量浓度为总黄酮质量浓度的5倍。
2.4.2总黄酮对DPPH自由基的清除DPPH自由基在乙醇溶液中处于稳定状态,溶液有颜色。如果反应体系中有可以提供H+的物质存在,则DPPH自由基被还原为DPPH-H,溶液颜色减弱或消失[7,28]。对DPPH自由基清除试验中,在520 nm最佳吸收波长下,红泡刺藤根、茎、叶、果实乙醇粗提液清除DPPH自由基的能力都随总黄酮质量浓度增加而增大。通过计算得到红泡刺藤根、茎、叶、果实总黄酮及VC对照对DPPH自由基的半数抑制质量浓度(IC50值)分别为7.856 mg/L、3.559 mg/L、5.481 mg/L、5.574 mg/L和133.777 mg/L,清除能力大小为茎总黄酮>叶总黄酮>果实总黄酮>根总黄酮>VC(图4)。每个质量浓度梯度中,红泡刺藤各部位总黄酮的DPPH自由基清除能力均极显著大于2倍质量浓度的VC。
VC质量浓度为总黄酮质量浓度的2倍。
3讨论
通过正交试验得到超声波辅助乙醇提取红泡刺藤总黄酮的最佳提取工艺参数为:乙醇体积分数40%,料液比1∶30 (g/ml),超声波提取时间45 min,超声波提取功率175 W。在此条件下红泡刺藤总黄酮含量可达28.07 mg/g(叶片)、24.66 mg/g(根)、19.06 mg/g(茎)、4.05 mg/g(果实),不同器官总黄酮含量差异显著。红泡刺藤各个器官的总黄酮对羟基自由基、DPPH自由基均有较好的清除能力,根、茎、叶、果实总黄酮对羟基自由基的半数抑制质量浓度(IC50值)分别为1.620 mg/L、0.537 mg/L、3.655 mg/L和1.499 mg/L,清除能力大小顺序为茎总黄酮>果实总黄酮>根总黄酮>叶总黄酮;对DPPH自由基的半数抑制浓度(IC50值)分别为7.856 mg/L、3.559 mg/L、5.481 mg/L和5.574 mg/L,清除能力大小顺序为茎总黄酮>叶总黄酮>果实总黄酮>根总黄酮。
试验测得红泡刺藤果实总黄酮含量为4.05 mg/g,高于红树莓果实的1.52 mg/g[29];叶片总黄酮含量为28.07 mg/g,高于五月份新疆树莓叶片的2.116 mg/g[30]和湖南省秋季山莓叶的2.03 mg/g。其原因可能是悬钩子属植物不同种间存在差异,红泡刺藤的总黄酮含量高于上述几种悬钩子属植物,也有可能是不同产地和不同生长期的悬钩子总黄酮含量的动态变化所致。
抗氧化性试验结果表明,红泡刺藤各个器官总黄酮粗提液清除自由基的能力与总黄酮质量浓度呈明显的计量效应,与树莓提取物抗氧化能力试验结果相同[31]。但红泡刺藤不同器官提取的总黄酮的羟基自由基和DPPH自由基清除能力表现不同:对羟基自由基清除能力表现为茎总黄酮>果实总黄酮>根总黄酮>叶总黄酮,对DPPH自由基清除能力表现为茎总黄酮>叶总黄酮>果实总黄酮>根总黄酮。这可能是因为粗提液中黄酮单体种类和含量不一所致。竹叶中黄酮提取物的抗氧化性研究结果也显示同一浓度的粗提物在几个抗氧化指标中表现和排序不一致的情况[32]。也可能是由于羟基自由基和DPPH自由基清除率分别考察的是粗提物的得电子能力和供氢能力,不同粗提物在这2个能力上存在差异。研究结果表明红泡刺藤总黄酮具有良好的抗氧化能力。
致谢:本研究得到国家留学基金资助!
参考文献:
[1]俞德浚,陆玲娣,谷粹芝,等.中国植物志[M]. 北京:科学出版社,1983:10-218.
[2]顾姻.悬钩子属植物资源及其利用[J].植物资源与环境,1992(2):50-60.
[3]刘敬,李水清,赵斌,等.近5年悬钩子属植物化学成分研究进展[J].时珍国医国药,2017,28(5):1195-1197.
[4]MELIM C,GUIMARES K,MARTIN-QUINTAL Z,et al. Antimicrobial activity of extracts and fractions from aerial parts of selected plants (Garcinia achachairu,Macrosiphonia velame,Rubus niveus and Pilea microphylla) against some pathogenic microorganisms[J]. Natural Product Communications,2014,8(11):1567.
[5]石永芳.覆盆子的营养成分和药理作用的研究进展[J].山东化工,2017,46(6):71-72.
[6]孟庆焕.牡丹种皮黄酮提取分离与抗氧化及抗疲劳作用研究[D].哈尔滨:东北林业大学,2013.
[7]张焕新,郑义,殷玲,等.白背三七黄酮类化合物的提取及抗氧化性评价[J].江苏农业学报,2019,35(4):933-939.
[8]王博.黄酮类化合物体外抗过敏活性筛选及人参黄酮分离纯化研究[D].长春:吉林大学,2018.
[9]MAHUNU G K. Effect of bamboo leaf flavonoid and phytic acid on the control efficacy of Pichia caribbica against Penicillium expansum and patulin content in apple fruits[D].鎮江:江苏大学,2016.
[10]王波,张晓艳,黄攀,等.响应面法优化马齿苋黄酮超声波提取工艺[J].江苏农业学报,2018,34(1):166-171.
[11]BANERJEE K,BANERJEE S,MANDAL M. Enhanced chemotherapeutic efficacy of apigenin liposomes in colorectal cancer based on flavone-membrane interactions[J]. Journal of Colloid and Interface Science,2017,491:98-110.
[12]AHN-JARVIS J H,PARIHAR A,DOSEFF A I. Dietary flavonoids for immunoregulation and cancer: food design for targeting disease[J]. Antioxidants,2019,8(7):202.
[13]周天山.茶树类黄酮3-羟基化酶功能分析及其在代谢工程中的应用[D].杨凌:西北农林科技大学,2016.
[14]方一杰,徐岩成,安毛毛,等.黄酮类化合物的药动学和药理作用研究进展[J].药学服务与研究,2015,15(1):6-9.
[15]李丹.山莓叶总黄酮的提取、纯化及降血糖作用研究[D].长沙:湖南农业大学,2009.
[16]李蕾,孙美利,王和宇,等.刺萼悬钩子枝总黄酮的超声提取工艺[J].医药导报,2016,35(1):79-82.
[17]骆桂法,刘超,纪兰菊.多腺悬钩子黄酮类化学成分研究[J].西北药学杂志,2014,29(1):5-8.
[18]肖洪明,祖灵博,李石平,等.掌叶覆盆子化学成分的研究[J].中国药物化学杂志,2011,21(3):220-226.
[19]张良英,刘林,牛歆雨.西藏几种野生树莓的果实性状评价[J].种子,2016,35(8):70-71,75.
[20]王仕玉,段修安,张泽,等.六种滇产悬钩子的果实品质评价[J]. 北方园艺,2008(6):7-9.
[21]张永顺,田志梅,赵树水.铝盐显色法测定山楂汁饮料中总黄酮[J].中国公共卫生,1995(3):127.
[22]梁爱军.紫外-可见分光光度法测定沙棘叶总黄酮含量的优化试验[J].山西林业科技,2018,47(3):11-13,17.
[23]荆常亮.紫花苜蓿总黄酮的提取、纯化及其抗氧化活性研究[D].北京:中国农业科学院,2016.
[24]熊双丽,马楠,廖婷婷,等.豆腐柴葉总黄酮不同溶剂级分抗氧化活性分析[J].食品工业科技,2017,38(18):19-24.
[25]刘孝平,邹雨珂,刘璐,等.不同品种罗望子果肉和种子多糖结构及抗氧化活性比较[J].南方农业学报,2019,50(8):1807-1813.
[26]何婷婷,柴军红,钟读波,等.蒲公英活性成分提取工艺的优化、多糖红外表征及其抗氧化性[J].江苏农业科学,2018,46(11):163-166.
[27]CHIMI H,CILLARD J,CILLARD P,et al. Peroxyl and hydroxyl radical scavenging activity of some natural phenolic antioxidants[J]. Journal of the American Oil Chemists Society,1991,68(5):307-312.
[28]YAO Y,YANG X,TIAN J,et al. Antioxidant and antidiabetic activities of black mung bean (Vigna radiata L.)[J]. Journal of Agricultural & Food Chemistry,2013,61(34):8104-8109.
[29]白立敏.红树莓总黄酮的提取、纯化及抗氧化性的研究[D].兰州:甘肃农业大学,2008.
[30]李转红.树莓化学成分及其抗氧化活性和PTP1B抑制活性的研究[D]. 石河子:石河子大学,2015.
[31]王睿婷,王鑫,张富敏,等.树莓的抗氧化活性与主要化学成分的相关分析[J].沈阳药科大学学报,2013,30(11):901-905.
[32]欧阳吾乐,雷福红,杨亚晋,等.4种竹叶营养成分分析及其黄酮提取物体外抗氧化活性研究[J].天然产物研究与开发,2019,31(10):1669-1674,1830.
(责任编辑:张震林)

