鹅星状病毒SYBR Green I荧光定量RT-PCR方法的建立
白彩霞 张达 赵靓 杨侃侃 王小朋 李新路 李锦春 李永东 王勇


摘要:為建立快速检测鹅星状病毒(GAstV)的方法,本研究根据GenBank中GAstV ORF2基因序列设计1对特异性引物,构建重组质粒pMD19-T-GAstV,以其作为标准品建立了GAstV的SYBR Green I荧光定量RT-PCR检测方法。优化其反应条件及体系,进行特异性、敏感性和重复性试验以及临床样本检测。试验结果显示,除GAstV外,禽白血病病毒(ALV)、血清4型禽腺病毒(FAdV-4)、鸡传染性喉气管炎病毒(ILTV)和鸡传染性贫血病病毒(CIAV)等常见禽病病原利用该方法检测均呈阴性,表明其特异性良好;建立的荧光定量RT-PCR检出的最低模板含量为1 μl 3.75×101拷贝,敏感性较高;组内和组间重复性试验变异系数均小于1 %。利用该方法对来自安徽地区的32份临床样品进行检测,阳性检出率为43.75%,常规PCR方法阳性检出率为18.75%,阳性检出符合率100%,表明该方法可用于临床样品检测。该方法的建立为临床样品中GAstV的快速高效检测提供了技术支持。
关键词:鹅星状病毒;SYBR Green I 荧光定量RT-PCR;检测
中图分类号:S858.33文献标识码:A文章编号:1000-4440(2020)03-0634-05
Development and application of SYBR Green I fluorescence quantitative RT-PCR assay for detection of goose astrovirus
BAI Cai-xia1,ZHANG Da1,ZHAO Liang1,YANG Kan-kan1,WANG Xiao-peng1,LI Xin-lu1,LI Jin-chun1,LI Yong-dong2,WANG Yong1
(1.College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, China;2.Ningbo Municipal Center for Disease Control and Prevention, Ningbo 315010, China)
Abstract:In order to rapidly detect the goose astrovirus (GAstV), the SYBR Green I fluorescence quantitative RT-PCR method was established. Firstly, a pair of specific primers was designed based on the ORF2 gene sequence of the GAstV in GenBank. Secondly, the recombinant plasmid pMD19-T-GAstV was constructed and used as a standard template to generate the standard curve. The reaction conditions and reaction system were optimized, the specificity, sensitivity and reproducibility of the assay were tested. Moreover, the established assay was used in clinical samples detection. The results showed that the detection results of fowl adenovirus serotype 4(FAdV-4), infectious laryngotracheitis virus(ILTV), avian leukosis virus(ALV), chicken infectious anemia virus(CIAV) and other common avian pathogens were negative except the GAstV. It indicated that the assay had good specificity. The lowest template content detected by fluorescence quantitative RT-PCR assay was 3.75×101 copies per milliliter. The variation coefficients in the repeatability test were less than 1%. Thirty-two clinical samples from Anhui province were tested using this assay. The positive detection rate was 43.75%, the positive rate of conventional PCR was 18.75%, and the coincidence rate was 100%. In conclusion, the established assay provides technical support for the rapid and efficient detection of GAstV in clinical samples.
Key words:goose astrovirus(GAstV);SYBR Green I flucrescence quantitative RT-PCR;detection
星状病毒(Astroviruses,AstV)属于星状病毒科,为无囊膜、单股正链RNA病毒[1]。基因组全长6.9~7.9 kb,包括5′UTR,3个开放阅读框ORF1a、ORF1b、ORF2,3′UTR及多聚腺苷酸(polyA)尾[2]。可根据感染宿主的不同分为哺乳动物星状病毒和禽类星状病毒。哺乳動物星状病毒包括人类、猫、猪、羊和水貂星状病毒;禽类星状病毒包括鸡、鸭、火鸡星状病毒及禽肾炎病毒[3-5]。2017年中国多个省份的鹅养殖场暴发一种以内脏和关节出现尿酸盐沉积为主要临床特征的新发疾病,该病造成雏鹅的大量死亡,给养鹅业带来巨大的经济损失。该病主要发生在5~20日龄的雏鹅,死亡率最高可达50%[6-7]。患病雏鹅精神沉郁,采食量减少,关节肿大;尸检可见内脏器官大量尿酸盐沉积,尤其是肝脏、心脏及肾脏[8]。Niu等首次从病鹅组织中分离出一种新型的鹅源星状病毒(Goose astrovirus,GAstV)[6-7]。
目前尚无针对该病的治疗措施及疫苗,防治重点在于疫情的检测和控制。因此建立一种快速、准确和省时的检测方法对疫情的防控尤为重要。然而目前检测GAstV常用方法是PCR,与荧光定量RT-PCR相比该方法具有交叉污染且耗时长等缺点,不适用于大量临床样品的检测[9-10]。而SYBR Green I荧光定量PCR作为一种通用的病原体检测技术,具有特异性强、敏感性高等优点,能在较短时间内完成病原体检测,已被广泛用于动物疾病的临床诊断。因此,本研究旨在建立一种基于SYBR Green I的实时荧光定量RT-PCR的快速检测GAstV的方法,为GAstV的临床诊断和流行病学调查提供技术支持。
1材料与方法
1.1病毒及临床样品
禽白血病病毒(ALV)、血清4型禽腺病毒(FAdV-4)、鸡传染性喉气管炎病毒(ILTV)、鸡传染性贫血病病毒(CIAV)均由本实验室保存;GAstV感染的鹅心、肝和肾等样品采用文献[6]的方法检测为GAstV阳性后由本实验室保存;疑似GAstV感染的32份心、肝和肾临床样品于2018年采自安徽省不同地区养殖场。
1.2主要试剂
pMD19-T载体、DL600 DNA marker、rTaq DNA聚合酶、Solution I和TB GreenTM Premix DimerEraserTM (Perfect Real Time) 购自 TaKaRa公司,质粒提取试剂盒购自AXYGEN公司,病毒基因组DNA/RNA提取试剂盒购自北京全式金生物技术有限公司,DH5α感受态细胞、普通琼脂糖凝胶DNA回收试剂盒和FastQuant RT Kit(with gDNase)购自TIANGEN公司。
1.3引物的设计与合成
根据GenBank登录的GAstV病毒株(MH052598.1)ORF2阅读框碱基序列,利用Primer Premier5.0软件设计1对特异性引物(F:5′-CGATGAGAAGGAGCAACACA-3′,R:5′-CAGAATTTGAAGCAGCACCA-3′),预期扩增片段为182 bp。引物由通用生物系统(安徽)有限公司合成。
1.4DNA/RNA的提取及cDNA的合成
取适量鉴定为GAstV阳性的心、肝和肾等组织加入含青霉素和链霉素各1 000 IU/ml的PBS用研钵充分碾磨,置于-80 ℃冰箱反复冻融3次,12 000 r/min离心10 min,取上清液,置于-80 ℃冰箱待用。利用病毒基因组DNA/RNA提取试剂盒提取FAdV-4、ILTV病毒基因组DNA,ALV、CIAV、GAstV病毒基因组RNA,反转录为cDNA后与上述病毒DNA分别置于-20 ℃保存。
1.5重组质粒标准品的制备
以提取的鉴定为GAstV阳性的cDNA为模板,采用引物F/R进行常规RT-PCR扩增。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 20 s,30个循环;72 ℃ 10 min。PCR产物经1 %琼脂糖凝胶电泳检测,回收并纯化扩增产物,将其克隆于pMD19-T中,构建重组质粒pMD19-T-GAstV,由南京擎科生物科技有限公司测序鉴定。重组质粒使用紫外分光光度计测定OD260/OD280值,按照拷贝数计算公式(质粒浓度×6.02×1023)/(109×基因组长度×660),计算重组质粒拷贝数。
1.6荧光定量RT-PCR方法的建立与优化
采用TB GreenTM Premix DimerEraserTM (Perfect Real Time) 试剂盒推荐的25 μl反应体系,以出现最小Ct值和最高荧光值以及不出现非特异扩增产物为标准,采用方阵法分别对引物浓度(0.2~1.0 μmol/L)、退火温度(50~60 ℃)、延伸时间(20~32 s)等反应条件进行优化,确定最佳反应条件及体系。
1.7标准曲线和熔解曲线的建立
以10倍倍比稀释为8个梯度(1 μl 3.75×101~3.75×108拷贝)的标准质粒为模板,同时设阴性对照(ddH2O)。用优化后的荧光定量RT-PCR体系及程序进行扩增,每个标准品和阴性对照做3个重复,建立标准曲线。待反应结束后,建立熔解曲线。结果判定标准如下:Ct值≤30并出现特异的扩增曲线和较为一致的熔解曲线,即判定结果为“阳性”;被检样品30
1.8特异性试验
以提取的FAdV-4、ILTV、ALV、CIAV的DNA/cDNA为模板,采用优化后的荧光定量RT-PCR条件进行扩增,同时设置阴性对照(ddH2O)及阳性对照(GAstV),验证该方法的特异性。
1.9敏感性试验
用8个稀释梯度(1 μl 3.75×101~3.75×108拷贝)的标准品为模板,采用优化后的荧光定量RT-PCR体系及程序进行扩增,检测该方法可检出的最低模板拷贝数。同时用常规PCR方法对相同稀释梯度的模板进行扩增,将2种方法的检测结果进行对比,验证本试验建立的荧光定量RT-PCR方法敏感性。
1.10重复性试验
用3个稀释梯度(1 μl 3.75×108、1 μl 3.75×105、1 μl 3.75×102)的标准质粒为模板,每个梯度设置3个重复,在同一时间或者不同时间段检测3次,进行组内和组间重复性试验,计算变异系数以验证该方法的重复性。
1.11临床样品的检测
根据基因组提取试剂盒使用说明书提取32份临床样品基因组,采用本研究建立的荧光定量RT-PCR及常规PCR方法对32份临床样品进行检测,比较二者的检测结果,并计算2种检测方法的符合率。
2结果与分析
2.1重组质粒标准品的鉴定
利用F/R引物,对GAstV阳性病料的基因组cDNA进行PCR扩增,扩增出约182 bp的单一特异性片段,与预期结果一致(图1)。将该目的基因片段克隆至pMD19-T载体中构建重组质粒,质粒测序结果与目的片段序列一致,表明pMD19-T-GAstV重组质粒构建正确。
M:DL600 DNA marker;1:陰性对照;2:GAstV RT-PCR产物。
2.2荧光定量RT-PCR反应条件优化
经优化后确定最佳反应体系为(25.00 μl):TB Green Premix DimerEraser(2×)12.50 μl,上游引物、下游引物(10 mmol/L)各0.75 μl,模板2.00 μl,加入ddH2O补足至25.00 μl。最佳反应条件:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。熔解曲线:65 ℃以0.5 ℃/s升至95 ℃。
2.3标准曲线及熔解曲线分析结果
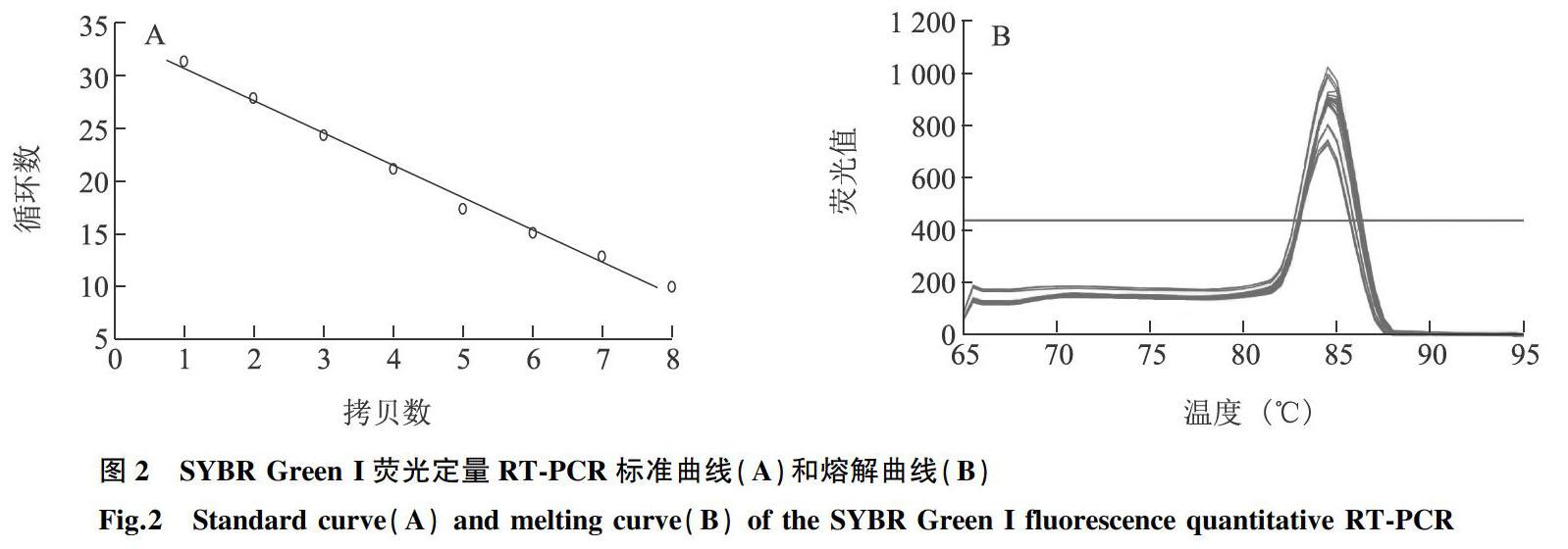
用建立的荧光定量RT-PCR对1 μl 3.75×101拷贝至3.75×108拷贝梯度的GAstV阳性质粒标准品检测,绘制的标准曲线Ct值与标准质粒含量呈良好线性关系(图2A)。相关标准曲线方程:Y=-3.065x+33.738,扩增效率(E)=105%,相关系数(r)=0.993。熔解曲线显示,熔解温度(Tm)在84.5 ℃时出现特异性单峰,无引物二聚体及非特异性产物(图2B)。
2.4特异性试验结果
利用本研究建立的荧光定量RT-PCR方法对几种临床常见禽病病原进行特异性检测,结果显示,仅GAstV出现特异性扩增,其他病原及阴性对照均未出现任何扩增曲线(图3)。表明该方法特异性良好。
2.5敏感性试验结果
敏感性试验结果显示,常规PCR可检测质粒标准品的最低含量为1 μl 3.75×103 拷贝 (图4A),而荧光定量RT-PCR检测质粒标准品的最低含量为1 μl 3.75×101拷贝(图4B),荧光定量RT-PCR的敏感性是常规PCR的100倍。表明本试验建立的荧光定量RT-PCR敏感性较高。
A:荧光定量RT-PCR;B:常规 PCR。1~8: 1 μl 3.75×108 ~3.75×101拷贝;9:阴性对照。
2.6重复性试验结果
利用本研究建立的方法进行重复性试验,结果显示,该方法的组内和组间变异系数均小于1.0%(表1)。表明本研究建立的荧光定量RT-PCR方法有较好的重复性。
2.7临床样品检测结果
在32份疑似GAstV感染病料中,荧光定量RT-PCR检出阳性样品14份,阳性率为43.75%,常规PCR检出阳性样品6份,阳性率为18.75%,两者符合率为100%。表明本研究建立的荧光定量RT-PCR检测方法敏感性更高,可适用于临床检测。
3讨论
截至目前,中国山东、江苏、安徽、河南、辽宁和广东等地区鹅养殖场陆续出现一种以雏鹅痛风为主要症状的急性传染病。先前有研究者指出该病的发生可能是由于超量高蛋白高钙饲料的使用导致[11-12],但实践证明,更换低蛋白饲料后,疫情并未得到改善。直至GAstV被成功分离鉴定[7],才确定真正病因。迄今为止对GAstV致病性及病理机制尚不清楚,因此,建立特异敏感的检测技术,可为后期GAstV的感染机制和致病机理研究奠定基础。
分子生物学技术检测病毒性传染病已广泛应用于临床诊断[13-15]。实时荧光定量PCR是近年来发展起来的一项新的检测技术,在动物疾病的检疫、基因表达分析等各种领域得到广泛的应用[16]。与常规PCR相比,具有快速、灵敏、简便的优点[17]。除此之外,还能够显著减少试验过程中的污染及对人体有致癌危害的EB的使用。该检测技术包括SYBR Green染料法和TaqMan探针法。TaqMan探针需要合成标记有荧光素的探针,成本较高。而SYBR Green是一种结合于双链DNA的荧光染料,在荧光定量PCR反应过程中与扩增产物结合释放荧光信号,通过仪器实时监测,具有灵敏度高、重复性好、操作简单和可定量分析等优点,已成为病毒检测的重要方法。Yuan等[9]建立了TaqMan探针法检测GAstV的实时荧光定量RT-PCR方法,需合成针对性很强的核酸探针,成本较高。本研究建立的方法设计简单,不需要设计探针,更加简便,通过熔解曲线分析即可区分非特异性扩增,而且SYBR Green I染料成本低,可通过计算机软件自动计算定量结果,不需要普通PCR后的电泳检测,操作更加简单、省时。
本研究根据GAstV ORF2基因保守序列设计引物,对已鉴定为GAstV阳性的病料进行普通PCR检测、序列测定及分析,结果显示扩增的目的片段条带单一且与预期片段大小相符,熔解曲线呈现特异性良好的单峰,确定所用引物具有良好的特异性,保证了后续建立检测方法的准确性。在该引物的基础上建立基于SYBR Green I染料法的GAstV 荧光定量RT-PCR检测方法。有资料报道,扩增效率小于105%、决定系数大于0.98、△Ct值变异系数小于10%是评估一种荧光定量PCR标准曲线质量的主要参数[18],精确灵敏度的确定需要满足这3个前提条件。本研究建立的方法扩增效率为105%,相关系数为0.993,精确灵敏度为1 μl 3.75×101拷贝,表明具有良好的线性关系;与禽类常见病原无交叉反应,表明特异性较好;组内和组间变异系数小于1%,表明具有良好的重复性。
综上所述,本研究建立的SYBR Green I荧光定量RT-PCR检测方法,特异性强、灵敏性高、重复性好,能够实现对样品的实时动态检测,自动分析结果,避免了空气中的交叉污染,可在短时间内得出检测结果。该方法的建立为GAstV流行病学调查以及临床诊断提供了有效的技术手段。
参考文献:
[1]YUAN X Y, MENG K, ZHANG Y X, et al. Genome analysis of newly emerging goose-origin nephrotic astrovirus in China reveals it belongs to a novel genetically distinct astrovirus[J]. Infect Genet Evol, 2019, 67:1-6.
[2]PANTINJACKWOOD M J, STROTHER K O, MUNDT E, et al. Molecular characterization of avian astroviruses[J]. Arch Virol, 2011, 156(2):235-244.
[3]SUN N, YANG Y, WANG G S, et al. Detection and characterization of avastrovirus associated with diarrhea isolated from minks in China[J]. Food Environ Virol, 2014, 6(3): 169-174.
[4]MARINA B, DARKO M, ZDENKO B, et al. Genetic characterization of turkey astroviruses identified in Croatian poultry flocks[J]. Vet Archiv, 2013,83(1):57-67.
[5]MARY J P, ERICA S, PETER R W. Molecular characterization and typing of chicken and turkey astroviruses circulating in the United States: Implications for diagnostics.[J]. Avian Dis, 2006, 50(3):397-404.
[6]NIU X Y, TIAN J J, YANG J, et al. Novel goose astrovirus associated gout in gosling, China.[J]. Vet Microbiol, 2018, 220:53-56.
[7]ZHANG Q S, CAO Y X, WANG J, et al. Isolation and characterization of an astrovirus causing fatal visceral gout in domestic goslings[J]. Emerg Microbes Infect, 2018, 7(1):71.
[8]ZHANG X Y, REN D, LI T F, et al. An emerging novel goose astrovirus associated with gosling gout disease, China[J]. Emerg Microbes Infect, 2018, 7(1):152.
[9]YUAN X Y, MENG K, ZHANG Y X, et al. Establishment and application of rapid diagnosis for reverse transcription-quantitative PCR of newly emerging goose-origin nephrotic astrovirus in China[J]. mSphere, 2018, 3(6):e00380.
[10]IAN M M, KATHERINE E A, ANDREAS N. Real-time PCR in virology[J]. Nucleic Acids Res, 2002, 30(6): 1292-1305.
[11]周红英. 一例雏鹅痛风病的诊治[J]. 畜禽业, 2017(7):120-121.
[12]陈英辉. 鹅痛风的发生原因与诊治[J]. 畜牧兽医科技信息, 2017(4):112.
[13]杨慧赞,童桂香,郑晓聪,等. IHHNV PCR检测方法改进及广西流行株基因型分析[J].南方农业学报,2019,50(5):1127-1132.
[14]楚会萌,任亚初,程凯慧,等. 一株牛流行热病毒的分离与鉴定[J].山东农业科学,2019,51(3):111-114.
[15]彭昊,吴翠兰,李军,等. 广西黄牛乳头状瘤病毒的鉴定及其基因组序列分析[J]. 南方农业学报,2018,49(3): 563-571.
[16]周晓俊,朱淮民,邱璐. 检测蚊虫感染黄病毒属病毒Real-time PCR方法的建立[J]. 中国病原生物学杂志, 2008, 3(8):561-563.
[17]CHANDRA B P, RISHI S, VIJAI K G, et al. Q-PCR based culture-independent enumeration and detection of enterobacter: an emerging environmental human pathogen in riverine systems and potable water[J]. Front Microbiol, 2016, 7:172.
[18]DAVID N, MARIO A, LLOREN G R, et al. Dynamics of Torque teno sus virus 1 (TTSuV1) and 2 (TTSuV2) DNA loads in serum of healthy and postweaning multisystemic wasting syndrome (PMWS) affected pigs[J]. Vet Microbiol, 2011, 152(3/4):284-290.
(責任编辑:陈海霞)

