早老素Ps1突变基因对阿尔茨海默病模型鼠表观有效性的影响
胡沿每,刘子重,郭美娜,马思飞,翟鸿儒,宋黄戎,苏令通,薛钦洋,王 琪,王 佳,张维宁
(江苏大学医学院生物化学检验教研室,江苏 镇江 212013)
阿尔茨海默病(Alzheimer’s disease,AD)[1]是一种以认知障碍、进行性记忆衰退为特征的神经系统退行性疾病。AD患者主要表现为记忆力、语言、认知、问题解决能力下降,行为改变等。淀粉样蛋白斑(amyloid-β,Aβ)是AD主要的病理学特征[2]。越来越多的证据[3-4]表明,Aβ累积在大脑形成斑块,导致神经元死亡是AD发病机制中的关键启动因素。
大量文献采用App/Ps1双转基因小鼠B6C3-Tg(APPswePSEN1dE9)/Nju作为阿尔茨海默病的模型动物[5-6],该模型鼠基因型中,含有人类早老素序列Ps1-dE9及人类淀粉样前体蛋白(amyloid precursor protein,APP)基因序列APPswe融合体,这两个基因的表达都由小鼠朊病毒蛋白启动子启动。人类早老素基因的Ps1-dE9突变是该基因的第九个外显子缺失产生的,Wanngren等[7]研究发现,Ps1蛋白可以参与细胞的保护功能,而Ps1基因突变可使γ-分泌酶活性增强从而促进Aβ42的过度合成,加速AD淀粉样蛋白沉淀,导致早发性老年痴呆症。Ps1基因对小鼠脑发育至关重要,Elder等[8]研究报道Ps1基因对正常小鼠脑内神经元,神经干细胞生长起保护作用。App/Ps1双转基因小鼠脑内发现人类早老素蛋白增加并替代了小鼠内源性蛋白,其脑匀浆中还检测到了人源淀粉样前体蛋白[9]。尽管突变的衰老基因ps1-dE9的引入能够更好地诠释阿尔茨海默病模型鼠的机理有效性,然而Ps1对该模型动物的表观有效性的影响国内外尚未见任何报道,因此,当前的研究通过对比App单转基因小鼠及App/Ps1双转基因小鼠在认知、学习、记忆功能及自主活动能力、情绪方面的异同,评价衰老基因Ps1在阿尔茨海默病基因模型鼠研究中的重要作用。
1 材料与方法
1.1 繁殖与饲养SPF清洁级转基因小鼠App/Ps1B6C3-Tg(APPswePSEN1dE9)/NjuAPPswePS EN1d E9(App/Ps1)购于南京生物医药研究院(许可证编号:SCXK (苏)2018-0008),品系背景为B6C3F1,App/Ps1双转基因小鼠雌鼠6只,雄鼠2只。经隔离观察未见异常后进入饲养区,严格按照SPF动物管理相关规定执行。繁育方式:适应1周后,育龄期App/Ps1双转基因小鼠按照雄 ∶雌鼠1 ∶3配对,于20 ∶00 pm合笼,d 2 8 ∶00 am对雌鼠进行阴道栓检查(雌鼠孕龄为19~21 d),繁育后获得的60只子代小鼠,存活57只,即存活率为95%。经PCR鉴定获得两种基因型小鼠:单转基因小鼠App(n=19,获得率=33.3%)与双转基因型小鼠App/Ps1(n=38,获得率=66.7%),37只用于繁育及保种,20只用于后续的行为学实验。
1.2 试剂与仪器琼脂糖(批号:1110GR500,德国BioFroxx公司),PCR仪(美国Applied Biosystems公司),凝胶成像系统(美国Bio-Rad公司),基因组DNA提取试剂盒(碧云天生物技术公司),行为学追踪记录软件(Ethovision8.5,Noldus,荷兰)。
1.3 小鼠基因型鉴定提取出生后6~7 d的小鼠脚趾基因组DNA:(1)乙醇消毒小鼠脚趾,取小鼠脚趾(按1~10的顺序)放入1.5 mL EP管中,适当离心30 s使其沉于管底。(2)加入30 μL裂解液(20% Tween-20 5 mL,1mol/L KCl 10 mL,1mol/L MgCl2 0.5 mL,1mol/L pH 8.0 Tris-HCl 3 mL,双蒸水181.5 mL至总裂解液200 mL,分装成30 μL/EP管),用前30 μL/EP管加入200 mg·L-1蛋白酶K 3 μL;(3)55 ℃水浴消化3~5 h,4 ℃12 000 r·min-1离心2 min,95 ℃取上清液,95 ℃水浴 15 min 以灭活蛋白酶 K,4 ℃ 12 000 r·min-1离心2 min,所获得的上清中DNA用于PCR模板,-20 ℃保存,用于基因型鉴定。以提取的DNA为模板进行扩增,扩增体系:20 μL。采用两对引物1597/1598(App)和1644/1645(Ps1)进行小鼠基因型鉴定。引物1597和1598的序列分别为:5′-GACTGACCACTCGACC AGGTTCTG-3′和5′-CTTGTAAGTTGGATTCTCATATC CG-3′。引物1644和1645的序列分别为5′-AAT AGAGAACGGCAGGAGCA-3′,5′-GCCATGAGGGCAC TAATCAT-3′。PCR反应条件为:95 ℃ 5 min;94 ℃ 30 s,60~65 ℃ 30 s,72 ℃ 40 s,72 ℃ 5 min,35个循环;10 ℃保存。PCR产物行2%琼脂糖凝胶电泳。电泳完成后用Bio Rad凝胶电泳成像仪照相。
1.4 实验分组实验分为两组:App/Ps1双转基因小鼠组及App单转基因小鼠组(6月龄,10只/组)。据前期报道[10],App/Ps1双转基因小鼠生长至6月龄,Aβ开始在脑内沉积。故此,当前的实验选取6月龄的小鼠作为研究对象。本研究中对该基因型的2月龄小鼠和6月龄小鼠脑内Aβ沉积状况做了免疫组化对比,证明App/Ps1双转基因模型鼠的模型建立成功。见Fig 1。

Fig 1 Immunohistochemical comparison of Aβ-amyloid in brain of App/Ps1 double transgenic mice at 2 and 6 months
1.5 行为学实验行为学实验按照以下的顺序进行:旷场实验,高架十字迷宫实验,新物体识/新位置识别实验,Morris水迷宫实验。每只小鼠实验完毕后,用75%乙醇清洁实验用具。
1.5.1旷场实验 本实验主要用于测试小鼠的自主活动行为和探索行为。通过分析软件设置一个大小约长(30 cm) × 宽(30 cm)区域为旷场箱的中央区域,中央区域的四周离旷场箱边缘10 cm。在其上方垂直置有摄像头,可记录小鼠的活动轨迹。通过EthoVision 8.5软件分析小鼠在30 min内活动的总距离及在中央区域活动的距离、频率和速度。
1.5.2高架十字迷宫实验 本实验是利用动物对敞开臂的探究和恐惧的矛盾行为来考察动物的焦虑状态。开放臂和闭合臂长(30 cm) × 宽(10 cm) × 高(20 cm)。实验开始前将小鼠放在中央平台记录5 min内小鼠进入开放臂和闭合臂的次数和时间,统计分析小鼠进入开放臂频率百分比与时间百分比。
1.5.3新物体/位置识别实验 新物体识别实验(Fig 2)步骤如下:①将实验小鼠放进一个长(40 cm) × 宽(40 cm) × 高(40 cm)空开箱内,允许其自由探索10 min以适应环境,然后将其放回原鼠笼休息。②把两个不同的物体A、B放入由分析软件标记的开箱内固定两位置,让小鼠在箱内探索5 min,再将其放回原笼休息5 min。③将开箱内的的A物体换成新的C物体,B物体保持原位不动,将小鼠再次放入箱中探5 min,通过自动分析软Etho-Vision 8.5记录实验小鼠在新物体C周围活动的时间、频率比,判断小鼠认知能力。新位置识别实验(Fig 2)是用来判断实验小鼠位置识别能力。实验步骤前两步与新物体识别实验步骤一致,第三步则是把物体B由原来位置换到另一个不同位置,将小鼠再次放入箱中探索5 min,通过自动分析软件EthoVision 8.5 记录实验小鼠在新位置周围活动的时间、频率比。

Fig 2 Schematic diagram for novel object/place recognition test
1.5.4Morris水迷宫实验 水迷宫为直径(120 cm),高(50 cm)带有恒温加热棒的圆形游泳池,将泳池等分为4个象限,泳池内壁标上东南西北4个入水点,池水温度为(20±5) ℃,平台直径10 cm。本实验进行12 d,实验前1 d为视觉测试训练,逃生平台露出水面1 cm。平台按西北-东北-东南-西南顺序移动,小鼠从平台的对侧象限放入泳池中(顺序为:东南-西南-西北-东北)每天训练4次,每次60 s,找到平台后在其上休息10 s,若超过60 s未找到平台,由实验者将小鼠引导至平台,休息10 s。d 1~6为获得性训练阶段,将平台放置于西北象限中央并低于水面1 cm,每天训练4次,训练方法同上。d 7为探查测试,将平台撤除,测定小鼠在目标象限的对侧象限放入后寻找目标象限平台的次数和小鼠在目标象限的时间,以此作为空间记忆检测指标。d 8~11将平台放在原先平台对面位置,为对位训练阶段,用来测定小鼠的学习记忆,方法与获得性训练相同。每天训练4次,记录寻找到平台的时间、距离及速度。d 12进行对位探查测试。方法与探查测试类似,记录小鼠60 s内在目标象限的时间和次数。

2 结果
2.1 App/Ps1双转基因小鼠PCR鉴定结果PCR鉴定引物为1597和1598(App)以及1644和1645(ps1)结果见Fig 3,扩增出350 bp和608 bp条带的为App/ps1小鼠,如泳道1、2、3、5、6、7、8;只扩增出350 bp条带的为单纯App基因型的小鼠,如泳道4。

Fig 3 Genotype identification of App/Ps1 and App mice
2.2 旷场实验结果App/Ps1双转基因小鼠与App单转基因小鼠活动距离差异有显著性(Fig 4A,F1,14=5.742,P=0.031 1),与App/Ps1双转基因小鼠(6 090.50±2 410.91)相比,App单转基因小鼠(8 461.48±1 420.91)活动距离增加;App/Ps1双转基因小鼠与App单转基因小鼠两者在中心区域的活动距离差异有显著性(Fig 4B,F1,14=11.999,P=0.003 8),与App/Ps1双转基因小鼠(498.25 ± 200.94)相比,App单转基因小鼠(1 364.31±650.25)在中心区域活动距离增加;此外,App/Ps1双转基因小鼠与App单转基因小鼠两者在进入中心区域的频率百分比差异也有显著性(Fig 4C,F1,14=11.571,P=0.004 3),与App/Ps1双转基因小鼠(26.75±16.82)相比,App单转基因小鼠(71.37±21.36)进入中心区域频率百分比增加;App/Ps1双转基因小鼠与App单转基因小鼠两者的运动速度有显著差异(Fig 4D,F1,14=10.086,P=0.006 7),与App/Ps1双转基因小鼠(4.37±2.18)相比,App单转基因小鼠(8.21±2.11)运动速度增加。

Fig 4 Knock in of Ps1 gene accelerated hypofunction of AD mice in OFT n=2)A:Total distance moved;B:Distance moved in the central area;C:Frequency in central area%=[(Central area/(central area+Peripheral area)×100%].(D) Velocity.Values were expressed as *P<0.05,**P<0.01 vs App/Ps1 genotype mice.
2.3 高架十字迷宫实验结果App/Ps1双转基因小鼠与App单转基因小鼠进入开放臂频率百分比差异有显著性(Fig 5A,F1,18=14.735,P=0.001 2),与App/Ps1双转基因小鼠(39.71±6.14)相比,App单转基因小鼠(53.46±9.52)进入开放臂频率百分比增多;App/Ps1双转基因小鼠与App单转基因小鼠在开放臂时间百分比差异也有显著性(Fig 5B,F1,18=13.847,P=0.001 6),与App/Ps1双转基因小鼠(26.83±1.75)相比,App单转基因小鼠(35.16±6.85)在开放臂时间百分比增多。

Fig 5 Knock in of Ps1 gene induced anxiety-like behavior of AD mice in EPMT n=2)A:Frequency in open arm/%=[(Open arm/(Open arm+Closed arm)×100%];B:Duration in open arm/%=[(Open arm/(Open arm + Closed arm)×100%].Values were expressed as **P<0.01 vs App/Ps1 genotype mice.
2.4 新物体/新位置识别实验结果One-way ANOVA结果显示:App/Ps1双转基因小鼠与App单转基因小鼠对于新物体的识别指数百分比有显著差异(Fig 6A,F1,14=24.086,P=0.000 2),与App/Ps1双转基因小鼠(-7.23±1.19)相比,App单转基因小鼠(-10.38±1.36)在新物体测试中的识别指数百分比增高;App/Ps1双转基因小鼠与App单转基因小鼠两者对于新位置的识别指数百分比差异有显著性(Fig 6B,F1,14=21.353,P=0.000 4),与App/Ps1双转基因小鼠(-26.87±4.72)相比,App单转基因小鼠(-40.15±6.61)在新位置测试中的识别指数百分比增高。

Fig 6 Knock in of Ps1 gene accelerated cognitive dysfunction of AD mice in NORT and NPRT n=2)Recognition index (RI) uses the difference in recognition Duration (D) for novel (DN) and familiar object/place (DF),but then dividing this difference value by the total amount of exploration of the novel and familiar object RI/%=(DN-DF)/(DN+DF) ×100%].(A) Recognition index in the NORT%.(B) Recognition index in the NPRT%.Values were expressed as vs App/Ps1 genotype mice.
2.5 Morris水迷宫实验结果本实验流程(Fig 7A)包括d 1~6获得性训练、探查测试1(d 7)、d 8~11对位训练及探查测试2(d 12)。
2.5.1d 1~6获得性训练 Repeated ANOVA结果显示:App/Ps1双转基因小鼠与App单转基因小鼠两者找到平台的距离差异有显著性(Fig 7B,F1,18=34.866,P<0.000 1),与App/Ps1双转基因小鼠(872.97±89.15)相比,App单转基因小鼠(661.73±69.64)在获得性训练测试中找到平台的距离(到达平台距离)显著减少;App/Ps1双转基因小鼠与App单转基因小鼠两者找到平台时间也差异有显著性(Fig 7C,F1,18=53.695,P<0.000 1),与App/Ps1双转基因小鼠(34.69±4.18)相比,App单转基因小鼠(22.14±3.45)在获得性训练测试中找到平台的时间减少;此外,App/Ps1双转基因小鼠与App单转基因小鼠两者游泳速度差异也有显著性(Fig 7D,F1,18= 15.806,P=0.000 9);与App/Ps1双转基因小鼠(15.09±1.86)相比,App单转基因小鼠(17.80±1.08)在获得性训练测试中游泳速度增加。
2.5.2探查测试1(d 7) One-way ANOVA结果显示:App/Ps1双转基因小鼠与App单转基因小鼠两者目标象限(NW)中停留的距离百分比差异有显著性(Fig 7E,F1,18=8.89,P=0.008);与App/Ps1双转基因小鼠(23.83±5.02)相比,App单转基因小鼠(34.81±10.49)NW象限中的距离百分比增高;App/Ps1双转基因小鼠与App单转基因小鼠两者NW象限中停留时间百分比差异有显著性(Fig 7F,F1,18=4.552,P=0.046 9),与App/Ps1双转基因小鼠(27.69±4.47)相比,App单转基因小鼠(33.20±6.83)NW象限中停留的时间百分比增高。
2.5.38~11d反向学习训练 Repeated ANOVA结果显示:App/Ps1双转基因小鼠与App单转基因小鼠两者寻找到平台的距离差异有显著性(Fig 7B,F1,18=18.38,P=0.000 4),与App/Ps1双转基因小鼠(513.68±68.49)相比,App单转基因小鼠(408.38±39.35)在对位训练测试中的寻找到平台的距离减少;App/Ps1双转基因小鼠与App单转基因小鼠两者寻找到平台的时间差异也有显著性(Fig 7C,F1,18=39.028,P<0.000 1),与App/Ps1双转基因小鼠(38.04±6.96)相比,App单转基因小鼠(23.35±2.59)在对位训练测试中寻找到平台的时间显著减少;此外,App/Ps1双转基因小鼠与App单转基因小鼠两者游泳速度差异也有显著性(Fig 7D,F1,18=58.246,P<0.000 1),与App/Ps1双转基因小鼠(13.86±1.28)相比,App单转基因小鼠(17.72±0.94)在对位训练测试中游泳速度增加。
2.5.4d 12探查测试2 One-way ANOVA结果显示:App/Ps1双转基因小鼠与App单转基因小鼠在目标象限(SE)中停留的距离百分比差异有显著性(Fig 7G,F1,18=11.65,P=0.003 1),对比两者在SE象限中停留的距离百分比发现,与App/Ps1双转基因小鼠(21.42±3.41)相比,App单转基因小鼠(28.32±5.40)在SE象限中的距离百分比增加;App/Ps1双转基因小鼠与App单转基因小鼠两者在SE象限中停留时间百分比差异有显著性(Fig 7H,F1,18=8.193,P=0.010 4),与App/Ps1双转基因小鼠(25.21±3.91)相比,App单转基因小鼠(31.87±6.23)在SE象限中停留的时间百分比增加。
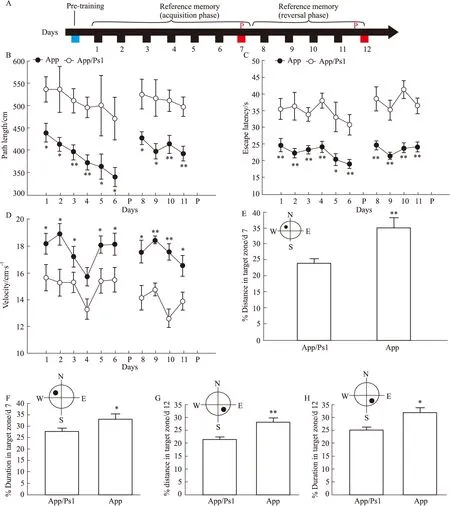
Fig 7 Knock in of Ps1 gene accelerated spatial cognitive dysfunction of AD mice in MWMTA:showed the training schedule in the WM;B~D:exhibited the path length,escape latency and velocity respectively for animal to reach a hidden platform during the acquisition and reversal phase in means of 4 trials within days.The distance;E,F:spent in target zone of the water maze pool during the probe test 1 (E) was showed by bar graph.Also,the distance (G) and duration (H) spent in target zone of the water maze pool during the probe test 2 were displayed.The location of the escape platform (removed for the probe test) was represented by a solid circle.All post-hoc comparisons were based on Fisher’s LSD.Values were expressed as *P<0.05,**P<0.01 vs App/Ps1 genotype mice.
3 讨论
本研究通过系列行为学实验探讨了Ps1突变基因对阿尔茨海默病模型鼠表观有效性的影响。旷场实验中发现与App/Ps1双转基因小鼠相比,App单转基因小鼠总的活动距离、中心区域活动距离、进入中心区域频率百分比均增加(Fig 4A-4C),说明App单转基因小鼠无法更好的模拟AD的自发活动、探索及抑郁样行为。此外,与App/Ps1双转基因小鼠相比,App单转基因小鼠活动速度增快(Fig 4D),说明App单转基因小鼠无法更好模拟AD活动机能减弱表现。高架十字迷宫实验结果显示,与App/Ps1双转基因小鼠相比,App单转基因小鼠在开放臂的频率百分比及时间百分比均显著增加(Fig 5A,5B),说明App单转基因小鼠不能更好模拟AD焦虑样行为。新物体与新位置识别实验发现,与App/Ps1双转基因小鼠相比,App单转基因小鼠识别指数百分比明显增加(Fig 6A,6B),说明App单转基因小鼠不能更好模拟AD认知与记忆受损的行为表现,该实验与Morris水迷宫实验结果相一致。在水迷宫实验中,与App/Ps1双转基因小鼠相比,App单转基因小鼠在获得性训练测试与对位训练测试中寻找到平台的距离与时间均减少(Fig 7B,7C),说明App单转基因小鼠不能更好模拟AD认知与记忆受损的行为表现。另外,与App/Ps1双转基因小鼠相比,App单转基因小鼠在获得性训练测试与对位训练测试中游泳速度增快(Fig 7D),说明App单转基因小鼠不能更好模拟AD活动机能减弱的行为学表现,这与旷场实验中小鼠运动速度结果一致。Ps1蛋白在海马和新皮质的锥体细胞、脑干活动神经元及骨骼肌中均有表达[11],Holtzer 等[12]研究报道,步行速度减慢与认知功能障碍是经常同步出现的,这与本实验结果相一致。探查测试1结果显示:与App/Ps1双转基因小鼠相比,App单转基因小鼠在目标象限内运动的距离与时间百分比均明显增加(Fig 7E,7F),说明Ps1基因转入加速阿尔茨海默病模型小鼠认知损伤。另外,在水迷宫实验探查测试2中,与App/Ps1双转基因小鼠相比,App单转基因小鼠在目标象限内运动的距离及时间百分比均显著增加(Fig 7G,7H),提示Ps1基因转入加速阿尔茨海默病模型小鼠学习记忆的衰退。
国内外文献[13-14]表明,Ps1基因突变不仅可以改变App的剪切位点,诱导Aβ42增加,还可以通过干扰细胞内钙稳态,增加ROS的生成,提高神经元对营养因子消耗的敏感性,诱导神经元凋亡。Inestrosa等[15]报道了Ps1基因突变的细胞内Akt/PKB活性减弱,由于Akt/PKB对GSK-3β有抑制作用,从而增强了GSK-3β对β-catenin磷酸化的作用。本实验所研究的阿尔茨海默病APPswe/PS1dE9双转基因模型小鼠是Jankow-sky在2004年首次建立的,将人鼠嵌合型基因Mo/Hu APP695和含有第9个外显子突变的人Ps1基因(Hu-PS1dE9)在胚胎期直接注入受精卵并整合到染色体的同一个基因座。Jankow-sky等[16]研究发现,在APPswe转基因小鼠中共表达Ps1-dE9可特异性增加Aβ42的水平而不会改变Aβ40,然而目前关于Ps1-dE9转入会导致认知障碍加速的研究尚未见任何报道。因此,本实验研究了Ps1基因在阿尔茨海默病中的重要功能,通过对比App单转基因小鼠及App/Ps1双转基因小鼠在认知、学习、记忆功能及自主活动、情绪方面的异同,发现Ps1基因的转入能够更好的模拟阿尔茨海默病模型鼠运动机能减弱,情绪异常及认知、学习、记忆功能障碍。
综上所述,Ps1突变基因显著增加了阿尔茨海默病模型(App/Ps1双转基因)小鼠的焦虑、抑郁样行为,并伴随自发活动减少、速度减慢及认知学习及记忆受损的行为学表现。这些结果证明了Ps1-dE9转入会导致认知障碍进一步加速,对AD的机制研究及靶向药物研发具有重要价值。