高三尖杉酯碱对人黑色素瘤A375细胞增殖的影响及机制研究
唐加峰,张 滔,,黄世莹,杜玉梅,李 静,冉建华,陈地龙
(1.重庆医科大学基础医学院干细胞与组织工程研究室,重庆 400016;2.重庆三峡医药高等专科学校,重庆 404120;重庆医科大学 3.基础医学院神经科学研究中心、4.公共卫生与管理学院,重庆 400016)
黑色素瘤(melanoma)是一种最具侵袭性的皮肤癌,具有死亡率高、转移快、预后差等特点,其5年生存率仅为6%,中位生存期约为6~8个月[1]。黑色素瘤的治疗方式主要包括手术、放疗、化疗、靶向治疗和免疫治疗等等[2]。黑色素瘤细胞对放疗的敏感性低,原因是其产生的黑色素可削弱射线的杀伤作用[3],因此黑色素瘤的治疗效果不尽如人意。由于转移性黑色素瘤几乎对大多数当前疗法完全耐药,并且与患者预后不良相关[4],因此进一步寻找新的药物和治疗方式显得至关重要。
高三尖杉酯碱(homoharringtonine,HHT)是从三尖杉属的枝叶中提取出来的生物碱,分子式为C29H39NO9,分子量为545.6[5],目前临床上主要用于急性粒细胞白血病的治疗,对于急性单核细胞白血病及恶性淋巴瘤也有一定疗效。最新研究证明,HHT在多种肿瘤细胞中呈现出良好的抑制作用,如肺癌、直结肠癌和乳腺癌[6]等,而HHT对黑色素瘤的作用效果却未见报道。本研究的主要内容是用HHT处理人黑色素瘤A375细胞,评估其作用效果,筛选出最佳作用浓度和时间,通过检测细胞凋亡与增殖相关基因和蛋白质的表达来探究HHT潜在的作用机制,期待能为黑色素瘤的治疗提供新的思路和手段。
1 材料
1.1 细胞株A375人恶性黑色素瘤细胞由本实验室提供。
1.2 药物与试剂HHT(纯度:99.96%,货号:HY-14944)和Cell Counting Kit-8(CCK-8,货号:HY-K0301)购自MCE公司;南美胎牛血清(10270-106,Gibco)和高糖培养基DMEM(C11995500BT,Gibco)均购自美国赛默飞公司;二甲基亚砜(DMSO)、BCA蛋白浓度测定试剂盒、RIPA裂解液、青-链霉素、Hoechst 33258染液和PMSF均购自碧云天生物技术有限公司;凝胶配置试剂盒、双色预染蛋白Marker和无蛋白快速封闭液均购自雅酶生物;一抗抗体CDK1、Cyclin B1、Bax、Bcl-2、Cleaved-PARP、Cleaved-caspase 3和GAPDH购自Bimake(Houston,TX,USA);二抗抗体购自美国CST公司。
1.3 仪器低温高速离心机(平凡仪器,TGL-185);M450酶标测定仪、凝胶成像系统、Western blot电泳仪、电转仪(美国Bio-Rad公司);高速台式离心机(长沙平凡仪器仪表有限公司);DMi8倒置显微镜、倒置荧光显微镜(德国Leica公司)。
2 方法
2.1 细胞培养复苏A375细胞,将其置于含10%胎牛血清和1%双抗溶液的DMEM培养基中,在37 ℃、5% CO2细胞培养箱中培养。
2.2 药物配置按照试剂商的说明书提供的方法,称取1 mg HHT,将其溶解在1.832 8 mL二甲基亚砜(DMSO)中,配制成1 mmol·L-1的药品储存液,分装后保存于-80 ℃冰箱中。后期实验过程中,用DMEM稀释药品储存液。
2.3 CCK-8法检测A375细胞活力取对数生长期的A375细胞,以5×107·L-1的密度接种于96孔板,每孔100 μL。该实验分为3组,每组设置3个复孔。空白对照组:不含细胞和HHT,仅加入DMEM完全培养基;对照组:含细胞不含HHT;实验组:含细胞和不同浓度的HHT(浓度为0、0.05、0.1、0.2、0.4、0.8 μmol·L-1)。在培养24、48、72 h后,向每孔加入10 μL CCK-8工作液,再将96孔板放入孵箱孵育1.5 h。孵育完成后,在450 nm波长处测定吸光度值(A),并计算细胞生长抑制率。抑制率/%=(A对照组-A实验组)/(A对照组-A空白对照组)×100%。实验重复3次。
2.4 Hoechst 33258 染色实验取对数期生长的A375细胞,以5×107·L-1的密度接种于24孔板中,每孔1 mL。将实验分两组,对照组:接种细胞不加药处理;HHT组:接种细胞并给药处理(0.4 μmol·L-1)。在孵箱中培养24 h后,取出24孔板,去除培养基,加入固定液固定,用PBS洗掉固定液。加入适量的Hoechst 33258染色液,并充分覆盖住细胞样品,室温避光染色5 min,弃染色液,用PBS洗涤3次后,用荧光显微镜观察拍照,实验重复3次。
2.5 细胞克隆形成实验取对数期生长的A375细胞,计算细胞数量并调整细胞密度,以每孔500个细胞接种于6孔板中,在37 ℃、5% CO2孵箱中培养24 h后,去除培养基,向不同组别的细胞中分别加入含终浓度0、0.1、0.2、0.4 μmol·L-1HHT处理24 h。移除培养液,并加入新鲜的完全培养基继续培养,每3~4 d更换一次培养基,直到出现肉眼可见的集落形成(约14 d)便终止培养。移除培养液,用PBS清洗后,加入4%多聚甲醛固定液固定15 min,吸除多聚甲醛,用PBS洗掉固定液后加入结晶紫染色液染5 min,用自来水洗去多余的染色液,拍照并用ImageJ统计每孔克隆形成数。实验重复3次。
2.6 FCM检测细胞凋亡取对数生长期的A375细胞,以5×107·L-1的密度接种于6孔板中,每孔3 mL。该实验分为2组,对照组:接种细胞没有加药处理并常规培养;HHT组:给予含终浓度为0.4 μmol·L-1的HHT完全培养基。在37 ℃、5% CO2孵箱中培养48 h后,弃培养基并用PBS洗涤2次,离心收集各组细胞,按照Annexin V-荧光素(FTIC)/碘化丙啶(PI)细胞检测试剂盒说明书进行操作,用流式细胞仪检测细胞凋亡。实验重复3次。
2.7 FCM检测细胞周期取对数生长期的A375细胞,以5×107·L-1的密度接种于6孔板各孔中,每孔3 mL。该实验分为2组,对照组:已接种细胞没有加药处理并常规培养;HHT组:给予含终浓度为0.4 μmol·L-1的HHT完全培养基。培养48 h后,弃培养基并用PBS洗涤2次,离心收集各组细胞,用提前预冷75%乙醇固定过夜,用PI试剂染色,PBS清洗2次后,用流式细胞仪检测细胞周期。实验重复3次。
2.8 免疫印迹实验(Western blot)检测相关蛋白的表达将A375细胞分为4组,分别加入不同浓度(0、0.1、0.2、0.4 μmol·L-1)的HHT,处理24小时后用细胞刮收集细胞,提取细胞总蛋白,BCA法测定不同组别的蛋白浓度。将4组蛋白进行SDS-PAGE电泳,电转至硝酸纤维素膜上,用无蛋白快速封闭液在室温条件下封闭半小时,加入一抗(Bax,Bcl-2,Cleaved-caspase 3,Cleaved-PARP,Cyclin B1,CDK1和GAPDH,稀释比例均为1 ∶1 000)置于4度孵育过夜。使用TBST清洗3遍硝酸纤维素膜,加入与一抗对应的二抗(以1 ∶10 000的比例稀释)在室温孵育1 h,再用TBST清洗3次,最后使用ECL系统对蛋白的表达情况进行检测。独立重复试验3次。

3 结果
3.1 HHT抑制A375细胞的增殖CCK-8结果显示,用不同浓度的HHT作用于A375细胞24、48和72 h后,与对照组相比细胞增殖受到抑制,差异明显(P<0.01)。并随着药物的剂量和作用时间增加,HHT对A375细胞的抑制作用逐渐增强。计算24小时的半数抑制浓度(IC50)约为0.4 μmol·L-1,因此选择该浓度作为本实验后续研究的最大浓度,见Fig 1。

Fig 1 Effect of HHT on proliferation of A375 cells by CCK-8 **P<0.01 vs control
3.2 HHT促进A375细胞发生凋亡A375细胞经0.4 μmol·L-1HHT诱导24 h后进行Hoechst33258染色,染色结果如Fig 2所示,对照组的细胞核形态完整呈椭圆形,荧光强度均一,凋亡细胞少;而HHT处理组可见细胞核形态发生改变,表现为核浓缩、核碎裂、核边集等特征,证明该组细胞发生了凋亡。流式细胞仪检测结果如Fig 3所示,用0.4 μmol·L-1的HHT处理A375细胞48 h后,HHT组的A375细胞凋亡率较对照组明显增高,差异有统计学意义(P<0.01)。

Fig 2 Homoharringtonine induced A375 cells for 24 h by Hoechst 33258 staining(×400)
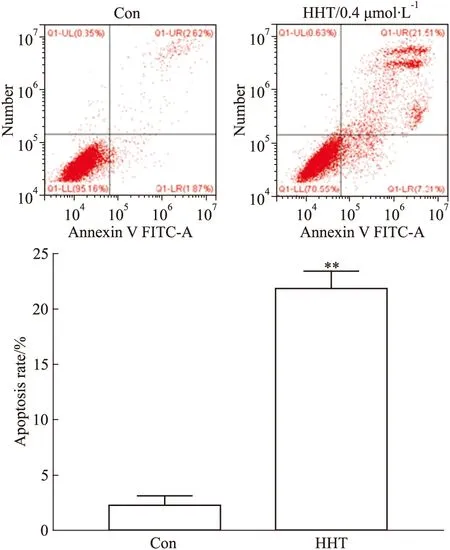
Fig 3 Effect of HHT on apoptosis of A375 cells by **P<0.01 vs control
3.3 HHT诱导A375细胞周期阻滞于G2/M期用0.4 μmol·L-1的HHT处理A375细胞48 h后,流式细胞仪检测结果显示,HHT组G2/M期细胞比例明显增加,而G0/G1和S期细胞比例减少,与对照组相比,差异有统计学意义(P<0.01)。提示0.4 μmol·L-1的HHT可使A375细胞周期阻滞于G2/M期,见Fig 4。

Fig 4 Effect of HHT on cell cycle distribution of A375 cells by **P<0.01 vs Control
3.4 HHT降低A375细胞的克隆形成能力克隆形成实验结果显示,在不同浓度HHT(0、0.1、0.2、0.4 μmol·L-1)处理A375细胞后,克隆形成能力受到明显抑制,且随着药物浓度增高,细胞集落形成数明显减少,与对照组相比差异有统计学意义(P<0.01),见Fig 5。
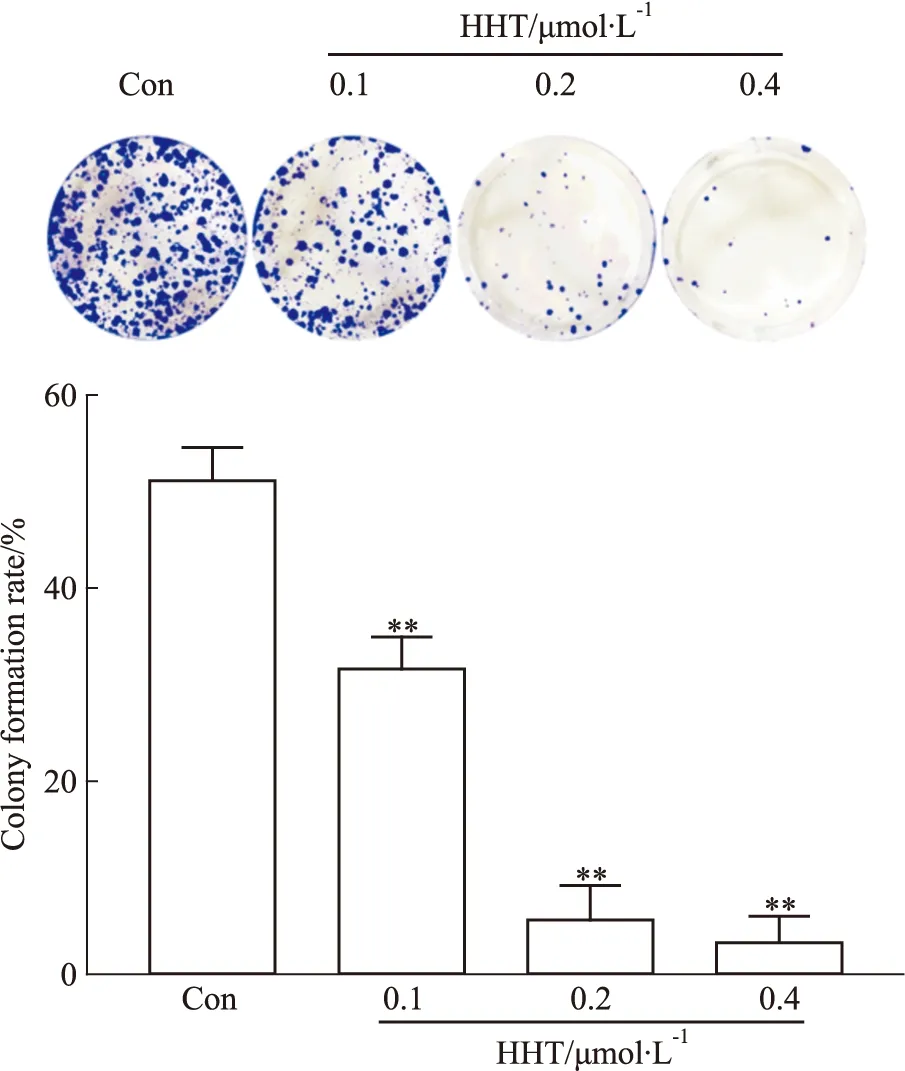
Fig 5 Effect of HHT on colony-formation **P<0.01 vs control
3.5 Western blot检测A375细胞凋亡相关蛋白的表达用不同浓度的HHT(0、0.1、0.2、0.4 μmol·L-1)作用于A375细胞24 h后,Western blot结果显示,HHT组Bcl-2的蛋白水平均明显下调,而Bax、Cleaved-caspase 3、Cleaved-PARP蛋白水平升高,与对照组相比,差异有统计学意义(P<0.01),见Fig 6。结果提示了HHT可以诱导A375细胞发生凋亡。

Fig 6 Effect of HHT on expression of Bax,Bcl-2,Cleaved PARP and Cleaved caspase-3 protein in A375 **P<0.01 vs control
3.6 Western blot检测A375细胞周期相关蛋白的表达用不同浓度的HHT(0、0.1、0.2、0.4 μmol·L-1)作用于A375细胞24 h后,Western blot结果显示,HHT组中与细胞周期相关的 CDK1和Cyclin B1蛋白表达下调,与对照组相比,差异有统计学意义(P<0.01),见Fig 7。蛋白水平的结果证实了HHT可以诱导A375细胞周期阻滞于G2/M期。
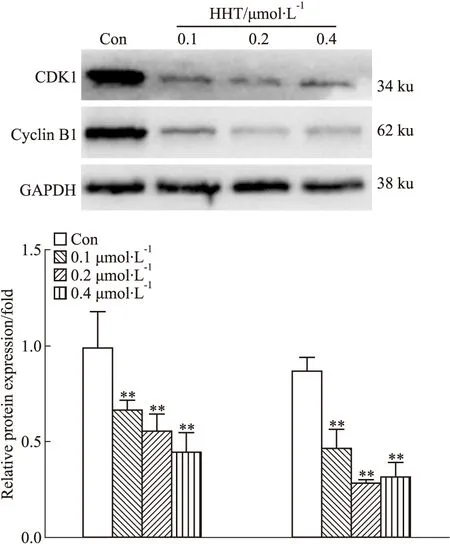
Fig 7 Effect of HHT on CDK1 and Cyclin B1 protein expression in A375 **P<0.01 vs control
4 讨论
黑色素瘤是一种侵袭性极高的恶性肿瘤,在肿瘤早期阶段便可发生转移,晚期患者预后极差[7],一旦确诊多属于晚期,因而黑色素瘤死亡率逐年增高。目前黑色素瘤的治疗方案较为单一,临床上主要以手术切除为主,放疗及化疗为辅助治疗手段。而化疗疗效欠佳,不良反应较大,并且容易对化疗药物产生耐药[8]。近年来,中医药在肿瘤治疗领域取得了一些新的进展,如人参皂苷、吴茱萸碱和白藜芦醇[9]等。因此,探索中药对黑色素瘤的疗效,或许是提高其预后的新思路。
20世纪70年代初,HHT得到分离与鉴别,由于其对白血病临床效果显著,2012年FDA批准了HHT用于治疗白血病。根据目前的研究结果,HHT可以与核糖体60S亚基的A位点结合,竞争性地抑制氨酰基-tRNAs的结合,抑制蛋白质合成,这种抑制作用具有剂量和时间的相关性[10]。HHT还可诱导细胞凋亡,通过上调Bax促凋亡蛋白的表达,诱导Caspace-3、Caspace-9和PARP的活化,引起人结肠癌LoVo细胞发生凋亡[11]。本研究采用CCK-8法检测HHT对A375细胞增殖的影响,结果表明HHT对A375细胞有较好的抑制作用,且药物的作用浓度较低,表现为时间和浓度依赖性。同时,HHT还可以抑制A375细胞的克隆形成能力,浓度越高集落形成数越少。以上结果均证实了HHT可以有效的抑制A375的增殖。
Bcl-2是一种线粒体外膜蛋白,它能够抑制有促凋亡作用的细胞色素C从线粒体释放到细胞质,进而抑制细胞凋亡[12]。Bax是存在于高级真核生物中的核编码蛋白,它们能够刺穿线粒体外膜以介导细胞凋亡,其过表达可拮抗Bcl-2的作用,使细胞发生凋亡[13]。细胞凋亡是细胞程序性死亡的一种形式,主要有两种途径:一个是死亡受体途径,另一个是线粒体介导的凋亡途径[14]。细胞色素C的释放是线粒体凋亡途径激活的显着特征。线粒体外膜的透化作用导致细胞色素C释放到细胞质中,与凋亡蛋白酶激活因子1(APAF-1)结合,导致Caspase-9和Caspase-3激活而引起细胞凋亡[15]。而活化的capspase-3裂解PARP,后者被认为是凋亡的标志物。
本研究采用HHT作用于A375细胞,用Hoechst33258和FCM检测结果证明了HHT诱导A375细胞发生凋亡。Western blot结果显示,凋亡相关蛋白Bax、Cleaved-caspase 3和Cleaved-PARP表达增高,而抗凋亡蛋白Bcl-2表达降低,具有浓度依耐性。因此,HHT可能是通过改变Bax和Bcl-2在细胞中的表达促进A375细胞发生凋亡,而Cleaved-caspase 3和Cleaved-PARP表达增高证明了HHT可能激活了A375的线粒体凋亡途径。
细胞周期检查点是细胞正常生命过程中一个重要的调节节点,只有通过检查点,细胞才能正常进入下一个细胞周期[16]。CDK1/Cyclin B复合体是G2/M期检查点的关键调节因子,当细胞通过G2/M期时,该复合物被大量合成,当细胞发生G2/M期阻滞时,CDK1/Cyclin B复合体的含量相应降低[17]。在我们的研究中发现,HHT处理A375细胞后,CDK1和Cyclin B1的蛋白水平降低,同时FCM的结果也说明HHT可以使A375细胞发生G2/M阻滞。以上结果表明,HHT可降低CDK1和Cyclin B的水平,从而降低CDK1/Cyclin B复合物的含量,导致A375细胞停滞在G2/M期,从而抑制A375细胞增殖。
综上所述,HHT对A375细胞有良好的抗肿瘤活性,能诱导细胞凋亡,阻滞细胞周期,进而抑制肿瘤细胞的增殖,可能是一种治疗黑色素瘤的有效药物。其机制可能是HHT通过激活线粒体介导的凋亡途径,上调Bax和Caspase-3,最终活化PARP,引起A375细胞凋亡;下调CDK1和Cyclin B1的表达,引起A375细胞周期的阻滞。接下来,我们将更进一步探索HHT在体内的作用效果以及分子机制。