木犀草素通过抑制Akt/IKK信号通路抑制膀胱癌5637细胞迁移、侵袭和上皮间质转化
胡艺还,高 静,杨宁刚,李彩丽,徐晓莉,李 乐,黄双盛
(西北民族大学 1.医学院、2.医院,甘肃 兰州 730030;3.兰州市第一人民医院泌尿科,甘肃 兰州 730050;4.兰州大学基础医学院,甘肃 兰州 730000)
膀胱癌是泌尿系统最常见的恶性肿瘤。其全球发病率在36种恶性肿瘤中位居第十位[1],在我国,膀胱癌发病位居全部恶性肿瘤的第13位,而死亡率位居全部恶性肿瘤死亡的第12位。其发病率和死亡率均占泌尿系统肿瘤首位,并呈逐年上升的趋势[2]。复发、转移是临床治疗失败的主要原因。
上皮间质转化(epithelial-mesenchymal transitions,EMT)是指具有极性的上皮细胞发生表型转换获得间质细胞表型的过程。通过EMT,肿瘤细胞开始从原发灶脱离并获得侵袭迁移能力。因此,EMT是启动肿瘤侵袭转移的关键所在,抑制EMT发生可作为抑制肿瘤侵袭转移的一种重要手段[3]。研究表明,EMT的发生是肿瘤微环境和肿瘤细胞相互作用的结果,多种生长因子、信号途径参与这一过程,其中转化生长因子β(transforming growth factor-β,TGF-β)是迄今研究最为深入的调节EMT过程的重要细胞因子,在多种肿瘤组织发现TGF-β过表达[4]。而在膀胱癌,研究发现从癌组织分离的肿瘤相关成纤维细胞主要通过分泌TGF-β1诱导膀胱癌细胞发生EMT[5]。
木犀草素(luteolin)是一种天然黄酮类化合物,化学结构为3′,4′,5,7-四羟基黄酮,广泛存在于多种中草药及蔬菜水果中,具有抗氧化、抗炎、抗过敏以及抗肿瘤等活性[6]。其抗肿瘤作用与抑制肿瘤细胞增殖、诱导凋亡,抗血管生成以及增敏抗癌药物活性等有关[7]。木犀草素还能抑制多种肿瘤细胞如胃癌[8]、肺癌[9]、乳腺癌[10]等侵袭迁移。研究证实[11],木犀草素能有效抑制膀胱癌细胞BIU-87细胞的增殖,阻滞细胞周期,诱导BIU-87细胞凋亡。但它如何影响膀胱癌的侵袭、转移目前尚未见报道。因此,本研究将观察木犀草素对膀胱癌5637细胞迁移、侵袭、基质金属蛋白酶-2/9 (matrix metalloproteinase-2/9,MMP-2/9)分泌影响,并通过建立TGF-β诱导的EMT模型,观察木犀草素对TGF-β诱导的EMT及相关信号通路蛋白表达的影响,以探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人膀胱癌5637细胞购自中科院上海细胞库,由本实验室传代保存。
1.1.2药物和试剂 木犀草素由兰州大学基础医学院张小郁教授惠赠,纯度为98%;RPMI 1640培养基购自美国Gibco公司(货号:31800-022);胎牛血清购自乌拉圭 Lonsera公司(货号:S711-001S);磺酰罗丹明B (sulforhodamine B,SRB) (货号:S1402-5G)和明胶(货号:G2500-100G)购自Sigma公司;插入式细胞培养皿(Millicell cell culture inserts)购自Millipore公司(货号:P18P01250);基质胶(Matrigel)(货号:356234)、转化生长因子β(transforming growth factor-β,TGF-β)(货号:7754-BH-005)购自BD公司;RIPA细胞裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)购自碧云天生物公司(货号:P0013B);E-cadherin(货号:ab40772)、N-cadherin(货号:ab18203)、Vimentin(货号:ab92547)、IKK(货号:ab178870)、p-IKK(货号:ab194528)、β-Actin(货号:ab8227)一抗和相关二抗购自Abcam公司;Akt(货号:4691)、p-Akt(货号:9271)、Slug(货号:9585)抗体购自Cell Signaling Technology公司;化学发光试剂购自美国Thermo Fisher公司(货号:34077);其它试剂均为国产分析纯。
1.1.3仪器 细胞培养箱(SHELLAB公司);酶标仪(上海科华生物工程有限公司);倒置显微镜(OLYMPUS公司);化学发光凝胶成像仪(Bio-Rad公司)。
1.2 方法
1.2.1细胞培养 5637细胞置于含10%胎牛血清的RPMI-1640培养基中,在37 ℃、5% CO2的细胞培养箱中传代培养。取对数生长期的细胞进行实验。
1.2.2SRB法 取指数生长期5637细胞消化,制成细胞悬液,调整细胞浓度为3 × 107~5×107个·L-1,然后每孔100 μL接种在96孔板。培养24 h后,加入不同浓度木犀草素,继续培养24、48、72 h后,将细胞取出,加入预冷的50%三氯乙酸(最终浓度10%)在4 ℃固定1 h。然后用去离子水冲洗5次,晾干,加入0.4%的SRB染料染色10 min,再用0.1%醋酸洗5次,过夜晾干。结合在细胞的SRB用150 μL 1% Tris碱溶解,用酶标仪在570 nm波长处测定吸光度值,计算细胞存活率。
1.2.3Transwell法检测细胞迁移 细胞迁移在插入式细胞培养皿Millicell中进行,其中聚碳酸酯膜的膜孔直径是8 μm。取5637细胞,用不含血清的RPMI 1640培养基制成细胞悬液,细胞浓度为1×109·L-1。取0.4 mL细胞悬液加到Millicell上室,同时加入不同浓度木犀草素,下室加入含20%血清的RPMI 1640培养基0.6 mL,37 ℃培养24 h,取出培养小室,将聚碳酸酯膜里面未迁移的细胞用棉签刮掉,膜外面迁移过去的细胞用甲醇固定,0.1%结晶紫染色,显微镜下随机选择视野拍照。用ImageJ软件对穿过微孔膜的细胞计数。
1.2.4Transwell法检测细胞侵袭 细胞侵袭同样在插入式细胞培养皿Millicell中进行。取出已经融化的Matrigel,用预冷的RPMI 1640按Matrigel ∶1640=1 ∶8的比例稀释,然后取稀释液50 μL加到Millicell上室,以上操作均在冰上进行。然后置37 ℃培养箱1 h 待Matrigel凝固后,取5637细胞,用不含血清的RPMI 1640培养基制成细胞悬液,细胞浓度为1.5×109·L-1,其余操作与“1.2.3”相同。
1.2.5明胶酶谱实验 取出即将长满单层的5637细胞,加入含有不同浓度木犀草素RPMI-1640培养基(含1%血清),置37 ℃培养箱继续培养24 h,收集上清液。取上清液,加入不含β-巯基乙醇的上样缓冲液,37 ℃水浴共同孵育0.5 h,上样,进行7.5%的SDS-PAGE电泳(其中分离胶加入1%明胶),电泳结束后,将凝胶置于洗脱液振荡洗脱1 h。再将胶放入孵育缓冲液,37 ℃孵育使酶复性。36 h后取出凝胶,用 0.25% 考马斯亮蓝R250染色。然后放入脱色液脱色,直至蓝色的胶上出现白色条带。
1.2.6Western blot检测 取即将长满单层的5637细胞,加入不同浓度木犀草素,24 h后,收集细胞,PBS洗涤,加入RIPA裂解液,置冰上裂解30 min,4 ℃、12 000 r·min-1离心10 min,取上清,用Bradford 法测定蛋白含量。每组取40 μg蛋白进行SDS-PAGE电泳,湿式转移法转移至PVDF膜,TBST洗膜3次,5%脂奶粉封闭1 h,TBST洗涤3次,加入一抗4 ℃孵育过夜,洗涤,再加入二抗室温孵育2 h,洗涤,加入发光试剂,用凝胶成像仪进行检测。利用ImageJ软件对蛋白条带进行灰度分析。

2 结果
2.1 木犀草素抑制5637细胞增殖如Fig 1所示,木犀草素对5637细胞增殖有明显抑制作用,且呈浓度和时间依赖性。木犀草素处理24、48、72 h的半数抑制浓度(IC50)分别为53.63、23.12、15.33 mg·L-1。由于6.25 mg·L-1的木犀草素作用24 h对5637细胞增殖无明显抑制作用,因此我们选用最大浓度6.25 mg·L-1作用24 h进行后续实验。

Fig 1 Proliferation of 5637 cells after treatment for 24,48,72 h inhibited by luteolin n=4)*P<0.05,**P<0.01 vs control group
2.2 木犀草素抑制5637细胞迁移如Fig 2所示,加入20%血清能明显诱导5637细胞向Transwell下室迁移,不同浓度木犀草素(1.56、3.13、6.25 mg·L-1)处理24 h明显抑制血清诱导的5637细胞迁移,抑制率分别为27.44%、48.91%、71.68%。
2.3 木犀草素抑制5637细胞侵袭如Fig 2所示,血清作为趋化因子能诱导5637细胞侵袭并穿过Matrigel,而用1.56、3.13、6.25 mg·L-1的木犀草素处理5637细胞24 h能明显抑制5637细胞侵袭,抑制率分别为36.57%、53.32%、73.55%。

Fig 2 Migration and invasion of 5637 cells inhibited by luteolin (×200) n=4)*P<0.05,**P<0.01 vs control group
2.4 木犀草素抑制5637细胞MMP-2、MMP-9分泌如Fig 3所示,6.25 mg·L-1木犀草素能抑制对5637细胞MMP-2分泌;而12.5、25 mg·L-1木犀草素对5637细胞MMP-2、MMP-9分泌均有明显抑制作用。与对照组相比较,差异有统计学意义。

Fig 3 MMP-2/9 secretion by 5637 cells inhibited by luteolin n=5)*P<0.05,**P<0.01 vs control group
2.5 木犀草素对5637细胞EMT相关蛋白表达的影响如 Fig 4所示,与对照组比较,5637细胞经入5 μg·L-1TGF-β处理24 h后,上皮细胞标志物E-cadherin表达明显降低,而间质细胞标志物N-cadherin、Vimentin表达明显升高,EMT相关转录因子Slug表达也明显升高。这说明加入5 μg·L-1TGF-β处理24 h诱导5637细胞发生了EMT。与TGF-β处理组比较,加入不同浓度木犀草素对TGF-β诱导E-cadherin降低无明显影响,但能明显抑制TGF-β诱导的N-cadherin、Vimentin以及Slug表达升高。这表明木犀草素对TGF-β诱导5637细胞EMT发生有抑制作用。

Fig 4 TGF-β-induced EMT of 5637 cells inhibited by #P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs TGF-β treatment alone
2.6 木犀草素对TGF-β诱导EMT相关信号分子表达的影响如Fig 5所示,与对照组比较,TGF-β处理不影响总的Akt、IKK表达,但p-Akt、p-IKK的表达升高,说明TGF-β处理能诱导Akt、IKK发生磷酸化。与TGF-β处理组比较,加入木犀草素处理后总的Akt、IKK以及p-Akt、p-IKK表达均出现下降。提示木犀草素抑制TGF-β诱导5637细胞EMT发生与抑制TGF-β/Akt/IKK信号通路有关。
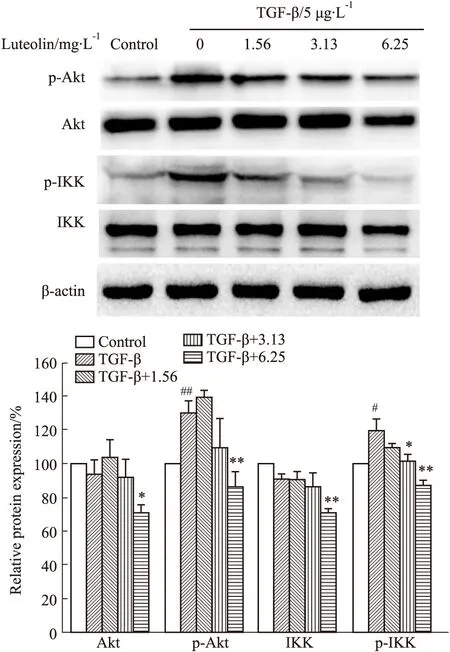
Fig 5 Expression of Akt,p-Akt,IKK and p-IKK inhibited by luteolin n=3)#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs TGF-β treatment alone
3 讨论
膀胱癌是泌尿系常见的恶性肿瘤,具有高复发、高进展、高异质性等特点。作为肿瘤侵袭转移的起始事件,EMT与膀胱癌尤其是肌层侵润性膀胱癌转移、对化疗的耐药性以及预后都密切相关[12]。近年来,天然产物由于具有来源广、类型多、不良反应小等优点,因此从中寻找靶向EMT抑制剂越来越受到人们的关注[13]。相关研究表明,木犀草素能够逆转多种肿瘤细胞EMT发生从而抑制肿瘤侵袭迁移[8-10],而木犀草素如何影响膀胱癌侵袭和转移目前尚未见报道。研究结果表明,木犀草素能抑制膀胱癌5637细胞迁移、侵袭及MMP-2/9分泌并且能够逆转TGF-β诱导的EMT过程。
TGF-β对肿瘤的影响有双重性,在肿瘤形成的早期阶段,TGF-β通过抑制肿瘤细胞的生长、诱导肿瘤细胞凋亡而产生抑制效应;但在肿瘤的进展阶段,TGF-β却通过诱导肿瘤细胞发生EMT而促进肿瘤的发展。研究表明[14]TGF-β诱导EMT发生涉及两条主要的信号通路,即TGF-β/SMAD和TGF-β/非SMAD信号通路,其中非SMAD依赖的TGF-β信号通路有多条,包括PI3K/Akt以及Ras/MAPK信号通路等。Akt是一种丝氨酸/苏氨酸蛋白激酶,活化的Akt通过磷酸化激活多种底物(包括GSK-3β、IKK等)从而参与肿瘤细胞的增殖、凋亡、迁移以及侵袭过程[15]。通常情况下,NF-κB在细胞质与IκB结合没有转录活性,而当IKK被Akt等上游信号磷酸化激活后,活化的IKK则磷酸化IκB进而使IκB通过泛素化途径被降解,于是NF-κB得以释放并发生核转位进而激活下游靶基因转录[16]。在本研究中,我们发现TGF-β处理5637细胞不影响总的Akt、IKK表达,但能诱导Akt、IKK磷酸化。而加入木犀草素后Akt、IKK以及p-Akt、p-IKK表达均有所降低,这表明木犀草素抑制TGF-β诱导5637细胞EMT发生与抑制TGF-β/Akt/IKK信号通路有关。Chen等[9]报道木犀草素可通过影响PI3K/Akt-NF-κB-Snail通路而抑制TGF-β1诱导的肺癌细胞发生EMT。我们的结果与Chen等报道一致。
然而,如上所述,EMT的发生是肿瘤微环境和肿瘤细胞相互作用的结果,多种生长因子、多条信号途径参与这一过程。从已有报道看,木犀草素可通过影响多条信号途径逆转多种因素诱导的EMT。例如Ruan等[17]报道木犀草素能够通过抑制integrinβ1/FAK信号通路抑制低氧诱导的小细胞肺癌细胞发生EMT;Liu等[18]研究表明木犀草素抑制结肠癌细胞EMT则是通过抑制cAMP反应元件结合蛋白1(CREB1)表达;而Zang等[8]发现木犀草素通过抑制Notch信号通路而抑制胃癌细胞EMT发生。而目前我们只通过建立TGF-β诱导的EMT模型,研究了木犀草素对Akt/IKK信号通路的影响。因此通过建立多种EMT模型,进一步探讨木犀草素逆转EMT的分子机制并通过体内实验研究木犀草素对膀胱癌侵袭转移的影响将是我们下一步研究的方向。
综上所述,本研究结果表明木犀草素能抑制膀胱癌5637细胞迁移、侵袭、MMP-2/9分泌及TGF-β诱导的EMT发生,其机制与抑制Akt/IKK信号通路有关。这一结果为木犀草素今后的开发利用提供了重要的实验依据。