Homer1基因真核表达重组质粒构建及HT22细胞转染鉴定
曹敏,张晓敏,王培昌,刘静
首都医科大学宣武医院,北京100053
Homer1基因定位于人染色体5q14.2,其编码蛋白是一类突触后支架蛋白,主要由短类型Homer1a和长类型Homer1b/c组成[1]。Homer1a含有一个高度保守的激活/血管扩张刺激磷蛋白同族体1(EVH1)同源结构域,而Homer1b/c不仅含有EVH1同源结构域,C末端还存在卷曲螺旋结构域和两个亮氨酸拉链基序[2]。Homer1a C末端缺乏多聚化序列,不具备长类型Homer1b/c的功能,但能竞争性结合Homer1b/c相关结合蛋白,从而起到负性调节作用[3]。Homer1蛋白主要分布于脑、心肌、骨骼肌等组织[4],能够参与突触形成、神经元信号传导、调节细胞内外Ca2+水平等[5]。有研究证实,Homer1蛋白在创伤性脑损伤(TBI)、阿尔茨海默病(AD)、抑郁症等疾病中发挥重要作用[6]。全基因组关联研究发现,重度抑郁症患者存在Homer1基因变异[7];敲除Homer1基因的小鼠可表现出与抑郁症小鼠相似的行为,这可能与Homer1蛋白与脑内代谢型谷氨酸受体(mGluRs)信号通路有关[8]。在AD小鼠脑组织中发现Homer1a表达下降,同时发现在AD小鼠脑组织中Aβ寡聚体可通过与mGluRs5、Homer1蛋白结合,影响神经元内外Ca2+水平,从而降低神经元兴奋性[9]。Homer1a是一种保护性蛋白,TBI发生后其表达迅速升高,并通过调节mGluRs-ERK信号通路,减轻神经元水肿,改善神经系统功能[10]。Homer1蛋白在神经系统疾病中的作用被广泛研究,但Homer1蛋白在AD中对Aβ清除的影响及其对神经元的保护作用缺乏深入研究。2019年1~8月,本研究构建了Homer1基因真核表达重组质粒,并在HT22细胞中转染和鉴定,为研究Homer1蛋白对脑内Aβ清除的影响及在AD发病机制中的作用奠定基础。
1 材料与方法
1.1 材料 小鼠海马神经元细胞系HT22(以下称HT22细胞),购自赛百慷(上海)生物技术股份有限公司;大肠杆菌TOP10感受态细胞,购自天根生化科技(北京)有限公司。APP/PS1双转基因小鼠,雌雄不限,9月龄,体质量25~35 g,购自北京华阜康生物科技股份有限公司。荧光定量PCR仪,购自美国ABI公司。真核表达载体p3×FLAG-CMV-10,由中国科学院生物物理研究所提供;Homer1引物序列,由生工生物工程(上海)股份有限公司设计合成。限制性内切酶Hind Ⅲ、EcoRⅠ,购自美国NEB公司。5×All-In-One RT Master Mix,购自加拿大ABM公司;难转染细胞转染试剂jetOPTIMUS,购自法国Polyplus-transfection公司;DNA聚合酶Phanta®Max Super-Fidelity DNA Polymerase,购自南京诺唯赞生物科技有限公司;兔源Flag一抗,购自美国Sigma公司;HRP标记的山羊抗兔IgG二抗,购自北京中杉金桥生物技术有限公司。
1.2 Homer1基因真核表达重组质粒构建与鉴定
1.2.1 Homer1基因真核表达重组质粒构建 取APP/PS1双转基因小鼠海马组织约50 mg,采用TRIzol法提取组织总RNA,经紫外分光光度计鉴定,提取的总RNA浓度和纯度合格,可用于后续实验。按5×All-In-One RT Master Mix说明,将总RNA逆转录为cDNA。逆转录条件:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 min。依据GenBank数据库中鼠Homer1基因mRNA的序列(NM_001284189.2),设计巢式PCR引物,并在引物两端加入酶切位点EcoRⅠ、HindⅢ。第1对引物序列:上游引物5′-CCCAAGCTTATGGGGGAGCAACCTATC-3′,下游引物5′-GGAATTCTTAGCTGCATTCCAGTAGC-3′;第2对引物序列:上游引物5′-CCCAAGCTTATGGGGGAGCAACCTATC-3′,下游引物5′-GGAATTCTTAGCTGCATTCCAGTAGC-3′。按Phanta®Max Super-Fidelity DNA Polymerase说明,以这两对引物为cDNA模板进行PCR扩增。PCR扩增体系共50 μL:2×Phanta Max Buffer 25 μL,dNTP 1 μL,上下游引物各2 μL,cDNA模板1 μL,ddH2O补足至50 μL;反应条件:95 ℃ 30 s,95 ℃ 10 s、60 ℃ 30 s、72 ℃ 30 s共35个循环,最后72 ℃ 10 min。PCR扩增产物经1%琼脂糖凝胶电泳分离后,用DNA凝胶回收试剂盒回收,然后用限制性内切酶EcoRⅠ、Hind Ⅲ分别对Homer1基因扩增产物和p3×FLAG-CMV-10载体进行双酶切。Homer1基因扩增产物于37 ℃酶切2 h,p3×FLAG-CMV-10载体于37 ℃酶切4~6 h。将双酶切后的目的基因Homer1与p3×FLAG-CMV-10载体按3∶1混合,加入T4 DNA连接酶,室温连接1 h。将连接产物转化大肠杆菌TOP10感受态细胞,37 ℃ 200 r/min摇菌45 min,将转化后菌液涂布于含氨苄青霉素的LB固体培养基,37 ℃孵育过夜。
1.2.2 Homer1基因真核表达重组质粒酶切鉴定 从LB固体培养基上挑取4~6个单克隆菌落,分别接种于10 mL含氨苄青霉素的液体LB培养基,37 ℃ 200 r/min摇菌12~14 h,按质粒小提试剂盒说明提取质粒。将提取的质粒收集至离心管中,用限制性内切酶EcoRⅠ、Hind Ⅲ进行双酶切。酶切产物经1%琼脂糖凝胶电泳分离,利用凝胶成像系统在紫外灯下观察DNA条带,根据DNA条带大小判断真核表达重组质粒是否构建成功。
1.2.3 Homer1基因真核表达重组质粒测序 构建成功的Homer1基因真核表达重组质粒送生工生物工程(上海)股份有限公司进行测序,并将测序结果与GenBank中Homer1基因的cDNA序列进行比对。
1.3 Homer1基因真核表达重组质粒转染与鉴定
1.3.1 Homer1基因真核表达重组质粒转染HT22细胞 取HT22细胞约1×106个,接种于含10% FBS的DMEM培养基中,置于37 ℃、5% CO2的恒温细胞培养箱培养。每2天更换1次培养基。当细胞生长融合90%以上时,0.25%胰蛋白酶消化,收集细胞并接种于6孔板,于37 ℃、5% CO2的恒温细胞培养箱培养。随机将细胞分为p3×FLAG-CMV-10-Homer1重组质粒组、p3×FLAG-CMV-10空载体组、空白对照组,每组设3个复孔。当细胞生长融合60%~70%时,根据难转染细胞转染试剂jetOPTIMUS说明,p3×FLAG-CMV-10-Homer1重组质粒组加入p3×FLAG-CMV-10-Homer1重组质粒2 μg、jetOPTIMUS Buffer 200 μL、jetOPTIMUS reagent 2 μL,p3×FLAG-CMV-10空载体组加入p3×FLAG-CMV-10空载体2 μg、jetOPTIMUS Buffer 200 μL、jetOPTIMUS reagent 2 μL,空白对照组加入jetOPTIMUS Buffer 200 μL、jetOPTIMUS reagent 2 μL,37 ℃、5% CO2的恒温细胞培养箱培养。培养5~6 h,弃掉原培养基,加入含10% FBS的DMEM培养基继续培养48 h。
1.3.2 转染Homer1基因真核表达重组质粒的HT22细胞鉴定 收集上述转染后的HT22细胞,RIPA裂解提取细胞总蛋白,经BCA法蛋白定量合格后,加入Loading上样缓冲液,100 ℃水浴变性。取变性蛋白40 μg,SDS-PAGE(10%分离胶、5%浓缩胶)分离蛋白。电泳结束后,采用湿转法将蛋白电泳产物转印至PVDF膜,5%脱脂奶粉封闭2 h,分别加入Flag一抗(稀释比1∶1 000)、GAPDH一抗(稀释比1∶5 000),4 ℃孵育过夜。次日,分别加入HRP标记的山羊抗兔或山羊抗小鼠二抗(稀释比1∶10 000),室温孵育1 h,ECL发光,暗室中曝光、显影。Image J软件分析各蛋白电泳条带灰度值。以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。

2 结果
2.1 Homer1基因真核表达重组质粒构建结果 含酶切位点的Homer1基因序列经PCR扩增和1%琼脂糖凝胶电泳分离发现,扩增产物片段大小约为1 064 bp,与目的基因片段大小一致。
2.2 Homer1基因真核表达重组质粒酶切鉴定结果 利用限制性内切酶EcoRⅠ、Hind Ⅲ对重组质粒p3×FLAG-CMV-10-Homer1进行双酶切,经1%琼脂糖凝胶电泳分离,在凝胶成像系统中紫外灯下可见1 064 bp处的Homer1目的片段和6 200 bp处的p3×FLAG-CMV-10载体片段。
2.3 Homer1基因真核表达重组质粒测序结果 将酶切鉴定阳性的Homer1基因真核表达重组质粒送生工生物工程(上海)股份有限公司进行测序,测序结果与在GenBank中检索的Homer1基因cDNA序列进行比对,证实Homer1基因中插入了p3×FLAG-CMV-10载体。见图1。
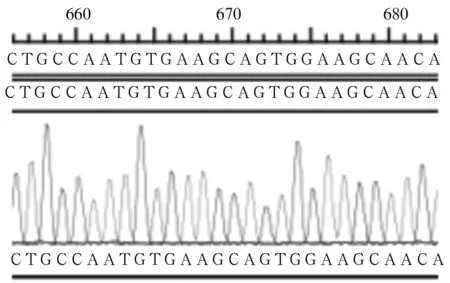
图1 Homer1基因真核表达重组质粒序列与GenBank中检索的Homer1基因cDNA序列比对结果
2.4 各组Homer1蛋白表达比较 p3×FLAG-CMV-10-Homer1重组质粒组、p3×FLAG-CMV-10空载体组、空白对照组Homer1蛋白相对表达量分别为4.91±0.87、1.27±0.42、0.80±0.28。p3×FLAG-CMV-10-Homer1重组质粒组Homer1蛋白相对表达量明显高于p3×FLAG-CMV-10空载体组、空白对照组(P均<0.05),而p3×FLAG-CMV-10空载体组与空白对照组Homer1蛋白相对表达量比较P>0.05。
3 讨论
Homer1蛋白是一种常见的骨架蛋白,主要由短类型Homer1a和长类型Homer1b/c组成。Homer1蛋白广泛存在于脑组织、心肌和骨骼肌中,其在神经系统中作为突触后支架蛋白被广泛研究[11]。Homer1蛋白可与多种钙离子通道蛋白结合,如内质网钙通道蛋白、三磷酸肌醇受体、mGluRs等[12],能够改变细胞内外Ca2+水平,调节突触膜电位,改变突触可塑性。研究发现,谷氨酸过度释放能够使神经元兴奋过度,可能会导致神经元死亡,而Homer1a蛋白通过降低Ca2+内流,减少氧化应激、降低N-甲基-D天冬氨酸(NMDA)受体下游信号通路活性、改变NMDA受体在细胞膜上的分布,从而对神经元起到保护作用[13]。
AD的主要病理改变是神经元细胞内Aβ沉积和神经元细胞外Tau蛋白高度磷酸化形成的神经纤维缠结。Aβ沉积和神经纤维缠结能够加速神经元不可逆性死亡,AD患者逐渐出现记忆力下降、失语、认知功能障碍等,最终发展为痴呆[14]。目前对AD药物治疗的主要研究方向集中在如何清除脑内Aβ沉积,减少神经元死亡。最近有研究对AD小鼠腹腔长期注射Ca2+通道抑制剂1,4-二氢吡啶衍生物AP-12后发现,小鼠空间学习记忆能力显著改善,其大脑扣带回和海马中发现谷氨酸脱羧酶67和囊泡型γ氨基丁酸转运体表达增加,虽然海马内Homer1表达无明显变化,但扣带回Homer1表达明显升高[15]。这为AD的治疗提供了一个新的方向,即利用Ca2+通道抑制剂阻断大脑Ca2+通道,调节突触可塑性,进而改善记忆功能。
本研究首先构建了Homer1基因真核表达重组质粒,含酶切位点的Homer1基因序列经PCR扩增和1%琼脂糖凝胶电泳分离发现,扩增产物片段大小与目的基因片段大小一致;经双酶切和1%琼脂糖凝胶电泳分离,在凝胶成像系统中紫外灯下可见1 064 bp处的Homer1目的片段和6 200 bp处的p3×FLAG-CMV-10载体片段;酶切鉴定阳性的Homer1基因真核表达重组质粒经生工生物工程(上海)股份有限公司测序并与GenBank中检索的Homer1基因cDNA序列进行比对,证实Homer1基因中插入了p3×FLAG-CMV-10载体。以上结果表明,Homer1基因真核表达重组质粒构建成功。
HT22细胞是一种永生化的小鼠海马神经元细胞,具有典型的神经元形态和特征,被广泛用于AD、帕金森病等神经退行性疾病的基础研究[16]。由于小鼠原代神经元取材困难且不能传代培养,通常用HT22细胞代替小鼠原代神经元进行实验。本研究将Homer1基因真核表达重组质粒转染HT22细胞,使HT22细胞Homer1蛋白过表达,进而研究Homer1蛋白在小鼠海马神经元中对Aβ、Tau蛋白及脑内Ca2+通道的影响。结果发现,p3×FLAG-CMV-10-Homer1重组质粒组Homer1蛋白相对表达量明显高于p3×FLAG-CMV-10空载体组、空白对照组,而p3×FLAG-CMV-10空载体组与空白对照组Homer1蛋白相对表达量比较差异无统计学意义,提示本研究构建的Homer1基因真核表达重组质粒能够转染入小鼠海马神经元。
综上所述,本研究成功构建了p3×FLAG-CMV-10-Homer1基因真核表达重组质粒,并成功转染入HT22细胞,这为研究Homer1蛋白对脑内Aβ清除的影响及在AD发病机制中的作用奠定了基础。
——一道江苏高考题的奥秘解读和拓展

