氨基化树枝状介孔二氧化硅固定葡萄糖氧化酶用于检测葡萄糖
王 欢,所金泉,王春艳,王润伟
(1.吉林大学公共卫生学院,长春 130021;2.吉林大学化学学院,长春130012)
葡萄糖是动植物碳水化合物的主要成分,葡萄糖的定量测定在生命科学中占有重要地位[1,2],葡萄糖的检测方法主要有分光光度法、安培法、高效液相色谱法、极谱法和毛细管电泳法等[3],但多数方法存在耗时长、检测费用高等缺点.酶是一类具有较高催化活性的生物催化剂,有较高的底物特异性[4~6],葡萄糖氧化酶(GOD)可催化β-D-葡萄糖氧化生成葡萄糖酸和过氧化氢[7],酶法检测葡萄糖具有准确快速、灵敏度高的特点.近年来,葡萄糖氧化酶法已被广泛用于生物化学、临床化学及食品分析中葡萄糖的检测[8~10],酶在正常条件下表现出很高的选择性和反应性,但对pH 和温度较敏感而易失活[11],游离酶价格昂贵且使用一次后不能回收利用,增加了检测成本.酶的固定化在很大程度上能够解决上述问题,固定化GOD 用于检测葡萄糖含量具有反应时间短、保存期较长、灵敏度高及反应快捷等优点[12,13].酶固定化方法有物理法和化学法2 大类[14],其中物理法包括吸附法和包埋法;化学法包括共价结合法和交联法等[15].二氧化硅由于本身无毒,具有化学和生物惰性,而成为一种优良的酶固定化载体.Balistreri 等[16]通过偶联脂质体囊泡将葡萄糖氧化酶GOD 固定在仿生二氧化硅颗粒中,用仿生硅化过程模拟细胞微环境,GOD 的回收率达到71.8%,固定化GOD 的热稳定性和pH 稳定性均有所提高,也显著改善了其耐受性和可重复使用性.因此,寻找一种能够提高酶活保留率以及重复使用次数的酶固定化载体是工作的重点.
树枝状介孔二氧化硅纳米材料(DMSNs)是一种具有特殊形貌的酶固定化载体.DMSNs 比传统的介孔二氧化硅材料有如下优势: (1) 整体形貌为树枝状,开放性较好,内有树枝状空腔,存在10 ~25 nm的内部外部堆积孔;(2) 可调控性强,由于表面含有裸露的硅羟基,可与功能化硅烷缩合,形成具有功能基团(巯基、氨基或羧基)的表面,且其粒径和孔径尺寸等可调;(3) 材料稳定性较高,不易被破坏;(4) 较大的比表面积可以提高酶的蛋白载量.上述性能说明DMSNs 是一种优良的酶固定化载体,目前,关于3-氨基丙基三乙氧基硅烷(APTES)修饰树枝状介孔二氧化硅的研究鲜有文献报道.
本文利用APTES 对DMSNs 材料进行氨基修饰,合成了氨基化树枝状介孔二氧化硅纳米粒子(DMSNs-NH2);并用此材料作为载体制备了固定化GOD(DMSNs-NH2-GOD).考察了固定GOD 时酶浓度和固定时间对固定效果的影响,研究了固定化GOD 的酶学性质,利用固定化GOD 进行了葡萄糖的定量检测.该方法具有灵敏度高、检测快速及重复利用率高等特点,最低检测限为0.0014 mg/mL,20 min即可完成样品中葡萄糖的检测.固定化GOD 可用于重复检测血清,使用36 次后酶活性仍大于80%;将固定化GOD 用于检测饮料中的葡萄糖,重复使用41 次后酶活性仍大于80%.该研究解决了现有固定化技术存在的酶浪费问题,降低了检测成本,固定化酶的pH 稳定性和热稳定性均显著高于游离酶,拓宽了固定化酶的研究领域.
1 实验部分
1.1 试剂与仪器
葡萄糖氧化酶(GOD)、辣根过氧化物酶(HRP)、Bradford 蛋白浓度测定试剂盒、三乙胺(TEA)和3-氨基丙基三乙氧基硅烷(APTES)购于Solarbio 科技有限公司;邻联茴香胺购于Macklin 公司;葡萄糖、无水乙酸钠和冰乙酸购于北京化工厂;正硅酸乙酯(TEOS,纯度98%)和浓氨水(NH3·H2O,质量分数28%)购于国药集团化学试剂有限公司;十六烷基三甲基溴化铵(CTAB)购于惠世生物试剂公司;实验所用试剂均为分析纯,超纯水为实验室自制.
TecnaiG2 F20s-twin D573 型场发射透射电子显微镜(TEM,美国FEI 公司);VERTEX 80v 型傅里叶变换红外光谱仪(FTIR,美国 Bruker 公司);Rigaku D/Max 2550X/PC 型 X 射线衍射仪(XRD,日本理学公司);JSM-6700F 型场发射扫描电子显微镜(SEM,日本 JEOL 公司);STA 449C 型差热-热重分析仪(德国Netzsch 公司);多功能微孔板监测仪-酶标仪(美国Bio-Rod 伯乐公司);Allegra X-30R 型离心机(美国贝克曼库尔特公司).
1.2 实验过程
1.2.1 DMSNs-NH2的合成 将0.68 g TEA 和20 mL 超纯水加入到100 mL 烧杯中,于80 ℃水浴30 min;再加入 0.38 g CTAB 和 0.16 g 水杨酸钠,于 80 ℃水浴 30 min;快速加入 4 mL TEOS,于 80 ℃水浴 2 h,离心,用超纯水和乙醇各洗涤 2 次,置于 80 ℃烘箱干燥整夜.取 0.30 g 上述材料,加入60 mL 乙醇和 0.77 mL 浓盐酸,水浴 6 h,离心后用乙醇清洗 2 次,置于 80 ℃ 烘箱干燥,研磨,即得DMSNs.
将0.50 g DMSNs 加入到盛有100 mL 甲苯的圆底烧瓶中,于80 ℃加热至澄清后,加入0.5 mL APTES,于 80 ℃加热回流 4 h,离心,沉淀用甲苯清洗 2 次,干燥过夜,经研磨后得到 DMSNs-NH2.
1.2.2 DMSNs-NH2固定化GOD 将10.0 mg DMSNs-NH2加入到10 mL GOD 溶液中,于4 ℃冰浴条件下匀速搅拌进行酶的固定.将混悬液离心,沉淀经冷冻干燥即得固定化GOD(DMSNs-NH2-GOD),置于4 ℃冰箱保存备用;上层清液采用Bradford 法测定蛋白浓度[17].分别改变酶固定过程中的酶浓度(0.1~0.6 mg/mL)和酶固定时间(4~12 h),其它条件不变,在4 ℃条件下匀速搅拌,考察其对GOD蛋白载量及活性的影响.
1.2.3 固定化酶性质测定 采用文献[18]方法测定固定化GOD 和游离GOD 的活性.向由5.0 mL 邻联茴香胺-甲醇缓冲液、0.6 mL 18%葡萄糖溶液、0.2 mL 0.03%HRP 溶液和0.2 mL 乙酸-乙酸钠缓冲液(pH=5.0)的混合溶液中,分别加入一定体积的固定化GOD 和游离GOD,于35 ℃反应3 min 后,迅速加入3% H2SO4溶液各2 mL 终止反应.空白对照是加入同体积煮沸去活的酶液作为对比,其它条件均相同.用紫外-可见分光光度计测定上层清液在460 nm 处的吸光度值,计算GOD 活性.酶活性(U/g)定义: 35 ℃时,每分钟氧化1.0 μmolβ-D-葡萄糖为D-葡萄糖酸内酯和过氧化氢的酶量为一个酶活单位.按照上述酶活性的测定方法,以相对酶活性为参考指标,测定固定化GOD 和游离GOD 的最适pH、最适温度、pH 稳定性、热稳定性及储存稳定性.
1.2.4 固定化GOD 检测实际样品及重复使用性 对检测条件进行了优化,确定了最佳检测时间和固定化GOD 加入量.采用建立的检测方法对不同浓度(0.001 ~0.500 mg/mL)的葡萄糖标准溶液进行检测,测定上层清液的吸光度值,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制标准曲线,经计算得出检出限.
血液样本经离心后得到血清,稀释10 倍后备用;含有葡萄糖的果汁饮料样本经过滤稀释100 倍备用.在样品管中加入3.0 mg 固定化GOD,3.0 mL 显色液,0.5 mL 超纯水和0.5 mL 待测稀释液,每个样品设3 个平行样,空白对照不加固定化GOD,其它均相同,于40 ℃反应20 min,离心后测定上层清液在505 nm 处的吸光度值,经计算得出实际样品中的葡萄糖浓度,并与游离酶检测结果进行对比.每次检测完成后,离心分离并洗涤固定化GOD,再进行重复使用,将第一次使用时的固定化GOD 活性视为100%,之后每次的活性用与第一次对比后保留的活性表示.
2 结果与讨论
2.1 DMSNs-NH2 的结构表征
2.1.1 形貌表征 图1(A)和(B)分别为DMSNs-NH2的SEM 和TEM 照片.由图1(A)可见,该材料分散性较好,粒径约为200 nm.图1(B)表明,材料有褶皱状孔道直通内部,呈树枝状,皱襞较薄,整体开放性较好,可为酶的固定化提供更多的空间.

Fig.1 SEM(A) and TEM(B) images of DMSNs-NH2
2.1.2 红外光谱分析 对GOD,DMSNs-NH2及DMSNs-NH2-GOD 进行了红外光谱分析.由DMSNs-NH2的红外光谱图(图2 谱线c)可见,1088 cm-1处有 1 个较宽的 Si—O 键吸收峰[19],2827 和 2960 cm-1处的峰为亚甲基的C—H 键伸缩振动峰,1636 cm-1处有—NH2的振动峰,表明氨基已修饰到DMSNs上[20].GOD 的红外光谱图(图2 谱线a)上,1646 和1526 cm-1处的峰分别为酰胺Ⅰ键和酰胺Ⅱ键的吸收峰,DMSNs-NH2-GOD 的红外光谱图(图2 谱线b)上也有相同的峰,说明GOD 已固定在DMSNs-NH2上[21~23].
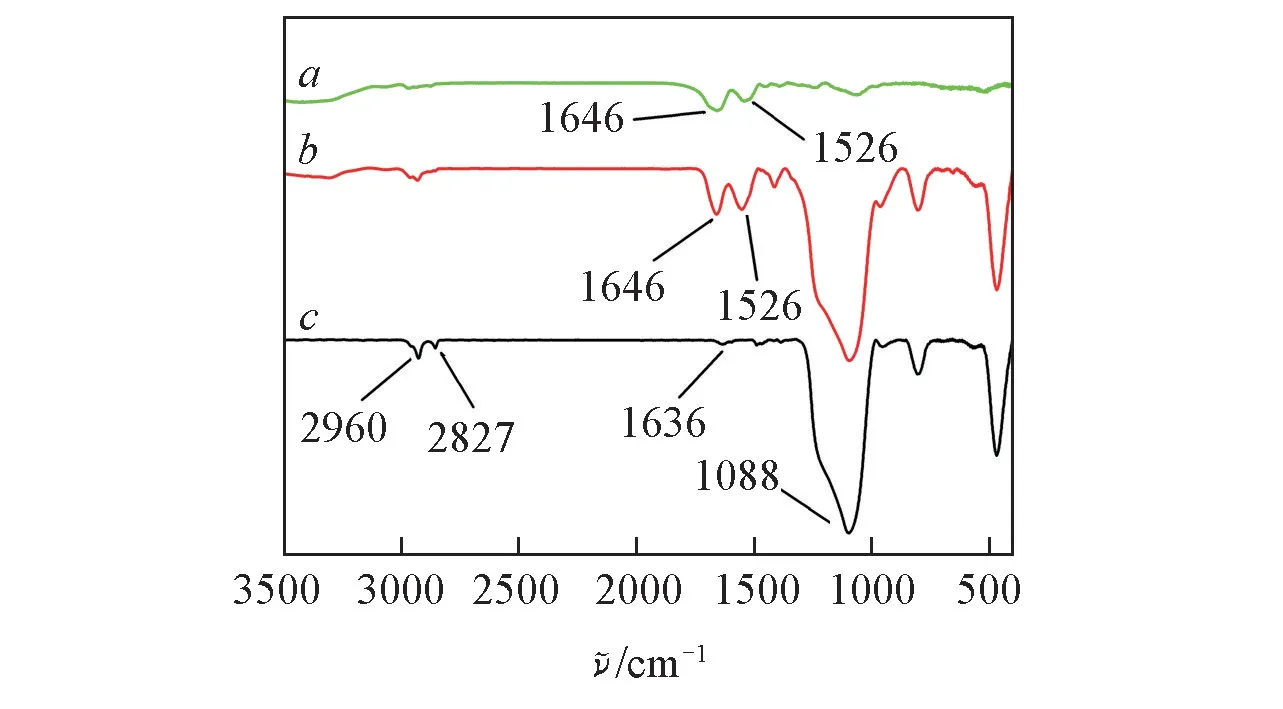
Fig.2 FTIR spectra of GOD(a),DMSNs-NH2-GOD(b) and DMSNs-NH2(c)
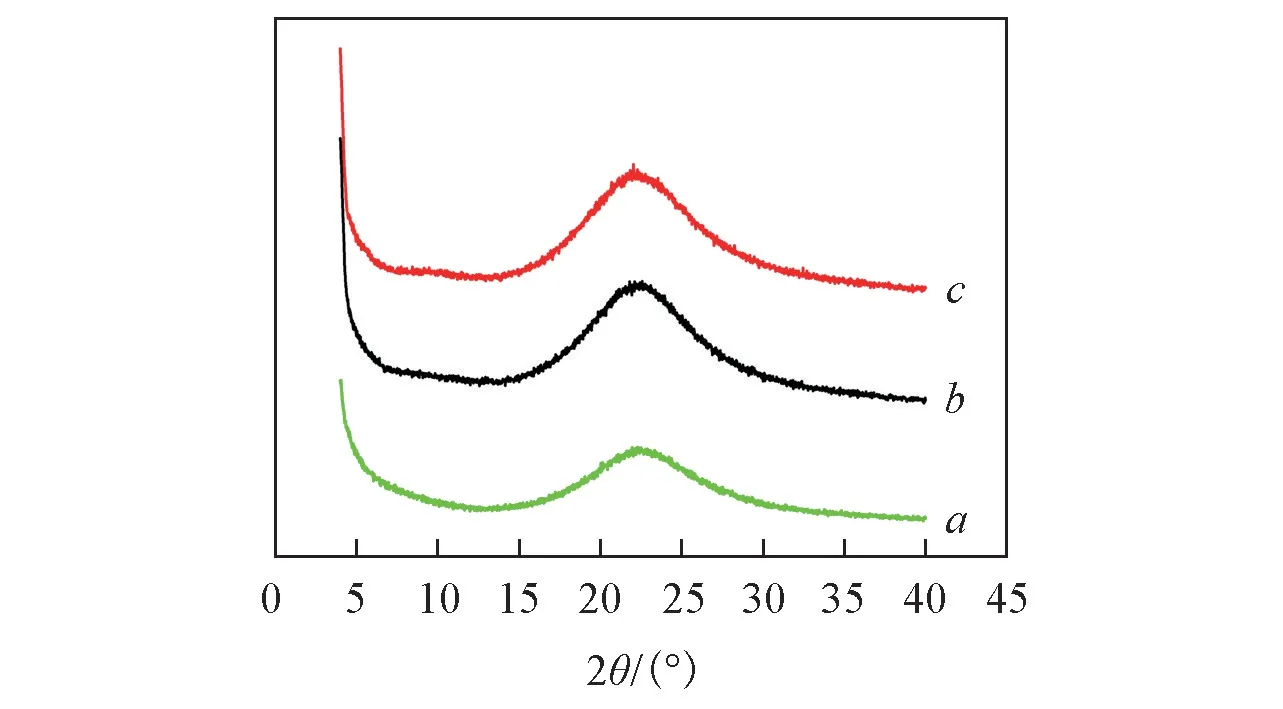
Fig.3 XRD patterns of DMSNs(a),DMSNs-NH2(b) and DMSNs-NH2-GOD(c)
2.1.3 XRD 分析 图3 为 DMSNs,DMSNs-NH2和 DMSNs-NH2-GOD 的 XRD 谱图.可见,3 个样品均在2θ=23°处出现非晶面衍射峰,说明样品为无定形SiO2,树枝状介孔二氧化硅经过氨基修饰和加载GOD后,并未对结构产生影响.
2.1.4 气体吸附性能 由图4 可知,DMSNs-NH2和DMSNs-NH2-GOD 的N2吸附-脱附曲线是典型的Ⅳ型曲线,曲线后端存在1 个H3 型滞后环,表明DMSNs-NH2为介孔材料.利用BET 法和BJH 法计算得出DMSNs-NH2的比表面积和孔容分别为215.19 m2/g 和0.88 cm3/g,DMSNs-NH2-GOD 的比表面积和孔容分别为165.06 m2/g 和0.64 cm3/g,表明 GOD 已经固定在该载体上.在相对压力(p/p0)为0.1~0.8 范围内,曲线较平缓,这是因为氮气分子以单层吸附在孔道表面;在相对压力为0.8 ~1.0时,有一个明显的突跃,这是由于氮气在材料孔道中发生毛细凝聚所致.由图4 插图可见,材料孔径主要集中在约25 nm,孔径均匀.以上结果表明,DMSNs-NH2的比表面积和孔容均较大,有利于酶的固定[24,25].
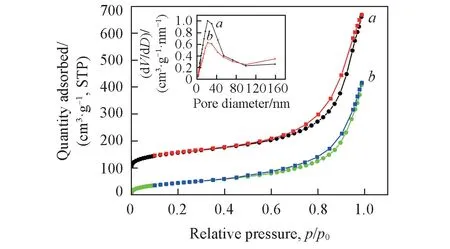
Fig.4 N2 adsorption-desorption isotherms and pore size distribution plots (inset) of DMSNs-NH2 (a)(translate up 100) and DMSNs-NH2-GOD(b)
2.1.5 热重分析 对样品进行了热重分析(TGA),空气气氛,升温速率为10 ℃/min,温度范围为25~800 ℃.如图5 所示,当温度升高后,2 个样品均在25~110 ℃和320~650 ℃区间出现了2 个失重阶段,分别是由水和氨丙基的失去引起的;当温度达到800 ℃时,DMSNs-NH2质量共损失15%,而DMSNs-NH2-GOD 质量损失达27%,说明从DMSNs-NH2-GOD 到DMSNs-NH2又损失了12%,该差值是由固定在DMSNs-NH2上的GOD 产生的,进一步说明GOD 已固定在DMSNs-NH2材料上.
2.2 GOD 固定条件的优化
考察了固定GOD 时酶浓度和固定时间的影响.测定了不同浓度GOD 溶液固定时的蛋白载量和酶活性,结果如图6(A)所示,当酶浓度较低时,蛋白载量和酶活性均随着酶浓度的增大而逐渐增加,且酶活性在酶浓度为0.30 mg/mL 时达到最大,此时载体上的氨基与酶分子表面的羧基结合;当酶浓度继续增加时,载体上酶分子的量达到饱和,产生了空间位阻与扩散阻力,酶活性受到了抑制[26],因此,GOD 固定的最适酶浓度为0.30 mg/mL.测定了不同固定时间下GOD 的蛋白载量,结果如图6(B)所示,GOD 的蛋白载量随着固定时间的延长逐渐增加,并在6 h 达到饱和状态.初步研究[27]表明,酶负载量过大会降低酶的迁移率,多层吸附会阻断酶的活性位点.因此,最适宜固定时间为6 h,最适宜酶浓度为0.30 mg/mL.
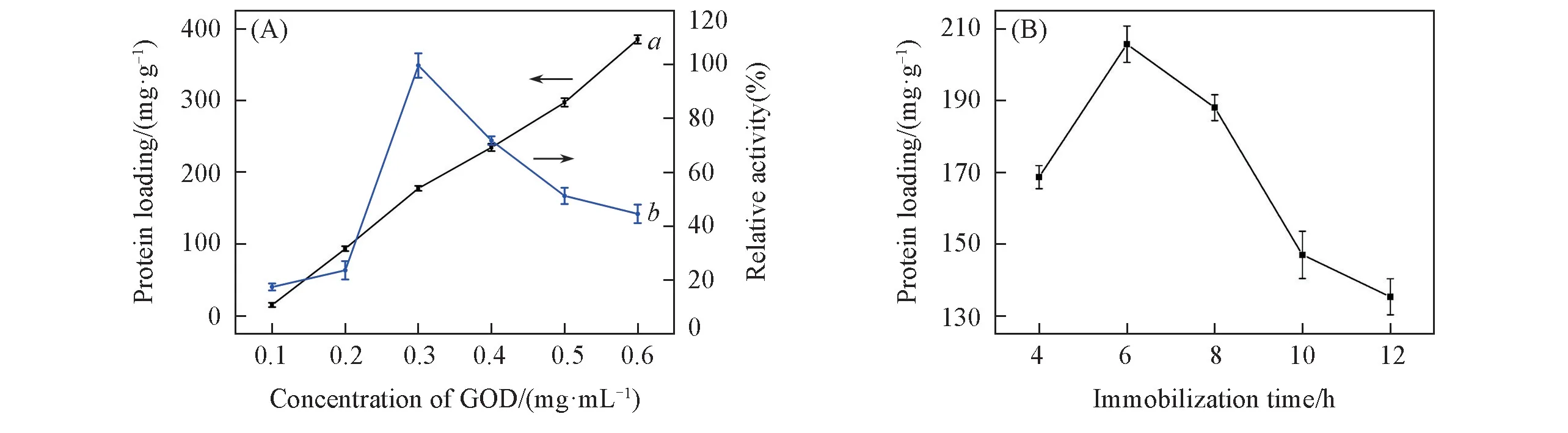
Fig.6 Optimum concentration(A) and immobilization time(B) for GOD immobilization
2.3 固定化GOD 的性质
2.3.1 固定化GOD 的pH 稳定性 分别将游离GOD 与固定化GOD 置于pH=2.0~7.0 的缓冲液中2 h后,测定酶活性.如图7(A)所示,游离GOD 在pH=3.5 ~4.5 范围内活性较高,而在偏酸和偏碱性环境下,活性显著下降.固定化GOD 在pH=2.0~6.0 范围内活性较高,在pH=5.0 时达到最大酶活,当pH>6.0 时,固定化GOD 的相对酶活性剩余75%以上,而游离GOD 仅剩余55%.由于酶分子被固定在载体内部,树枝状孔隙结构对酶形成了保护,与游离GOD 相比,固定化GOD 更耐酸碱,pH 稳定性更好.
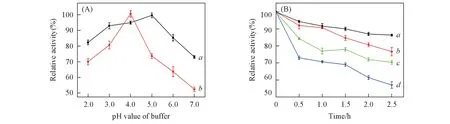
Fig.7 pH stability(A) of immobilized enzyme(a) and free enzyme(b) and thermal stability of immobilized enzyme and free enzyme(B)
2.3.2 固定化GOD 的热稳定性 分别将游离GOD 和固定化GOD 置于50 和60 ℃水浴箱中保存2.5 h后测定酶活.由图7(B)可见,在50 ℃下保存2.5 h 后,固定化GOD 酶的活性仅减少10%,而游离GOD 酶活性减少了20%;在60 ℃下保存2.5 h 后,固定化GOD 酶活性剩余75%,保留了较高的相对酶活性,而游离GOD 酶活性仅剩57%.其原因是高温会加速热运动,而酶的催化作用与蛋白的四级结构有关,当温度过高时,自由酶不能保持稳定的催化构象,而固定化GOD 的载体则可有效抑制酶蛋白的过度运动,从而减缓了高温对酶催化活力的影响,降低了高温引起的酶分子变性.由此可知,GOD 经过固定化后热稳定性得到了显著改善[28].
2.3.3 固定化GOD 的储存稳定性 将固定化GOD 储存在4 ℃冰箱中,每周定期抽取一批样品,比较游离GOD 与固定化GOD 的储存稳定性.结果如图8所示,储存 2 个月后,固定化GOD 酶活性剩余93%,而游离GOD 酶活性仅剩余76%,表明 GOD 经过固定后,储存稳定性得到了提高.

Fig.8 Storage stability of immobilized enzyme(a)and free enzyme(b)
2.4 固定化GOD 的应用
2.4.1 葡萄糖检测条件的优化 考察了固定化GOD 检测葡萄糖时检测时间和固定化GOD 加入量对检测的影响.将固定化GOD 与葡萄糖底物溶液(0.1 mg/mL)反应不同时间测定吸光度值,结果表明,当反应时间为20 min 时,底物反应完全,因此检测的最佳反应时间为20 min.用不同含量的固定化GOD检测葡萄糖底物溶液(0.1 mg/mL),当固定化GOD 加入量为3.0 mg 时底物反应完全,故选择最佳固定化GOD 的加入量为3.0 mg.
2.4.2 葡萄糖检出限的确定 配制一系列不同浓度的葡萄糖标准溶液,用固定化GOD 对其进行检测.结果如图9 所示,随着葡萄糖含量的增大,吸光度值增加,二者在0.001~0.500 mg/mL 浓度范围内呈现良好的线性关系,线性方程为y=4.9883x+0.0025,R2=0.9987,检出限为 0.0014 mg/mL.
2.4.3 实际样本检测和重复使用性 采用本文方法对4 份血清样本(来自4 名志愿者)进行了检测.血样于4 ℃经离心得到血清,稀释10 倍,用固定化GOD 对其进行检测,每个样品设3 个平行样,并与游离GOD 检测方法进行对比,结果如表1 所示.经统计分析,P值均大于0.05,说明2 种检测方法无显著性差异,检测结果可靠.图10(A)显示,固定化GOD 用于重复检测血清,使用36 次后,酶活性仍大于80%,说明测方法重复使用性较好,可用于临床血样分析.
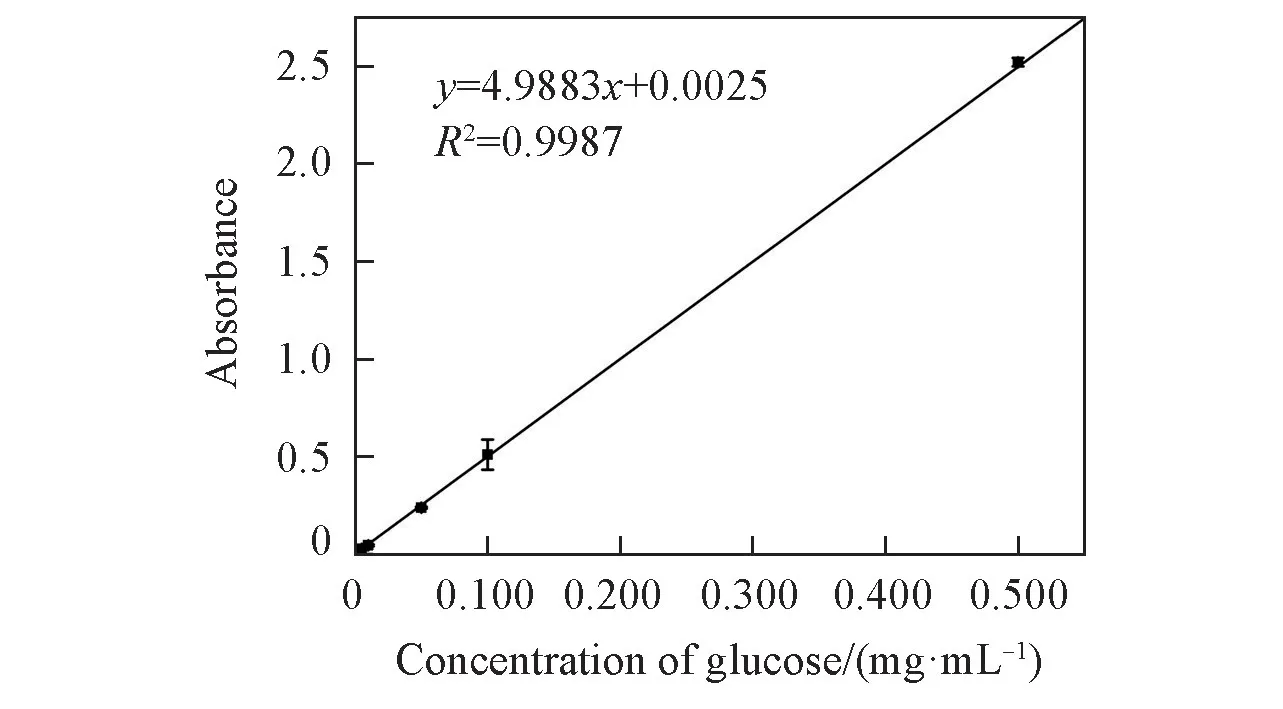
Fig.9 Linear equation for determination of glucose
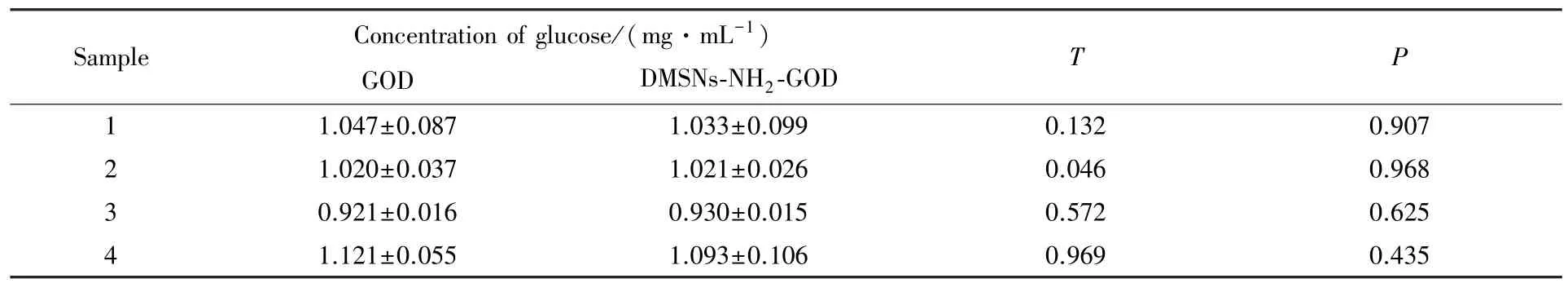
Table 1 Results of serum detection by GOD and DMSNs-NH2-GOD(n=3)

Fig.10 Reusability of immobilized enzymes in detecting serum(A) and drinks samples(B)
将市售果汁饮料样本过滤后,取1 mL 滤液置于100 mL 容量瓶中,用超纯水稀释至刻度后混合均匀,备用.采用本文方法进行检测,每个样品设3 个平行样,并与游离GOD 检测结果(国标法[29])进行对比.结果表明,固定化GOD 检测所得葡萄糖浓度为(19.884±0.213) mg/mL,游离GOD 检测所得葡萄糖浓度为(20.172±0.169) mg/mL ,经统计学分析,T=-1.415,P=0.293,说明 2 种检测方法无显著性差异.检测完成后,固定化GOD 经缓冲液清洗后可重复进行检测,由[图10(B)]可见,固定化GOD 重复使用41 次后酶活性仍大于80%.
3 结 论
合成了氨基修饰的树枝状介孔二氧化硅纳米粒子(DMSNs-NH2),利用其对葡萄糖氧化酶(GOD)进行了固定化研究.建立了应用固定化GOD 检测葡萄糖的方法,并对临床样本和食品样本进行了检测分析.结果表明,固定化GOD 能够准确检测血清及饮料中的葡萄糖含量,具有高稳定性、高重复性、高催化活性及不受其它物质干扰的特点;固定化GOD 用于检测血清样品时,重复使用36 次后仍保持80%以上的活性.

