电针对AD大鼠学习记忆能力及额叶皮质SIRT1/FOXO3a表达的影响*
光 磊 王 智 许志鹏 叶 伟 王 林 丁 见
皖南医学院 1 临床医学院2016级 2 人体解剖学教研室,安徽省芜湖市 241002
阿尔茨海默症(Alzheimer’s disease,AD)是一种以进行性认知功能障碍、学习记忆能力减退为主要特征的中枢神经系统退行性疾病。现代研究发现,诱发AD的因素有tau蛋白过度磷酸化形成的胞内神经纤维缠结和老年细胞外β-淀粉样蛋白(Aβ)聚集等[1]。在大鼠侧脑室内注射链脲佐菌素(Streptozotocin,STZ)可降低葡萄糖在大鼠皮质和海马区的代谢速度,导致Aβ的异常聚集,进而突触丢失、神经元结构损伤,最终出现大鼠的学习记忆功能障碍[2]。沉默信息调节因子2同源蛋白1 (Silent mating type information regulation 2 homolog 1,SIRT1)可通过增强α-分泌酶的活性或抑制NF-κB信号通路来减少β-淀粉样蛋白的病理性沉积,其激活后可改善AD大鼠海马区认知障碍,从而发挥神经保护作用,故被认为是预防和改善AD的重要靶基因[3]。叉头框转录因子O3a (Forkhead box O3a,FOXO3a)是叉头框蛋白O家族的核心,具有抗氧化、抗应激损伤等多种生物学功能[4]。AD的治疗目前尚无特效手段, 但有报道显示电针对改善AD患者的学习记忆功能具有明显的疗效[5]。由SIRT1、FOXO3a基因在神经元中表达的结果进一步表明SIRT1、FOXO3a在AD的改善中起着非常重要的作用,这将对AD的研究及诊治具有深远的意义。
1 材料与方法
1.1 实验动物与材料 从浙江省实验动物中心[动物证书编号:SCXK(浙江)2014-0001]购买18只雄性SD大鼠,体重(200±20)g。实验期间,为大鼠提供标准饲料、自由饮水、自然光照,饲养室恒温21~25℃,适应性饲养1周后,将健康SD大鼠随机分为对照组、模型组和电针组,每组6只。实验过程中对动物的操作和处理严格遵守《关于善待实验动物的指导性意见》的有关规定。
1.2 主要试剂与仪器 链脲佐菌素(STZ-S0130)购自Sigma公司;脑立位定位仪(上海江湾医疗器械厂);通透液(P0097-100ml)购自碧云天生物技术有限公司;Morris水迷宫视频分析系统(北京众实迪创科技发展有限责任公司);Nisslstaining溶液购自北京索莱宝科技有限公司;兔IgG-免疫组化试剂盒(SABC浓缩型)(SA2002 1/4KIT)、SIRT1抗体购自博士德生物工程有限公司;FOXO3a抗体购自北京博奥森生物技术有限公司;华佗牌电子针疗仪(苏州医疗用品厂有限公司);轮转式石蜡切片机(型号:RM2235,德国Leica公司);微量注射器(上海安亭进样器厂);BX 51显微镜;Express C图像分析系统(日本,OLYMPUS)。
1.3 制备AD模型及模型后治疗 造模:通过Morris水迷宫的试验筛选学习记忆功能正常的12只大鼠作为模型组和电针组,每组6只,以3ml/kg腹腔注射戊巴比妥钠进行麻醉,麻醉后将头部固定在脑立体定位仪上,剪去头部鼠毛,消毒,再沿矢状线切开约1.5cm,推开两侧骨膜暴露颅骨,微量加样器垂直进入脑室,在大鼠两侧侧脑室缓慢注射STZ(100mg/ml),距脑表面为3.6mm,注射时间为2min,留针3min,注射后缓慢拔出微量加样器,使用无菌骨蜡来封闭钻孔,再缝合消毒,防止大鼠感染死亡。若模型组大鼠4d平均逃避潜伏期高于对照组(P<0.05),平台象限滞留时间百分比低于对照组(P<0.05),提示造模成功。对照组缓慢注射等量人工脑脊液(100mg/ml),与上述相同处理。治疗:造模成功1周后,将电针组以3ml/kg腹腔注射戊巴比妥钠进行麻醉,麻醉成功后将大鼠侧卧位放置,针柄连接至电针仪,正极连接“大椎”穴,负极连接左侧“百会”穴,在顶骨正中向后平刺“大椎”穴2mm,在腓骨小头下方约5mm 处直刺左侧“百会”穴2mm,用频率为2Hz,强度为2V,波宽为1ms的电针连续治疗14d,30min/次,1次/d。对照组和模型组不予治疗。
1.4 Morris水迷宫 水迷宫检测实验共5d,分为定位导航实验和空间探索实验。定位导航实验:Morris水迷宫由圆形水池(半径60cm,高度60cm)和平台(直径9cm,放置于水下2cm)构成,水池被分为1、2、3、4四个象限,本实验平台位于第4象限。实验前1d,先将大鼠放到平台适应10s,再以第2象限为入水点,预游泳120s。之后的第1~4天,将大鼠分别从4个象限固定点面壁放入水中,记录每只大鼠找到平台的时间,即为逃避潜伏期。计时120s,若在平台滞留超过5s定义为找到平台。若滞留不足5s,则该鼠的逃避潜伏期记作120s,并将大鼠引至平台,停留10~15s。每只大鼠每天4个象限找到平台的时间取平均值作为该鼠当天的成绩,即为平均逃避潜伏期。空间探索实验:第5天把平台撤去, 按照上述方法把大鼠从4个象限依次面壁放入水中,记录120s内大鼠在平台象限的滞留时间和穿越原平台的次数。此实验均在水温(22±2)℃、黑暗环境中进行。
1.5 尼氏染色和免疫组化染色
1.5.1 取材:3ml/kg腹腔注射戊巴比妥钠进行麻醉,麻醉后备皮、消毒,从剑突下打开大鼠胸腔,暴露心脏,从心尖处插入吊瓶针至主动脉弓处,先注入100ml生理盐水,再注入300ml已过滤的多聚甲醛固定液(前100ml快速注入,剩余200ml缓慢注入),固定后取脑组织,将取出的脑组织放入4℃ 4%多聚甲醛固定液浸泡24h,再经过脱水、石蜡包埋后,将蜡块保存在4℃冰箱。
1.5.2 尼氏染色:参考《大鼠脑立体定向图谱Ⅲ》,取大鼠额叶皮质所在区段制备的石蜡切片,常规脱蜡,于Cresyl Violet Stain中56℃浸泡1h,去离子水冲洗,置于Nissl分化几秒钟,光学显微镜下观察额叶皮质神经元形态,二甲苯透明,并用中性树胶密封,1周内采图。
1.5.3 免疫组化:取大鼠额叶皮质所在区段制备的石蜡切片,常规脱蜡,放入3%双氧水室温10min,pbs冲洗5min×2次,枸橼酸中修复,冷却,通透液37℃温箱恒温45min,pbs冲洗5min×2次,山羊血清封闭液滴加,37℃温箱恒温1.5h。滴加稀释过的一抗SIRT1(1∶1 000)、FOXO3a(1∶1 000),4℃冰箱过夜,再放入37℃温箱恒温1h,pbs冲洗5min×3次,滴加二抗生物素化兔抗山羊IgG(1∶100)、羊抗兔IgG(1∶100),37℃温箱恒温2h,pbs冲洗5min×3次,滴加SABC 37℃温箱恒温1h,pbs冲洗5min×3次,滴加二氨基联苯胺(DAB)显色,显微镜下观察额叶皮质神经元,清水冲洗载玻片,烘干,二甲苯脱水、透明,中性树胶封片,1周内采图。
2 结果
2.1 Morris水迷宫结果 见图1。模型组大鼠4d平均逃避潜伏期高于对照组(P<0.05),平台象限滞留时间百分比低于对照组(P<0.05);电针组大鼠的4d平均逃避潜伏期低于模型组(P<0.05),平台象限滞留时间百分比高于模型组(P<0.05);电针组大鼠的4d平均逃避潜伏期高于对照组(P<0.05),平台象限滞留时间百分比低于对照组(P<0.05)。
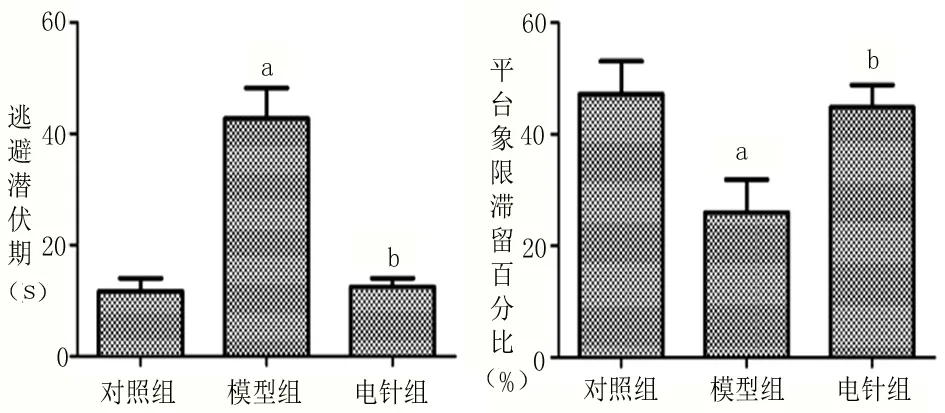
图1 Morris水迷宫
2.2 尼氏染色结果 见图2。对照组额叶皮质神经元结构完整,胞核居中,核仁清楚,神经细胞紧密(图2对照组);模型组大脑皮质发生萎缩,体积明显小于对侧,额叶出现结构、形态的变化,神经元层次明显紊乱,染色加深,细胞核固缩(图2模型组);电针组较模型组神经元形态明显改善,情况好转(图2电针组)。
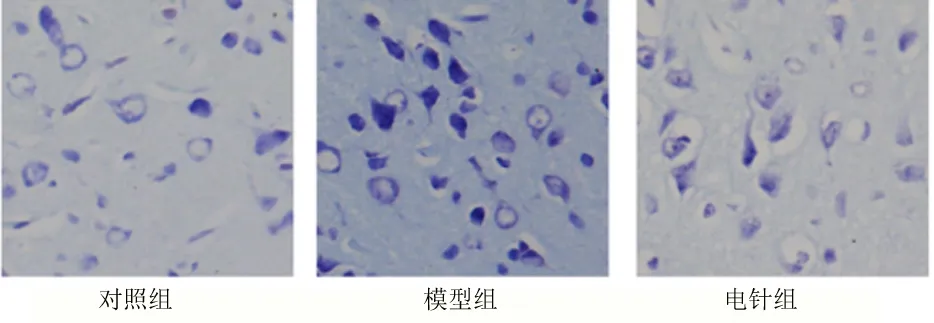
图2 尼氏染色×400
2.3 免疫组化结果 见图3。SIRT1阳性神经元呈棕黄色,免疫阳性产物着色部位主要是胞膜和胞浆。与对照组相比,模型组的SIRT1阳性神经元数量明显减少,免疫阳性细胞平均灰度值增加(P<0.05);与模型组相比,电针组的SIRT1阳性神经元数量增加,免疫阳性细胞平均灰度值降低(P<0.05)。FOXO3a阳性神经元呈棕黄色,免疫阳性产物着色部位主要是胞膜和胞浆,细胞多呈圆形或梨形。与对照组相比,模型组的FOXO3a阳性神经元数量明显增多,多位于胞浆,染色加深,平均灰度值降低(P<0.05);与模型组相比,电针组的FOXO3a阳性神经元数量减少,着色浅,多位于胞核,平均灰度值增高(P<0.05)。
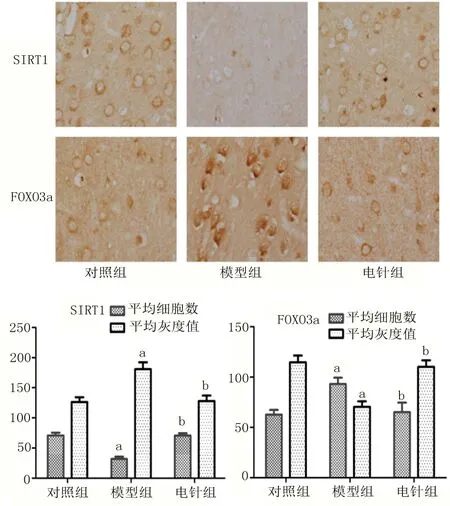
图3 SIRT1和FOXO3a表达情况
3 讨论
AD是一种中枢神经系统退行性疾病,其主要表现是学习记忆功能障碍,导致患者的生活质量明显下降,目前尚无有效治疗的方法。在AD的发病机制中,由于Aβ神经元毒性、氧化应激、突触功能异常、神经递质失调、神经胶质细胞炎症反应与神经元损害等一系列交叉级联反应,最终导致脑组织萎缩、神经系统结构和功能破坏[6]。其主要病理学改变包括脑组织大量神经元丢失、突触改变、细胞外老年斑和细胞内神经纤维缠结的形成[7],即细胞形态发生改变。尼氏染色观察到模型组大脑皮质发生萎缩,体积明显小于对侧,额叶出现结构、形态的变化,神经元层次明显紊乱,染色加深,细胞核固缩;Morris水迷宫试验系统检测到模型组大鼠平均逃避潜伏期明显高于对照组(P<0.05),平台象限滞留时间百分比低于对照组(P<0.05),提示AD大鼠学习记忆能力损害严重,造模成功。
沉默信息调节因子1 (Silent information regulator 1,SIRT1)是sirtuins去乙酰化酶家族成员,因为SIRT1对不同类型的底物进行脱乙酰化反应,故表现出广泛的功能,如能量代谢、脂肪代谢、基因转录、细胞衰老、胰岛素分泌和糖原代谢等[8]。叉头基因转录因子家族(Forkhead transcription factor,FOXO),又称Forkheadlike protein(FKHR),该家族包括4种蛋白:FOXO1/FKHR/FOXO1a、FOXO3/FKHRL1/FOXO3a、FOXO4/AFX和FOXO6,它们的结构、功能及作用比较相似,都是调节细胞周期、细胞凋亡、氧化应激、DNA损伤修复、能量代谢和长寿、癌症的发生发展及其他的细胞功能有关的一类蛋白质家族体系。其中,FOXO3a是其蛋白家族重要的成员之一[9]。多项研究显示[10-13]:SIRT1可通过去乙酰化FOXO3a来调节机体内细胞抗氧化的基因和酶的表达,从而减少氧化应激产物对细胞的损伤,由此延缓细胞的衰老与凋亡,保护细胞的正常功能[14]。本实验中,模型组的SIRT1阳性表达最弱,FOXO3a阳性表达最强,而在对照组中SIRT1阳性表达最强,FOXO3a阳性表达最弱。这与SIRT1可以通过去乙酰化FOXO3a来减少氧化应激产物对细胞的损伤的观点相一致。
据研究显示电针具有改善循环、抑制细胞凋亡、保护受损神经和脑组织、提高机体抵抗自由基能力等作用[15],使用电针治疗AD的机理之一是干预Aβ的生成途径,即调控β分泌酶的表达,抑制淀粉样前体蛋白APP的异常水解[16],减少Aβ的沉积,进而有效控制AD的发生。陈阳阳等[17]和董卫国等[18]电针AD大鼠“大椎”穴和“百会”穴,与模型组对比发现电针组小鼠大脑皮层及海马的 APP与Aβ明显减少,说明电针“大椎穴”和“百会穴”有助于抑制AD的发生。张晓东和佟欣等[19-20]实验表明,通过对AD大鼠电针刺激“大椎”穴和“百会”穴,可在一定程度上改善AD大鼠的学习记忆功能。本实验中,电针组大鼠的平均逃避潜伏期低于模型组(P<0.05),平台象限滞留时间百分比高于模型组 (P<0.05),说明通过电针治疗后AD大鼠学习记忆能力得到改善;电针组的SIRT1阳性表达比模型组强,FOXO3a阳性表达比模型组弱,故电针改善了蛋白表达量,促进SIRT1的表达,抑制FOXO3a的表达,而SIRT1可以通过去乙酰化FOXO3a,减少氧化应激产物对细胞的损伤,改善AD大鼠的学习记忆能力。因此电针对AD大鼠学习记忆能力有一定的改善效果,但具体的机制尚不明确,有待进一步的研究和发现。

