感染深度与糖尿病足患者下肢血管病变及血清炎症因子、免疫球蛋白水平的相关性
蔡新萌,李晓辉,李翠华,姜 辛
(聊城市人民医院,聊城 252000)
糖尿病足(DF)是2型糖尿病(T2DM)的重要慢性并发症,其病理基础是足部的血管、神经病变、大血管和微血管灌注不足和微循环障碍,临床表现为足部麻木、疼痛、皮肤溃疡或肢端坏疽,也是糖尿病患者主要致残原因之一[1]。目前,全球糖尿病患者人数已超过4.1亿例,约占全世界成年人口的8.3%,到2040年,这一数字会上升至6.42亿[2]。在糖尿病患者中,合并DF的比例约为25%,DF患者的截肢率约占糖尿病患者总截肢率的85%,仅美国每年由DF导致的低位截肢病例数就超过了8.5万人,针对DF的护理费用占全部糖尿病患者护理费用的25%~50%,而DF患者的5年死亡率超过40%[3-4]。我国目前的糖尿病患者近1亿例,是全世界患者人数最多的国家,我国糖尿病患者中约有15%的患者会发生DF,此类患者的下肢截肢风险是正常人的40倍[5]。针对DF的传统治疗方法主要包括控制血糖、清创、消炎、活血等,能够在一定程度上改善多数DF患者的溃疡症状,但仍在约15%~20%患者利用现有治疗手段不能有效减少溃疡面,病情呈现持续进展,特别是大约有80%的DF患者会出现继发感染,而继发于DF的溃疡、感染和深层组织破坏是导致DF患者截肢、致残的主要原因。因此,优化DF的治疗方案、控制DF进展和发生感染等并发症的危险因素,对于降低患者的截肢率及死亡率具有关键性的作用[6]。下肢血管病变是糖尿病常见的并发症,糖尿病患者动脉硬化的发生率为非糖尿病患者的11倍,即使在糖尿病早期也可以观察到下肢血管的病变,糖尿病的下肢血管病变主要累及远端动脉,也是DF发生和进展的病理基础。对于糖尿病下肢血管病变进行早期诊断和干预,能够提高患者的生活质量和改善患者的预后,但国内外目前缺乏针对DF患者下肢血管病变与其感染深度及全身炎症、免疫状态的相关性研究,基于这一研究现状,本研究针对感染深度与DF下肢血管病变及血清炎症因子、免疫球蛋白水平的相关性进行了研究,现报道如下。
1 资料与方法
1.1 临床资料收集医院2016年10月~2017年11月医院收治的、符合本研究纳入标准的106例DF合并感染患者作为研究对象,所有纳入患者均对本研究知情并签署知情同意书,本研究方案经我院医学伦理委员会审核通过。
1.1.1 纳入标准所有纳入患者均符合中华医学会糖尿病学分会制订的《中国2型糖尿病防治指南》中的T2DM诊断标准[7],同时符合美国感染协会(IDSA)于2012年制订的DF合并感染诊断标准[8],临床资料完整。
1.1.2 排除标准合并恶性肿瘤、心脑卒中、自身免疫病、免疫缺陷症、血液疾病、肝肾功能不全及长期应用免疫调节剂、糖皮质激素的患者。合并其它部位感染及入组前一个月内有手术史、重大重伤史的患者。
1.2 观察指标对所有患者的感染深度、下肢血管病变程度进行观察和比较,其中,感染深度的判定参照美国血管外科学会2016年制订的糖尿病足管理指南中的相关标准[9],以仅累及皮肤及皮下组织的感染为浅部感染,以累及肌腱、骨骼或关节的感染为深部感染;下肢血管病变程度的判定参照美国血管外科学会2014年制订的严重下肢血管病变WIfI分类标准[10],以下肢动脉检查未见显著异常改变为A级,以出现下肢动脉内膜厚度≥1.0mm、动脉狭窄、粥样斑块、内膜厚度回声增强中任意1种为B级,以存在上述改变中任意2种为C级,以存在上述改变中任意3种或更多为D级。所有患者均于入院次日采集清晨空腹外周静脉血样本,在常温下以3000r/min的速度离心15min后分离血清,采用全自动特种蛋白分析仪(美国贝克曼库尔特公司)采用免疫比浊法对血清C反应蛋白(CRP)水平进行检测,采用酶联免疫吸附法(ELISA法)对血清肿瘤坏死因子-α(TNF-α)、白细胞介素 -6(IL-6)、免疫球蛋白(Ig)-A、Ig-M、Ig-G水平进行检测和比较,ELISA试剂盒均购自美国贝克曼库尔特公司,严格按照试剂盒说明书进行操作。
1.3 统计方法采用SPSS 22.0统计学软件进行数据分析,正态计量数据用“mean±SD”表示,计数资料采用例数或百分比表示,两组独立,正态,方差齐资料组间比较采用t检验;等级资料组间比较采用秩和检验;样本率的比较采用卡方检验或Fisher确切概率法;等级资料的相关性分析采用Spearman等级相关分析。均以P<0.05为差异有统计学意义。
2 结果
2.1 不同感染深度糖尿病足患者的临床资料比较在纳入患者中,有49例患者为深部感染占46.23%,57例患者为浅部感染占53.77%,深部感染患者与浅部感染在年龄、性别构成、糖尿病病程、体质指数、血脂指标、合并高血压等方面的差异均无统计学意义(P>0.05),而在糖尿病足溃疡分级和糖化血红蛋白水平方面的差异有统计学意义(P<0.05),见表1。
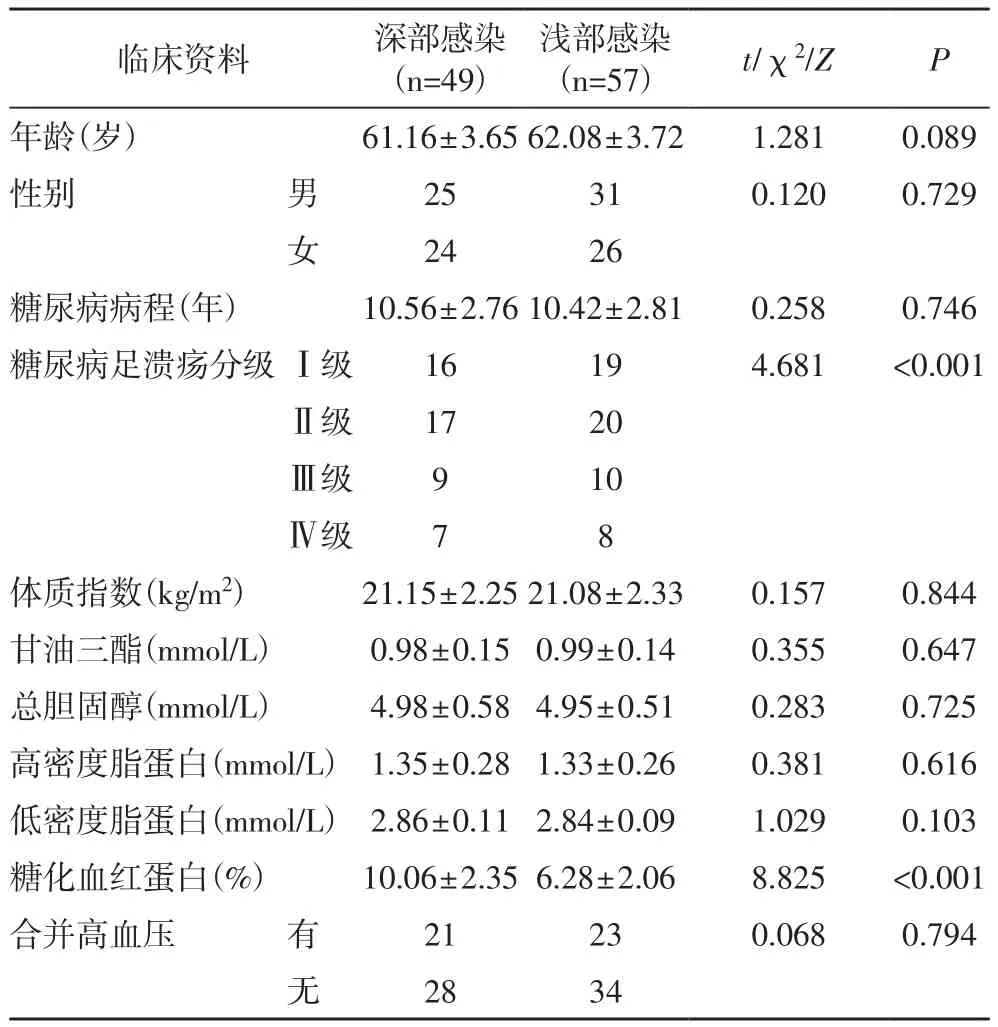
表1 不同感染深度糖尿病足患者的临床资料比较
2.2 不同感染深度糖尿病足患者的下肢血管病变程度比较深部感染患者的下肢血管病变分级显著高于浅部感染患者,两者下肢血病变分级分布的差异有统计学意义(P<0.05),见表2。

表2 不同感染深度糖尿病足患者的下肢血管病变程度比较
2.3 不同感染深度糖尿病足患者的血清炎症因子水平比较深部感染患者的血清炎症因子水平均显著高于浅部感染患者,差异有统计学意义(P<0.05),见表3。
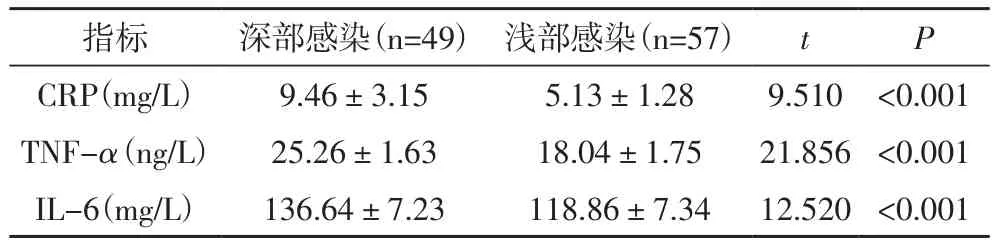
表3 不同感染深度糖尿病足患者的血清炎症因子水平比较
2.4 不同感染深度糖尿病足患者的血清免疫球蛋白水平比较深部感染患者的血清免疫球蛋白水平均显著低于浅部感染患者,差异有统计学意义(P<0.05),见表4。
2.5 糖尿病足患者下肢血管病变程度与血清炎症因子、免疫球蛋白水平的相关性以患者的下肢血管病变程度为因变量,以患者的血清炎症因子、免疫球蛋白水平为自变量,进行Spearman等级相关分析,结果显示,糖尿病足患者的下肢血管病变程度与血清炎症因子水平呈正相关关系(P<0.05),与血清免疫球蛋白水平呈负相关关系(P<0.05),见表5。

表4 不同感染深度糖尿病足患者的血清免疫球蛋白水平比较(g/L)
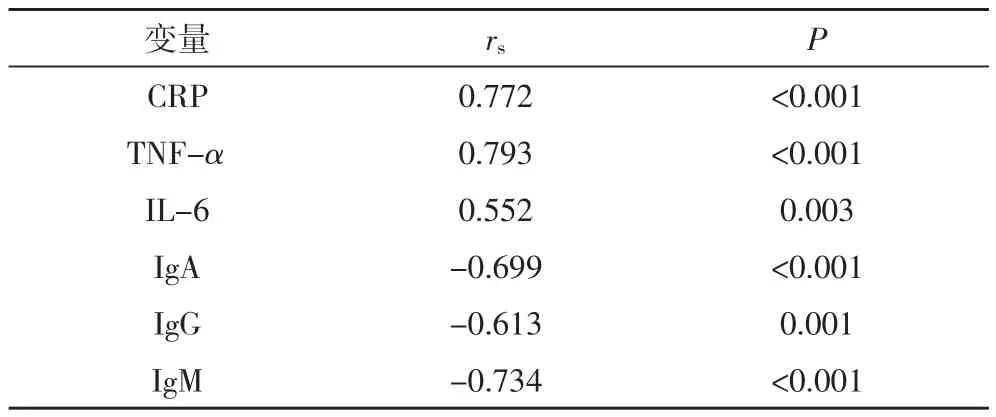
表5 糖尿病足患者下肢血管病变与血清炎症因子、免疫球蛋白水平的相关性
3 讨论
DF的概念于1956年首次被提出,随着糖尿病发病率的增加,DF患者群体也不断扩大,特别是年龄较大的糖尿病患者的DF发生率和足坏疽发生率均较高,其导致的截肢病例数占到了非外伤性下肢截肢患者的50%,全世界每年估计有超过100万的糖尿病患者需要截肢,大约每30秒就有一个大的截肢事件,而且,在一侧肢体截肢后,有50%的患者会在5年内不得不进行另一侧肢体的截肢[11]。DF严重威胁着患者的身心健康和生活质量,针对DF进行积极的预防和治疗,能够显著减少DF的截肢比例,甚至有50%的截肢是可以避免的[12]。近年来,高压氧、血管介入治疗、干细胞移植、中医药治疗等新型治疗方案陆续被引入DF的治疗,很多患者通过接受综合性的治疗方法达到了使足部动脉血液供应改善、有效控制感染和坏疽的目的,从而在一定程度上降低了截肢率。DF的病情进展受到多种因素的影响,免疫紊乱、病原体感染等危险因素共同存在,而胰岛β细胞功能受损、胰岛素抵抗等也可引起代谢综合症。感染是DF的主要并发症之一,也是导致DF患者出现不良预后的重要因素。相关研究显示,DF合并感染主要由革兰阴性菌引起,而且病原菌中耐甲氧西林金黄色葡萄球菌、产超广谱β-内酰胺酶肠杆菌的检出率较高,耐药性较强,溃疡症状越重,混合感染的比例更大,故临床治疗难度较大[13]。而相对于未发生感染或轻度感染患者,合并中重度感染的DF患者会出现白蛋白、空腹血糖、中性粒细胞、尿素氮、24h尿蛋白、CRP水平的显著异常,创面愈合率较低,发病12个月内的截趾/肢率较高[14]。因此,对于DF患者的感染风险进行准确评价并给予积极的预防和干预是改善患者预后的关键环节。
本研究结果显示,合并深部感染DF患者的下肢血管病变及全身性炎症反应更加严重,免疫功能抑制状态更加显著,而且患者的下肢血管病变与其炎症反应和免疫功能异常具有一定的相关性,这提示了下肢血管病变可能在促进DF感染的扩散和患者机体的炎症免疫异常发挥着一定的作用,预防和控制下肢血管病变对于控制DF患者的感染症状、改善机体状态可能具有积极的意义。DF的病因复杂造成了治疗困难、预后不佳,下肢血管病变、糖尿病周围神经病变、长期高血糖、感染、全身营养状况等多种因素均与DF的严重程度有关[15]。在DF的发生和发展过程中,下肢动脉闭塞性病变既是足病的病理基础,也是患者截肢甚至死亡的重要危险因素。根据相关报道,50岁以上的糖尿病患者的下肢血管病变发生率为25%~30%,其主要病因是下肢动脉粥样硬化,高同型半胱氨酸血症、胱抑素C、胎球蛋白-A、纤维蛋白原、D-二聚体、脑钠肽、C 反应蛋白、尿蛋白等多种因素可对其病变风险产生影响,及早发现并治疗有助于延缓病变的进展。目前,临床上主要依据间歇性跛行、静息痛等临床表现、足部动脉搏动检查、踝-肱血压指数、经皮氧分压检查、彩色多普勒超声检查、血管成像、血管造影等手段对糖尿病患者的下肢血管病变进行诊断和评价,内科治疗以戒烟、降压、调脂、川芎嗪、灯盏花素、前列腺素等治疗为主,而外科治疗主要采用腔内血管成型术、血管重建术、内膜剥脱术、腰交感神经切除术和静脉动脉化等,但仍有一些内科治疗效果不佳且无法进行手术治疗患者的预后较差。近年来的相关研究已证实,随着下肢血管病变程度的提高,DF患者的年龄、糖尿病病程、外周血中性粒细胞比例均呈现逐级上升,踝肱指数、趾肱指数均呈现逐级下降,混合感染患者比例逐级提升,这提示了下肢血管病变的加重可能会导致DF患者感染程度的加重[16-17]。本研究结果还提示了存在深部感染和较严重下肢血管病变的DF患者可表现为更加显著的机体炎症反应程度和体液免疫功能低下,相关研究结果显示,DF患者的血清IL-6、CRP等炎症标志物水平与患者感染的严重程度及疾病转归具有密切的相关性,并且能够作为评价DF患者预后的重要依据[18-19]。血清免疫球蛋白水平的异常也是DF患者机体的典型改变之一,而促进DF患者足部创面组织免疫因子IgA、IgM、IgG的广泛性弥漫分布,能够通过ERK1/2、p38、MAPKK6、c-myc、Akt、ATF2等组织信号通路促进DF创面的愈合[20],故机体的体液免疫指标与DF病情的转归密切相关。因此,临床医生应高度重视DF患者的下肢血管病变对机体炎症和免疫状态的影响作用,采取有效的干预措施,以改善患者的预后。
存在深部感染的DF患者的下肢血管病变程度更高,机体炎症反应和体液免疫功能异常更加严重,下肢血管病变可能促进了DF患者感染的扩散和机体内环境的紊乱,临床医生应给予及时的诊断和有效的干预。

