L-NAME对实验性隐睾生精细胞凋亡与p38MAPK表达的影响
谢 丽,赖 琼,孙国瑛,石金凤,谢远杰,贺丽萍
(1.长沙市卫生职业学院,长沙 410100;2.湖南师范大学附属湘东医院,醴陵 412200;3.湖南师范大学医学院,长沙 410006;4.南华大学衡阳医学院,衡阳 421001)
近年来,睾丸局部温度和精子发生的关系已受到越来越多国内外学者的关注。隐睾症及睾丸局部热处理会导致生精上皮的形态改变及大量生精细胞凋亡,从而出现少精与无精现象[1,2],但热应激造成男性生精障碍的分子机制尚未充分阐明。p38MAPK是MAPK家族中的重要成员,细胞外应激因子如紫外线、细胞外高渗、热休克、强氧化剂等能导致p38MAPK磷酸化活化,并通过一系列下游信号调控细胞凋亡,在生精细胞凋亡过程中p38MAPK通路被激活[3]。NO是一种具有生物活性的自由基,它的前体是L-精氨酸,在一氧化氮合酶(NOS)作用下产生NO。研究表明NO是热激导致生精细胞调亡的重要信号分子[4]。本实验通过建立单侧隐睾模型,观察NOS抑制剂对隐睾生精细胞凋亡以及p38MAPK表达的影响,阐述在热激导致生精细胞凋亡过程中NO与p38MAPK的关系,为研究热压导致生精细胞凋亡的分子机制提供科学的实验依据。
1 材料与方法
1.1 隐睾模型的建立与处理48只健康雄性SD大鼠(42 day-old)喂养7天后随机分为假手术组、隐睾组、隐睾+NOS抑制剂(L-NAME)组、隐睾+生理盐水组。隐睾模型的建立:戊巴比妥钠(30mg/Kg)腹腔内注射麻醉,下腹正中切口,切断右侧睾丸引带,用5-0尼龙线将右侧睾丸固定于腹后壁关腹,假手术组右侧睾丸切断引带后还纳入阴囊关腹。隐睾+L-NAME组与隐睾+生理盐水组术后分别于腹腔内注射L-NAME或生理盐水,每天一次,定时定量(50mg/Kg)。术后第7天处死动物,留取各组大鼠双侧睾丸称湿重后立即将各组大鼠右侧睾丸沿长轴方向切开,一半用来进行Western blot、NO含量和NOS活性检测以及流式细胞术检测,另一半均投入4%多聚甲醛固定以进行组织学及原位凋亡检测。
1.2 主要试剂SD大鼠由湖南农业大学实验动物部提供,L-NAME与蛋白定量试剂盒购自北京华美公司,兔抗鼠磷酸化p38MAPK IgG 购自基因公司,羊抗兔IgGHRP购自北京中山公司,S-P 免疫组化试剂盒 购自福州迈新公司,细胞凋亡检测试剂盒购自武汉博士德公司,NO与 NOS检测试剂盒购自南京建成生物工程公司。
1.3 主要方法
1.3.1 睾丸组织的NO含量检测用硝酸还原酶法检测睾丸组织NO含量。操作按说明书进行如下:将各睾丸组织用4℃预冷的生理盐水洗净血液,滤纸吸干水分后称重,取睾丸组织0.2~0.3 g加9倍生理盐水制备成10%组织匀浆,1000r/min分离心5分钟后取上清0.5mL,加入试剂1、试剂2各0.2 mL混匀,37℃水浴2小时。再加入蛋白分离剂,混匀,静置10分钟,用721分光光度计以0.5cm光径在550nm波长处测吸光度,再根据吸光度通过计算得出NO含量。
1.3.2 睾丸组织NOS活性的测定采用化学比色法测定睾丸组织中NOS活性,其原理为NOS催化L-Arg和分子氧反应生成NO,NO与亲核性物质生成有色化合物,通过测定吸光度可计算出NOS活力。操作按试剂说明书进行:将各睾丸组织用4℃预冷的生理盐水洗净血液,滤纸吸干水分后称重,取大鼠睾丸组织0.2~0.3 g加9倍生理盐水制备成10%组织匀浆,3000 r/min离心10分钟后取上清50µL,再依次加入底物缓冲液200µL,促进剂10µL及显色剂100µL,混匀后37℃水浴反应15分钟,加入透明剂100µL及终止液2000µL后用721分光光度计以1.0cm光径在530nm波长处测吸光度,再根据吸光度通过计算得出NOS活性。
1.3.3 免疫组化SP法检测p38MAPK蛋白常规石蜡切片,免疫组织化学SP法严格按试剂盒说明书操作,阴性对照以PBS代替一抗,组织中出现棕色颗粒为阳性反应。应用GSM图象处理系统计算阳性细胞的平均灰度值。
1.3.4 Western blot检测p38MAPK蛋白表达量称取睾丸组织置小烧杯中,用PBS液洗涤2次,加入适量的组织裂解液(100 mM NaCl,10 mM Tris·Cl,1mM EDTA,1ug/mL Aprotinin,100ug/mL PMSF),置于冰上5min,用眼科剪剪碎,倒入5mL匀浆器中,反复抽取匀浆组织,再将其吸入EP管中,离心(4℃ 1000g 10min),吸出上清液,即为组织总蛋白,用BCA法进行蛋白定量。调节每份样品浓度,以等量的蛋白量加样,样品加入等体积2×SDS加样缓冲液,沸水煮沸10min,经SDS-PAGE胶电泳后转膜4h;膜用5%牛奶封闭液(2.5g牛奶+50mL TBST)封闭2h;加一抗(用1%牛奶封闭液稀释),37℃孵育2h;TBST洗15 min×3次;加相应的二抗(也用1%封闭液稀释),37℃孵育1 h,TBST洗15 min×4次;用ECL发光法检测不同蛋白表达状况;薄层扫描仪测定印迹区带的光密度值。
1.3.5 流式细胞术测定生精细胞DNA含量和细胞凋亡每组取6份0.25×0.25cm大小睾丸组织放入置于培养皿上的240目不锈钢筛网内,用眼科组织剪将睾丸组织剪碎,用注射器的针芯轻搓组织块,边搓边滴加生理盐水,直到组织搓完,收集细胞悬液,离心(1000r/min×8min),然后用磷酸盐缓冲液(phosphate buffered saline solution,PBS)洗涤2次,冰冷的70%乙醇固定,4℃保存。样本上机前作如下处理:①将乙醇固定的细胞离心洗涤,去上清,摇匀;②加RNA酶50µl(浓度为0.5 g·L-1),37℃水浴 30min。③加碘化丙啶(PI)50µl,浓度为1 g/L,振荡混匀,避光置冰箱30min;④300目尼龙网滤过,上机检测。
1.3.6 TUNEL法检测生精细胞凋亡睾丸组织经4%的多聚甲醛固定,常规石蜡切片,脱蜡水化,原位凋亡测定按试剂盒说明书操作。胞核着紫蓝色者为阳性细胞,即凋亡细胞。阴性空白对照未加TUNEL反应液。每个睾丸组织切片观察10个生精小管横断面,平均每个生精小管横断面的调亡细胞数即为凋亡指数(AI)。
1.4 统计分析计量资料均采用均数±标准差表示,应用SPSS 10.0统计软件对组间均数进行单因素方差分析,P<0.05认为差异有显著性意义。
2 结果
2.1 两侧睾丸大体改变及重量变化术后第7天,与左侧相比,隐睾组、隐睾+生理盐水组和隐睾+L-NAME组右侧睾丸的重量均减轻(P<0.001),但隐睾+L-NAME组右侧睾丸较左侧睾丸缩小的程度明显轻于隐睾组和隐睾+生理盐水组(P<0.05)。假手术组睾丸重量双侧差异无显著性(见表1)。
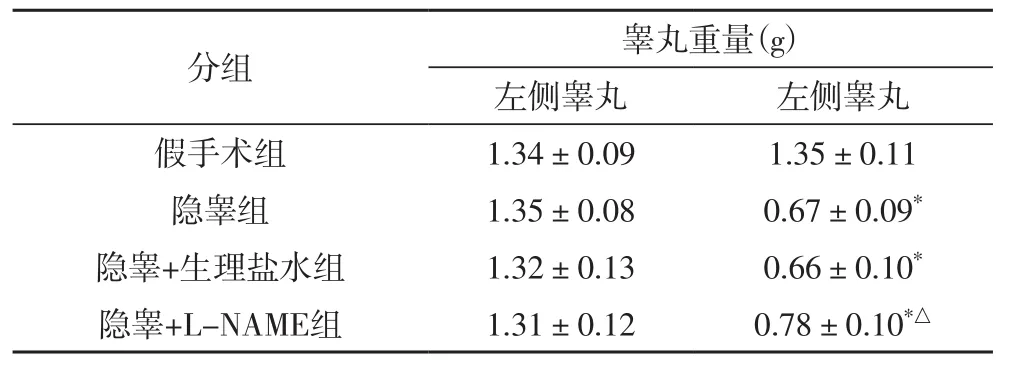
表1 术后第7天双侧睾丸重量的变化(n=12)
2.2 各组大鼠右侧睾丸内NO和NOS活性的变化如表2所示,术后第7天,隐睾组和隐睾+生理盐水组大鼠右侧睾丸NO浓度和NOS活性均明显高于假手术组和隐睾+L-NAME组(P<0.05),差别均有显著性意义;隐睾+L-NAME组睾丸组织内NO浓度和NOS活性较假手术组高,差别没有显著性意义。

表2 睾丸 NOx- 和NOS 活性的变化(n=12)
2.3 磷酸化p38MAPK表达
2.3.1 免疫组化检测如图1所示,免疫组化显示各组大鼠右侧睾丸间质细胞及血管内皮和平滑肌细胞内均有表达,但假手术组睾丸生精上皮未见p-p38MAPK表达,而其他三组的睾丸生精上皮及生精小管管腔内均可见到p-p38MAPK免疫阳性细胞,且多见于胞浆和(或)胞核,但隐睾+L-NAME组的p-p38MAPK表达弱于隐睾组和隐睾+生理盐水组。
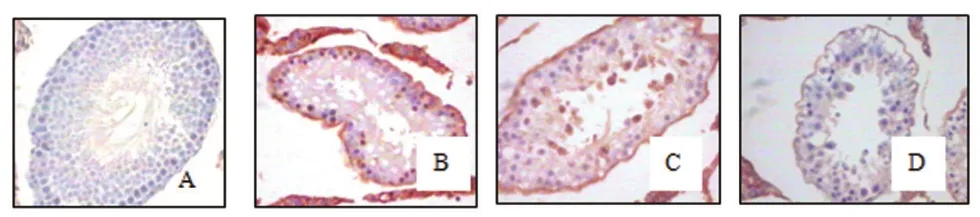
图1 免疫组化检测磷酸化p38MAPK表达(DAB染色,苏木素复染,×400)
2.3.2 Western blot检测如图2所示,隐睾组和隐睾+生理盐水组磷酸化p38MAPK蛋白表达量增高,为假手术组的约2.5倍(P<0.01),为隐睾+L-NAME组的约1.3倍(P<0.05)。而隐睾+SB203580组的则为假手术组的约1.8倍(P<0.05)。总p38MAPK作为内对照,各组表达均无差别(P>0.05)。
2.4 生精细胞凋亡检测
2.4.1 流式细胞术如图3所示,四组大鼠生精细胞在G1期前端均出现了一个称之为凋亡峰的亚倍体峰。与假手术组和隐睾+L-NAME组比较,隐睾组和隐睾+生理盐水组大鼠生精细胞凋亡率明显增高(见表3)。

图2 Western blot检测磷酸化p38MAPK蛋白变化

表3 右侧睾丸生精细胞凋亡率(n=12)

图3 生精细胞凋亡的流式细胞术检测
2.4.2 TUNEL原位末端标记法如图4所示,四组睾丸内均可见到胞核为紫蓝色的凋亡的生精细胞,包括初级精母细胞和精原细胞,未见到支持细胞发生凋亡,隐睾组和隐睾+生理盐水组睾丸生精小管内出现大量凋亡细胞,隐睾+L-NAME次之,假手术组最少(见表4)。

表4 右侧睾丸内生精细胞凋亡指数(n=12)
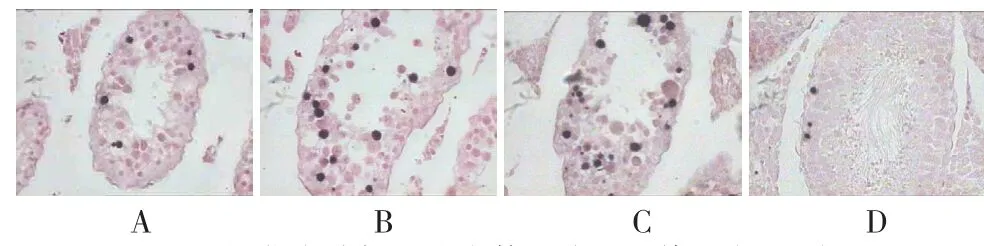
图4 原位末端标记法生精细胞凋亡情况(×400)
3 讨论
睾丸生精小管内精子的发生是一个高度协调与相当复杂的过程,正常情况下精子的产生与生精细胞的凋亡同时存在,这对排除异常精子,维持精子数量与质量稳态起着重要作用,而异常增多的生精细胞凋亡可造成弱精与少精从而导致男性不育[5]。现发现多种理化因素可导致生精细胞凋亡增加,其中阴囊温度的局部升高是导致生精细胞过度凋亡的重要原因之一[6]。本研究通过建立隐睾模型,发现隐睾内生精上皮变薄,生精细胞凋亡大量增加,进一步说明热应激可导致生精细胞凋亡[7]。
热应激造成生精细胞凋亡的机制目前尚未完全阐明,有研究表明热压可导致睾丸组织内的活性氧增加,过量的活性氧可以破坏精子中的细胞器引起线粒体内的凋亡级联反应导致精子失去活力[8]。NO是一种重要的生物活性分子,其供体硝普钠能促进生精细胞凋亡[9]。本研究发现大鼠隐睾NOS活性与NO含量明显增高,生精细胞凋亡指数与凋亡率升高,抑制剂L-NAME可抑制NO的产生从而减轻生精细胞凋亡。提示NO介入了热应激所致的生精细胞凋亡过程。
一氧化氮可通过多种信号通路调控细胞凋亡[10],其导致生精细胞凋亡涉及到P53、Bcl-2/Bax等多个凋亡相关基因[11,12]。本研究前期工作证实实验性隐睾可激活MAPK通路。在本实验中,给予适量L-NAME后,隐睾生精上皮的磷酸化p38MAPK蛋白表达下调,同时生精细胞凋亡指数下降,表明L-NAME可以通过抑制磷酸化p38MAPK的表达来抑制生精细胞凋亡。研究发现,NO诱导的其他类型细胞凋亡过程中也出现了p38MAPK的激活。Jun等[13]研究发现,将HL-60细胞暴露于硝普钠能明显激活p38激酶,且能被SB203580所阻断,认为p38MAPK在NO诱导的神经细胞凋亡中起调控作用。在NO通过刺激bax流入线粒体而导致神经元细胞死亡的过程中,p38MAPK的活化起到关键作用[14]。
本研究结合文献资料表明,在隐睾导致的生精细胞凋亡过程中,NOS的表达增加导致NO局部含量升高,NO激活p38MAPK途径,磷酸化的p38MAPK激活一系列下游信号,最终导致生精细胞细胞凋亡。Ishikawa等研究发现,在隐睾症患者中NOS表达上调,抑制P38丝裂原活化蛋白激酶可使NOS表达下调[15],提示在隐睾所致生精细胞凋亡过程中,NOS/NO通路与p38MAPK途径有相互调控的作用。有关NO活化p38MAPK的何种上游分子,以及活化后的p38MAPK调控哪些下游因子最终导致生精细胞凋亡,尚有待进一步研究。

