儿童伴IRF4 基因重排大B 细胞淋巴瘤临床病理分析
吴崇军 黄 慧 熊 婷 徐忠金
江西省儿童医院 南昌大学附属儿童医院(江西南昌 330000)
干扰素调节因子4(interferon regulatory factor 4,IRF 4)是IRF 家族的转录因子成员之一,较特异地表达于淋巴细胞[1]。因IRF 4 最先在多发性骨髓瘤中被识别,故也被称为多发性骨髓瘤癌基因1(multiple myeloma gene 1,MUM1)。IRF家族有10个成员,IRF4的DNA 结合结构域与IRF1有44%同源,IRF相关结构域(IRF related domain,IAD)与IRF3有26%同源[2],IRF 4 与IRF 8 高度同源。IRF 4 是在B 细胞成熟后期表达的B 细胞转录因子[3-4],在淋巴细胞中表达有种系和阶段特异性[5],在正常淋巴组织中表达于浆细胞、5%~10%的生发中心B 细胞(germinal center B cell,GCB)以及活化的T 细胞,是B 细胞向浆细胞分化的重要调控因子。最近在弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)中发现一种预后较好的亚型,该亚型好发于小年龄组,一般以扁桃体和/或颈部淋巴结肿大为主要表现,通常多在早期,对化疗反应良好。从组织形态学上看,该亚型显示出结节/滤泡结构,肿瘤细胞弥漫强表达IRF 4。在2016 世界卫生组织(World Health Organization,WHO)淋巴瘤分类的更新版中将该类肿瘤命名为伴IRF 4重排的大B细胞淋巴瘤[6]。目前该类型病例报道较少。本研究回顾分析3例伴IRF4基因重排大B细胞淋巴瘤患儿的临床及病理资料。
1 临床资料
2018年1月—2020年1月江西省儿童医院收治的3例伴IRF4基因重排的大B细胞淋巴瘤患儿。患儿均为男性,发病年龄5岁4月龄至7岁10月龄。例1以发现扁桃体肿大引起睡眠呼吸障碍起病,例2因腹痛、呕吐考虑肠套叠行手术诊断,例3以无痛性淋巴结增大行活检发现。
患儿病理均经2家以上三甲医院复核。3例患儿的肿瘤细胞中等或偏大,染色质分散,可见嗜碱性小核仁。例1肿瘤细胞形态学提示为弥漫大B细胞淋巴瘤,例2瘤细胞呈结节状,例3瘤细胞呈弥漫分布(图1)。例1、例2的IRF4基因重排阴性,例3 FISH检测IRF4基因断裂阳性。结合患儿年龄、部位、组织形态学(瘤细胞弥漫分布)、免疫表型(CD20、MUM1、CD10、BCL-6和BCL-2阳性)和其他基因检测结果(C-MYC和BCL-2)诊断为伴IRF4基因重排的大B细胞淋巴瘤(表1)。
3 例患儿均纳入CCCG-NHL-2016 方案进行治疗,疗效判定参照非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)疗效标准。化疗休疗期、放疗期间每周1、2 次门诊随诊,全部治疗结束后门诊随访,第1年每2个月1次,第2年每3个月1次,2年后每4~6个月1次。疗效和疾病状态评价指标疗效评估一般至少包括3个时间点:治疗2~3个疗程后、化疗结束时放疗开始前以及所有治疗结束时。疾病状态通常用完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定和进展和/或复发来描述。例1和例3纳入CCCG-NHL-2016方案R2组执行化疗,例2按R3组执行。例1、例2已经结束化疗1年余,随访至今无复发;例3仍在治疗中,目前已获得CR。
3 例患儿均出现不同程度的骨髓抑制,但均在化疗间歇期自行恢复,无明显重症感染,有不同程度的呕吐、脱发及肝损害情况,在化疗停止后恢复。
2 讨论
IRF 4基因在成熟B 淋巴细胞和T 淋巴细胞中的重排比在B细胞和浆细胞肿瘤中更为常见[3-4,7-10]。涉及IRF4和IGH基因的t(6;14)首先在多发性骨髓瘤中描述[7],DLBCL 最初于2001 年描述[8],随后IRF 4基因重排也在少数低级别B 细胞淋巴瘤患者中被发现[9]。在T 细胞非霍奇金淋巴瘤中,特别是在原发皮肤间变性淋巴瘤激酶阴性间变性大细胞淋巴瘤中,也发现涉及IRF4基因重排[10]。
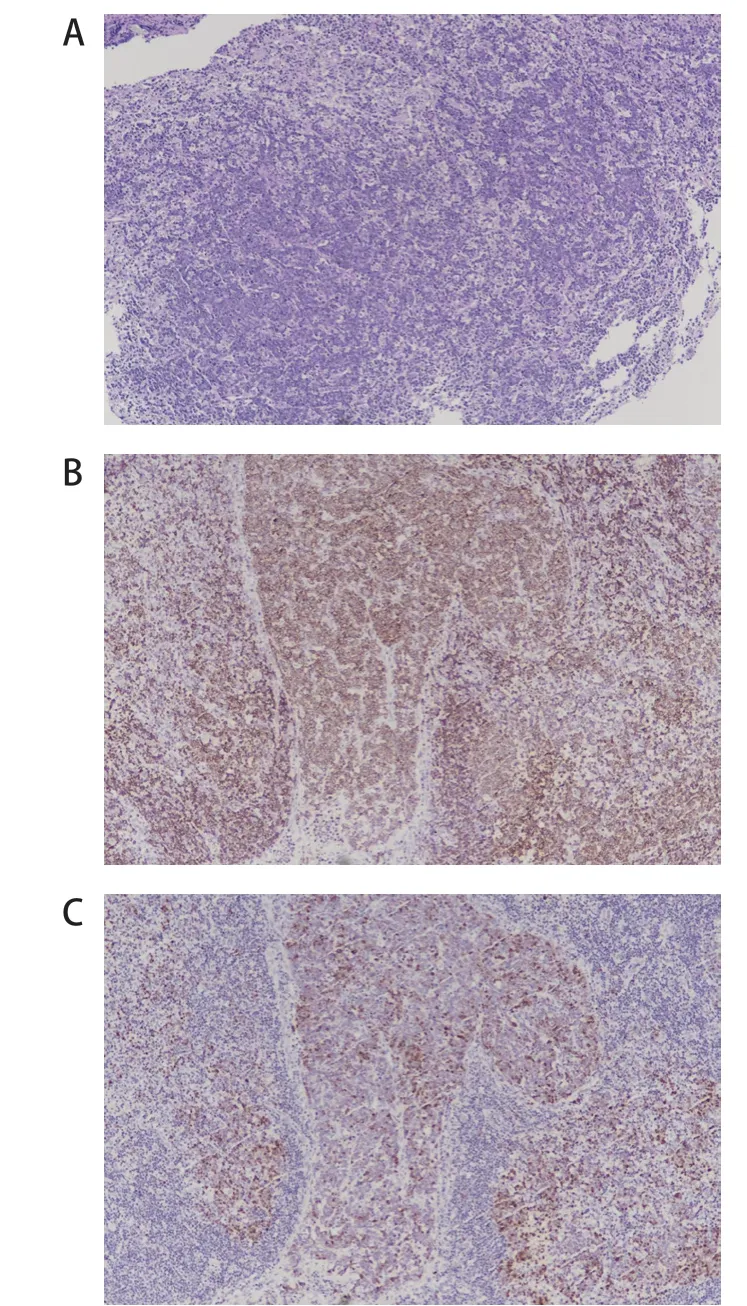
图1 例2 患儿病理表现
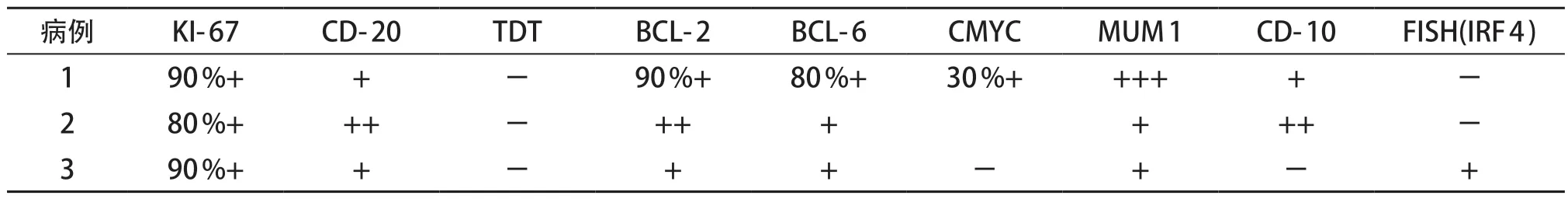
表1 3例患儿病理结果
在2016 WHO淋巴瘤分类更新版中,将该类肿瘤命名为伴IRF 4重排的大B 细胞淋巴瘤[6]。其常见于儿童和青年人,中位年龄10 岁(4~28岁),也可发生于老年人[3]。本组3例患儿年龄5~7岁,均为男性,但本组患儿例数偏少,可能与前期对该类型认识不足相关,有待进一步扩大样本量统计。
典型的LBL-IRF 4 淋巴瘤表现为儿童和年轻人中韦氏环内的肿块。韦氏环包块约8%的DLBCL表现出IRF4基因重排[3-4、11],在表达MUM1的扁桃体中,50%的儿童型滤泡性淋巴瘤(pediatric follicular lymphoma,PFL)表现出IRF4基因重排[4]。其他报道的罕见部位是腹腔淋巴结和肠道[3]。本组3例患儿分别发生于扁桃体、颈部淋巴结和回盲部,与文献报道相符。有研究者在儿童DLBCL或PFL病例中描述了IRF4的重排,且发现侵犯韦氏环和淋巴结的PFL的某些亚群在组织学、免疫组织化学和分子水平上存在差异,其中在涉及儿童或年轻人韦氏环的病例中,IRF4基因容易发生易位[3-4]。最近有报道,在因睡眠呼吸暂停而行扁桃体摘除术的患儿中发现病理诊断为伴IRF4基因重排的大B 细胞淋巴瘤[12]。另有学者报道1例12岁IRF4基因重排男性患者,涉及腹股沟区,但未涉及韦氏环[13]。
LBL-IRF 4 淋巴瘤的肿瘤细胞中等或偏大,染色质分散,可见嗜碱性小核仁,肿瘤可以呈完全弥漫、滤泡+弥漫型或完全滤泡型。当呈滤泡性生长模式时,滤泡较大,呈背靠背现象,套区变小或缺失,与儿童型滤泡性淋巴瘤不同,滤泡通常缺乏匍匐状生长模式和星空现象。LBL-IRF 4 肿瘤弥漫强阳性表达CD 20和MUM 1。在正常B 淋巴细胞成熟过程中,IRF 4 的表达抑制BCL-6 表达,激活B 淋巴细胞诱导的成熟蛋白1(B lymphocyte induced maturation protein 1,BLIMP1)。然而,在这些肿瘤中,IRF4基因重排导致MUM 1 和BCL-6 共表达以及BLIMP 1 表达缺失[3-4]。因此在LBL-IRF 4 肿瘤中,BCL-6 几乎总是阳性表达(94%~100%),而BCL-2 和CD 10 阳性表达率仅占约65%。本组3例患儿BCL-2、BCL-6和MUM1均阳性,2 例CD 10 阳性。当肿瘤细胞呈结节状时,BCL-2和MUM1是区别PFL和LBL-IRF4的重要指标。大部分PFL 病例BCL 2 阴性,IRF 4/MUM 1 强阳性应考虑LBL-IRF 4 的可能性。本组3 例患儿均弥漫强阳性表达IRF4/MUM1,虽然IRF4基因断裂阴性,但结合患儿年龄、部位、组织形态学(瘤细胞弥漫分布)、免疫表型(CD20、MUM1、CD10、BCL-6和BCL-2阳性)和其他基因检测结果(C-MYC和BCL-2断裂阴性)仍诊断为伴IRF4基因重排的大B细胞淋巴瘤。
分子遗传学上,在85%的LBL-IRF 4 患者中,IRF4与IGH融合,而轻链很少参与易位。在临床和病理特征相似的罕见病例中,IRF4易位可能无法用现有技术证实[3]。部分患者存在BCL6基因重排,几乎所有患者缺乏MYC和BCL2基因重排[3]。尽管大多数患者被发现具有生发中心B细胞起源,但具有独特的基因表达特征,这与生发中心B细胞和活化B细胞都不同。
综上所述,LBL-IRF 4 需要与普通型DLBCL 及PFL 鉴别。与普通型DLBCL 相比,LBL-IRF 4 显示出明显不同的临床病理学特征,但有相对较好的预后。因此,发生头颈部和胃肠道并表达MUM1的B细胞非霍奇金淋巴瘤,可考虑行FISH检测IRF4基因。

