白及多糖超声提取工艺及其抗氧化活性研究
吴诗惠 王剑波 开拓 朱宁 杨军 季绍聪 张美 杨安东


摘要 目的:优化白及多糖的超声提取工艺,比较不同产地白及多糖含量差异,考察白及多糖稳定性和抗氧化活性。方法:以多糖得率为考察指标,料液比、超声温度、超声时间为考察因素设计L9(34)正交试验优化白及多糖超声波提取工艺;以苯酚-硫酸法测定白及多糖含量,考察陕西汉中、云南普洱、湖南洪江及四川绵阳白及多糖含量产地差异;以化学方法考察白及多糖稳定性,并比较白及多糖对1,1-二苯基-2-苦肼基自由基(DPPH·)和羟基自由基(·OH)的清除率以评价其体外抗氧化活性。结果:最佳超声提取工艺条件为:料液比1∶25(g/mL)、超声温度80 ℃、超声时间10 min;四川绵阳白及多糖含量最高,达到60.81%,湖南洪江次之,云南普洱最低;白及多糖在柠檬酸及中性溶液中的稳定性较好,在苯甲酸钠、过酸性或过碱性溶液中的稳定性较差;白及多糖能有效地清除DPPH和羟基自由基,具有潜在的体外抗氧化活性。结论:白及多糖超声波提取工艺的优化及其抗氧化活性研究,可为白及多糖提取及综合利用提供借鉴。
关键词 白及;多糖;超聲波;稳定性;抗氧化活性;提取工艺;正交试验;自由基
Abstract Objective:To optimize the ultrasonic extraction process of Bletillastriata polysaccharides, compare the content of Bletillastriata polysaccharides from different origins, and investigate the stability and antioxidant activity of Bletillastriata polysaccharides. Methods:Polysaccharide yield rate was taken as the investigation index, the material-liquid ratio, ultrasonic temperature, and ultrasonic time was as the investigation factors, L9 (34) orthogonal test was designed to optimize the ultrasonic extraction process of Bletillastriata polysaccharides; the content of Bletillastriata polysaccharides was determined by phenol-sulfuric acid method. the differences in polysaccharide content of Bletillastriata polysaccharides in Hanzhong in Shaanxi, Pu′er in Yunnan, Hongjiang in Hunan and Mianyang in Sichuan were investigated. The stability of Bletillastriata polysaccharides was investigated by chemical methods, and the clearance rate of 1, 1-diphenyl-2-picridyl radical (DPPH·) and hydroxyl radical (·OH) by Bletillastriata polysaccharides was compared to evaluate its in vitro antioxidant activity. Results:The optimum extraction conditions were:solid/liquid ratio 1∶25 (g/mL), ultrasonic temperature 80 ℃, ultrasonic time 10 min. The content of Bletillastriata polysaccharides in Mianyang in Sichuan was the highest, reaching 60.81%, Hongjiang in Hunan Province was the second, Puer in Yunnan Province was the lowest; the stability test showed that the stability of Bletillastriata polysaccharides in citric acid and neutral solution was better than that in sodium benzoate, acid or alkaline solution. Bletillastriata polysaccharides can effectively remove DPPH and hydroxyl free radicals, and have potential antioxidant activity in vitro. Conclusion:Study on the optimization of the extraction process of Bletillastriata polysaccharides and its antioxidant activity can provide a reference for the extraction and comprehensive utilization of Bletillastriata polysaccharides.
Keywords Bletillastriata;Polysaccharides; Ultrasonic extraction; Stability; Antioxidant activity; Extraction process; Orthogonal test; Free radical
中图分类号:R282文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.17.007
白及(Bletillastriata(Thunb.)Reichb.f)别名连及草、雪如末、甘根,是兰科白及属多年生草本植物[1-2],因具有收敛止血、消肿生肌的功效,被作为一种传统中药在临床上广泛使用[3]。白及在陕西、云南、四川等地区大量种植,不同产地的白及活性成分有较大差异。其中40%~50%的天然水溶性白及多糖,是白及的主要功效成分,其化学组成为葡甘聚糖[4],可溶于水并形成黏稠的亲水胶液。目前白及多糖主要的提取方法有超声提取法[3]、酶提取法[4]、红外辐射法[5]、浸提法[6]等。
白及多糖具有抗炎、促凝血、抗病毒、抗肿瘤、抗氧化等生物学活性[7],对疮疡肿毒、胃溃疡、内外伤出血等症具有治疗作用[1]。除此以外,白及多糖是一种优良的天然增稠剂,可以形成高浓度、低黏度胶液,同时白及多糖具有优良的成膜性能,可以制备水果涂膜保鲜剂,减少水分蒸发达到保鲜目的。总的来说白及多糖是安全性较高的医药原料、药用辅料和生物医学材料[8]。
我们对白及多糖超声提取条件进行优化研究,通过对料液比、超声时间、超声温度等因素进行正交设计,以多糖含量为指标,确定最佳的提取条件,并比较不同产地白及多糖含量,考察其稳定性和抗氧化活性,为白及药材的综合开发利用提供参考依据。
1 仪器与试药
1.1 仪器 分析天平(苏州江东精密仪器有限公司,型号:ESJ210-4A),电热恒温股份干燥箱(常州普天仪器制造有限公司,型号:DHG-9140A),数控超声波清洗器(昆山禾创超声仪器有限公司,型号:KH5200DE),旋转蒸发器(上海亚荣生化仪器厂,型号:RE-2000A),紫外可见分光光度计(上海精密科学仪器有限公司,型号:752N),电热恒温水浴锅(上海一恒科学仪器有限公司,型号:HWS-26),电子天平(赛多利斯公司,德国,型号:QUINTIX224-1CN),高速冷冻离心机(Heraeus Multifuge,美国,型号:XIR),台式低速自动平衡离心机(湖南湘仪实验仪器开发有限公司,型号:L-420)梅特勒-托利多pH计(上海梅特勒-托利多仪器有限公司,型号:FE28-Standard),冷冻干燥机(北京松源华兴科技发展有限公司,型号:LGJ-12),万能粉碎机(天津泰斯特公司,型号:FW100)。
1.2 试剂 D-无水葡萄糖标准品(中国食品药品检定研究院,批号:110833-201707)、1,1-二苯基-2-苦肼基(Sigma,美国,货号:257621-100MG),其余试剂均为成都科龙化工有限公司生产,分析纯。
1.3 分析样品 白及药材于2020年3月購自四川省成都荷花池中药市场,产地分别为陕西汉中(批号:1901、1902、1903)、云南普洱(批号:1904、1905、1906)、湖南洪江(批号:1907、1908、1909)及四川绵阳(批号:1910、1911、1912),共12批次,经四川省农业科学院经济作物研究所张超研究员鉴定为兰科植物白及Bletillastriata(Thunb.)Reichb.f的块茎。
2 方法与结果
2.1 对照品溶液的制备 葡萄糖标准溶液配制:取D-无水葡萄糖标准品于105 ℃干燥至恒重,精密称取20 mg于500 mL量瓶中,用水溶解并定容至刻度,摇匀,即得。浓度为0.04 g/mL,备用。
2.2 标准曲线的制备 分别精密吸取葡萄糖标准溶液0.2、0.4、0.6、0.8、1.2、1.4、1.6 mL于棕色试管中,加水补至2.0 mL,加入1.0 mL浓度为5%的苯酚溶液(临用新配),迅速加入浓硫酸5.0 mL,摇匀,放置5 min后,至沸水浴中加热30 min,冷却至室温,在490 nm处测定吸光值,同法制空白对照溶液,以吸光度值(Y)为纵坐标,葡萄糖浓度(X,μg/mL)为横坐标,绘制标准曲线。
2.3 供试品溶液的制备 将白及块茎用清水洗净,润透,切薄片,40 ℃烘箱中干燥至恒重,粉碎,过80目筛,称取100 g,置圆底烧瓶中,加入85%乙醇1.5 L,回流提取1 h,重复操作2次,弃去提取液,以除去脂溶性成分,残渣挥干溶剂并晾干后,置于60 ℃烘箱中烘干备用。取上述预处理过的白及药材粉末20 g,精密称定,置圆底烧瓶中,加蒸馏水200 mL,80 ℃下超声提取3次(超声频率50 kHz),10 min/次,合并提取液,离心,上清液旋转蒸发浓缩至黏稠状,冷却后加入95%乙醇缓慢搅拌,使含醇量达到80%,4 ℃冰箱放置过夜,在12 000 r/min,离心半径10 cm,离心10 min,沉淀物再加95%乙醇搅拌,静置,使之充分脱水,在3 000 r/min,离心半径13.5 cm,离心5 min,挥干溶剂,再用少量蒸馏水溶解后,按体积比1∶4加入Sevage试剂充分振摇后,在3 000 r/min,离心半径13.5 cm,离心5 min,重复3次,以除去游离蛋白质(双缩脲反应呈阴性),沉淀置于-80 ℃预冷冻6 h,再冷冻干燥24 h,研细,即得白及粗多糖样品。称取干燥至恒重的白及多糖样品25 mg,加入少量蒸馏水,加热,搅拌使溶解,置于100 mL量瓶中,加水至刻度,摇匀,量取10 mL于100 mL量瓶中,加水至刻度,摇匀,作为供试品溶液。
2.4 测定法 精密吸取供试品溶液0.2 mL于棕色试管中,照2.2项下自“于棕色试管中”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中葡萄糖的含量并计算。
2.5 检测波长选择 精密吸取供试品溶液和葡萄糖标准溶液0.2 mL,照测定法显色后对200~600 nm范围进行波长扫描,结果显示其最大吸收波长为490 nm。
2.6 线性关系考察 精密吸取葡萄糖标准溶液0.2、0.4、0.6、0.8、1.2、1.4、1.6 mL的葡萄糖标准溶液,照上述方法测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线。回归方程为Y=0.085 63X+0.001 52,R2=0.997 1,表明葡萄糖浓度在8.0~64 μg/mL范围内线性关系良好。
2.7 供试品溶液稳定性试验 精密吸取白及多糖供试品溶液0.2 mL,按2.4项下显色方法进行测定,20 min测定1次,连续测定5次,结果显示:在100 min时间内,供试液的吸收度值RSD%分别为2.68%(n=5),表明稳定性良好,在2 h内测定结果可靠。
2.8 中间精密度试验 取葡萄糖标准品、白及多糖供试品溶液0.2 mL,各平行5份,经检测葡萄糖标准品溶液与白及多糖供试液的吸收度值(A490 nm)RSD%分别为0.28%、0.53%(n=5),表明该方法精密度符合要求。
2.9 回收率试验 精密量取白及多糖供试品溶液3.0 mL于9支10 mL容量瓶中,分别按照高(5.0 mL)、中(3.0 mL)、低(1.0 mL)剂量加入葡萄糖标准品溶液(0.4 mg/mL),用蒸馏水定容后,混匀,精密吸取0.2 mL,置于比色管中,按标准曲线项下进行显色并测定,加样回收率测定结果平均值为98.86%,RSD%为1.32%,表明本法准确性较高,符合含量测定的要求。
2.10 白及多糖超声波提取法
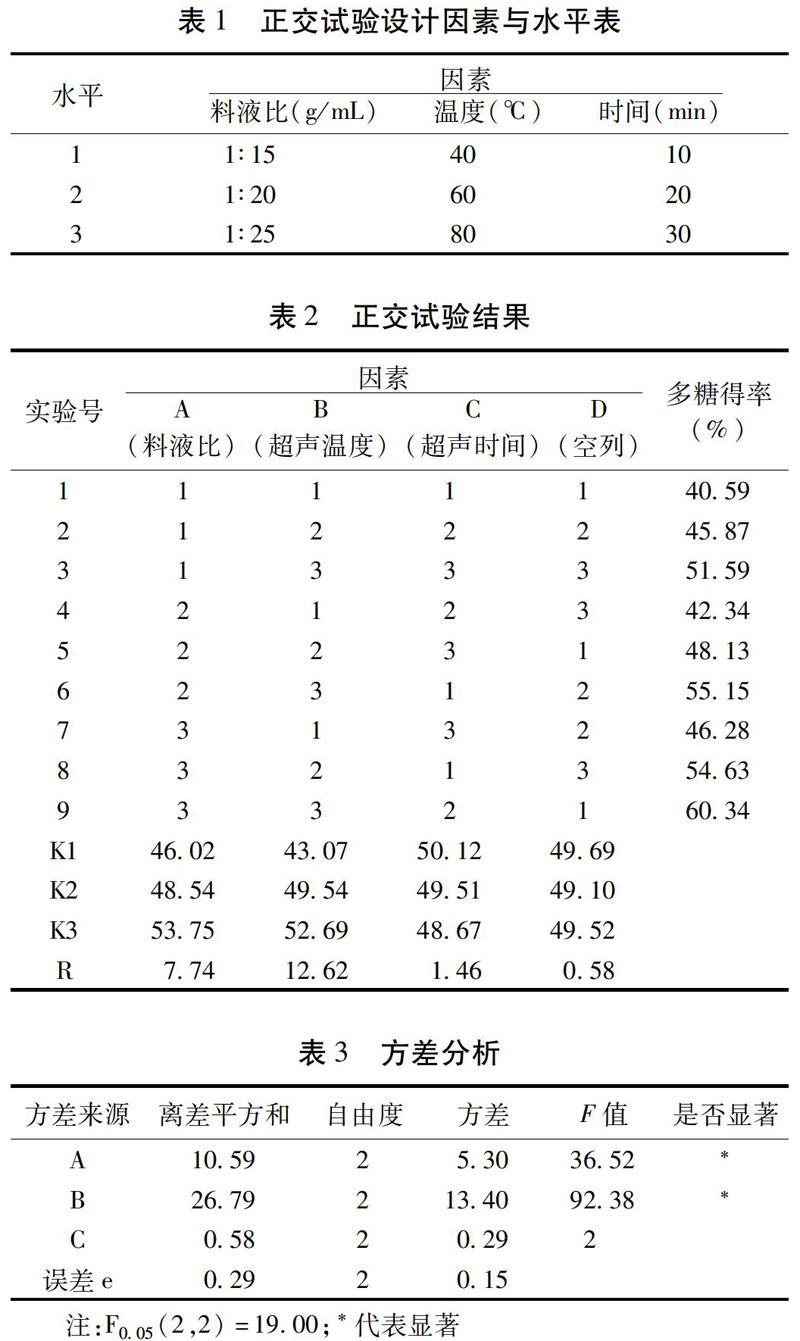
采用超声波提取法,拟定影响多糖得率的3个因素即料液比(g/mL)、超声温度(℃)和超声时间(min)为优选因素,每个因素设定3个水平进行正交试验。选L9(34)正交表进行设计,并以多糖含量作为考察指标。见表1。直观分析可知影响白及多糖超声波提取法的因素次序为:超声温度(B)>料液比(A)>超声时间(C),最佳工藝条件组合为A3B3C1,即料液比1∶25(g/mL)、超声温度80 ℃、超声时间10 min。见表2。方差分析结果可知,超声温度(B)和料液比(A)对白及多糖得率有显著的影响,而超声时间(C)无显著影响。见表3。按最优工艺进行3次重复试验,白及多糖得率为60.47%、60.39%、61.52%,平均60.79%,高于表2中的任意组合,表明优选的工艺稳定可行。
2.11 样品测定结果 各产地白及中多糖含量结果见表4。通过直观分析可以看出,来源于不同地区的白及药材中,其多糖含量存在较大差异,其中产地为四川绵阳的白及多糖含量最高,达60.81%,其他依次为湖南洪江、陕西汉中和云南普洱,说明地域性条件对白及药材的内在质量影响明显。
2.12 白及多糖稳定性考察
2.12.1 食品添加剂对白及多糖稳定性影响 取浓度为5.0 mg/mL的四川绵阳白及粗多糖溶液5 mL,平行2份,分别加入2.0 mL 0.05 mol/L苯甲酸钠、2.0 mL 0.05 mol/L柠檬酸,摇匀密封,避光静置2 h,加入苯酚-硫酸溶液显色,冷却20 min后测定其吸光度[9],同时以水为空白,同上操作。结果见表5。柠檬酸组影响较小,接近对照组,而苯甲酸钠组影响较大。
2.12.2 pH对白及多糖稳定性影响 pH值对白及粗多糖稳定性的影响:取浓度为5.0 mg/mL的四川绵阳白及粗多糖溶液5 mL,各6份,用0.1 mol/L HCl和0.1 mol/L NaOH调节pH,为2.0,4.0,6.0,8.0,10.0和12.0,振摇密封,避光处理2 h,用上述苯酚-硫酸比色法测其吸光度[10],同时以蒸馏水为空白,同上操作,扣除溶剂的影响后,计算出吸光度值。结果如图1所示,酸性与碱性对白及多糖均有一定的影响,其中酸性对白及多糖影响大于碱性,同时,白及多糖在pH=8时,相对稳定。
2.13 白及多糖抗氧化活性试验
2.13.1 白及多糖对DPPH·自由基的清除能力 DPPH·清除能力的测定:·参照Luo等[10](2011)的方法,分别取浓度为0.001、0.01、0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0 mg/mL产地为四川绵阳的白及粗多糖样品供试液各2.0 mL,分别加入2.0 mL 0.1 mmol/L的DPPH·-80%甲醇溶液,室温反应30 min,在517 nm处测定吸光度值,并按以下公式计算白及多糖对DPPH·的清除率(I%)。式中A1为供试液吸光度值;A0为水代替白及多糖组;A2为水代替DPPH·。以同浓度抗坏血酸(维生素C)为阳性对照,做相同处理并计算结果。
随着浓度升高,白及多糖对DPPH·自由基的清除能力逐渐提高,在白及多糖浓度≤0.6 mg/mL时,提升较为明显,具有明显的浓度依赖性。当浓度达到5 mg/mL时,白及多糖和维生素C对DPPH·自由基清除率分别达到69.73%和95.64%。见图2。
2.13.2 白及多糖对羟基(·OH)自由基的清除能力 羟基自由基(·OH)清除率的测定:参照Sun等[11]的方法,取产地为四川绵阳的白及粗多糖样品,分别配置成0.001、0.01、0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0 mg/mL的供试品溶液,各取1.0 mL,依次分别加入9 mmol/L FeSO4溶液1.0 mL、9 mmol/L的水杨酸溶液1.0 mL以及0.1%的H2O2溶液0.5 mL,混匀,置于37 ℃反应30 min,在510 nm下测定吸光度值,记为A1,以去离子水代替样品作为待测溶液,记为A0,以去离子水代替FeSO4、水杨酸和H2O2溶液,记为A2对同样浓度的维生素C(Vc)作同样处理作为阳性对照,按上述同样公式计算(·OH)清除率(I%)。
结果如图3所示:白及多糖对·OH自由基的清除能力跟多糖浓度呈正相关趋势,当白及多糖浓度≥3 mg/mL时,清除能力增加变缓。
3 讨论
本研究采用较为成熟的苯酚-硫酸法显色,UV-VIS测定不同产地白及中多糖的含量,经方法学验证,本法灵敏度高、显色稳定且结果准确。从试验结果可知,不同产地的白及多糖含量存在差异,其中四川绵阳的白及多糖含量远高于湖南洪江、陕西汉中和云南普洱,说明白及药材因来源不同,由于其生长环境的不同等因素,其内在质量存在一定的差异。对白及多糖的提取,利用超声波辅助处理,采用正交实验得出白及多糖的最优提取条件为:料液比1∶25(g/mL)、超声温度80 ℃、超声时间10 min,白及多糖收率可达60%,与传统溶剂提取法比较,多糖含量及转移率都有所提高,且具有便捷、高效、环保、节能等特点。白及多糖稳定性研究结果表明,白及多糖在酸性条件下稳定性较差,在中性溶液中稳定性较好,碱性溶液中影响低于酸性。同时,食品添加剂苯甲酸钠对白及多糖的稳定性影响较大,柠檬酸中较稳定,这对白及多糖在食品加工领域的应用具有一定指导意义。因此,在开发利用白及多糖时,应尽量控制影响白及多糖稳定性的不良因素,避免白及多糖与苯甲酸钠等食品添加剂直接接触。据报道,多糖糖醛酸含量、分子量大小等因素对其清除DPPH·自由基的能力强弱有影响[12-13]。抗氧化研究结果表明,白及多糖具有清除羟基自由基(·OH)和二苯基苦酰肼基自由基(DPPH·)的能力,呈现明显的浓度依赖性,但清除能力不同,且弱于阳性药物维生素C。以上研究结果为白及多糖在自由基清除剂、食品添加剂等中的应用提供了科学依据,也为白及药材的综合开发利用提供了供参考依据。
参考文献
[1]孙达锋,史劲松,张卫明,等.白芨多糖胶研究进展[J].食品科学,2009,30(3):296-298.
[2]韩欣,王文苹,隋宏,等.白芨多糖的提取与除蛋白研究[J].宁夏医科大学学报,2013,35(5):536-538.
[3]王芳,李东.白芨多糖的超声提取条件优选[J].产业与科技论坛,2013,12(16):106-107.
[4]孔俊豪,史劲松,孙达峰,等.白芨多糖的酶法精制工艺条件研究[J].食品科学,2009,30(14):52-56.
[5]Qu Y,Li C,Zhang C,et al.Optimization of infrared-assisted extraction of Bletilla striata polysaccharides based on response surface methodology and their antioxidant activities[J].Carbohydr Polym,2016,148:345-353.
[6]舒任庚,蒋跃平,蔡永红.植物多糖的提取分离方法探讨[J].中国药房,2011,22(11):1052-1055.
[7]赵文昌,宋丽军,许健煌.天然高分子白芨多糖在药物制备中的应用[J].今日药学,2010,20(3):2-3.
[8]王轶,于国英,高振珅.正交试验法优化白及粗多糖的提取工艺[J].中药材,2012,35(2):314-316.
[9]史娟.微波预处理-超声波提取山茱萸多糖及稳定性研究[J].食品研究与开发,2014,35(1):1-5.
[10]Luo Q,Zhang J,Yan L,et al.Composition and antioxidant activity of water-soluble polysaccharides from Tuber indicum[J].J Med Food,2011,14(12):1609-1616.
[11]Sun L,Wang C,Shi Q,et al.Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activities[J].Int J Biol Macromol,2009,45(1):42-47.
[12]Sun L,Wang L,Li J,et al.Characterization and antioxidant activities of degraded polysaccharides from two marine Chrysophyta[J].Food Chem,2014,160:1-7.
[13]Zeng WC,Zhang Z,Jia LR.Antioxidant activity and characterization of antioxidant polysaccharides from pine needle(Cedrus deodara)[J].Carbohydr Polym,2014,108:58-64.
(2020-07-10收稿 責任编辑:杨觉雄)

