异育银鲫(Carassius auratus gibelio)脊髓组织 细胞系的建立及对CyHV-2 的敏感性*
魏钰娟 潘晓艺 蔺凌云 赟姚嘉 郝贵杰 曹 铮 夏焱春 尹文林 刘忆瀚 沈锦玉,
(1. 上海海洋大学水产与生命学院 上海 201200; 2. 农业农村部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室 浙江省淡水水产研究所 湖州 313001)
鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus Ⅱ, CyHV-2)又被称为疱疹病毒性造血器官坏死病病毒(Herpesviral haematopoietic necrosis virus, HVHNV)(徐进等, 2013)或金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus, GFHNV)(Jefferyet al, 2007)与鲤科鱼类的其他两种疱疹病毒CyHV-1(Carp pox)和CyHV-3(Koi herpesvirus, KHV)同属于异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)。CyHV-2 于1992—1993 年间给日本西部养殖的金鱼造成了巨大的经济损失, 患病金鱼死亡率高达100% (Junget al, 1995)。随后其他国家和地区也相继有了该 病暴发的报道, 1997 年春季在美国西海岸一循环水养殖场的金鱼幼鱼出现大量死亡, 死亡率高达80%以上, 后经证实其发病是由CyHV-2 感染引起的。观赏鱼的国际贸易很大程度上促进了该病的跨区域传播, 随后中国台湾、澳大利亚、英国养殖的金鱼相继暴发该病(Stephenset al, 2004; Jefferyet al, 2007; Hansonet al, 2011)。2011 年匈牙利报道了养殖的银鲫也发现了CyHV-2 感染。而中国大面积暴发该病始于2009年, 主要发生在江苏省鲫鱼养殖区射阳、大丰、宝应、高邮、东台等地, 发病总面积在6600ha 以上, 发病严重的塘口死亡率高达90%, 造成的经济损失达数亿元(桂建芳, 2009; Xuet al, 2013)。与此同时, 在湖北、湖南、江西、浙江等省份, 也相继在患病鲫鱼体内检测出CyHV-2。
细胞培养分离技术是病毒病诊断的经典方法, 也常被世界动物卫生组织(OIE)所推荐。CyHV-2 敏感细胞系的建立对CyHV-2 的分离、特征分析和细胞灭活疫苗研究都具有重要作用。但已有研究发现CyHV-2 很难在鱼类病毒分离常用的细胞系中进行连续的传代(马杰等, 2016), 比如胖头鲤细胞(fathead minnow cells, FHM) (Junget al, 1995)、鲤鱼上皮瘤细胞(epithelioma papulosum cyprini, EPC)、草鱼卵巢细胞(grass carp ovary, CO)、草 鱼 肾 细 胞(grass carp kidney, CIK)均对CyHV-2 不敏感, 仅锦鲤鳍细胞(koi fin, KF-1)能产生细胞病变效应(CPE), 但病毒在KF-1细胞上传至第3—5 代后, CPE消失且检测不到病毒核酸(Junget al, 1995)。虽然已有学者建立了异育银鲫脑组织细胞系(Maet al, 2015)和鳍条细胞系(Luet al, 2018), 且对CyHV-2 敏感, 但由于不对外供应, 还是缺乏CyHV-2 敏感的细胞系, 限制了对CyHV-2 的研究, 因此建立对CyHV-2 敏感的细胞系并研究该细胞系的生物学特性, 对CyHV-2 进行连续传代扩大培养从而深入研究病毒的特性, 具有重要的意义。
1 材料与方法
1.1 试验材料
患鲫造血器官坏死病异育银鲫(Carassius auratus gibelio)采集自江苏盐城某鲫鱼养殖场。健康异育银鲫来自于浙江省淡水水产研究所综合试验基地, 平均体重120±20g/尾, 实验前于室内养殖水池暂养。L-15细胞培养基、青霉素/链霉素、磷酸缓冲液(PBS)、胰蛋白酶-EDTA、秋水仙素均购自Sigma 公司, 胎牛血清购自GIBICO 公司, DNA 核酸提取试剂为天根产品; PCR 用rTaq 预混液购为TaKaRa 公司。细胞培养瓶、移液管、细胞冻存管均购自Corning 公司。
1.2 鲫鱼脊髓细胞系的建立
1.2.1 原代培养 健康异育银鲫以75%酒精进行体表消毒3—4 次, 无菌条件下取出异育银鲫脊髓组织, 置于含200U/mL 青霉素和200μg/mL 链霉素的Hank’s 平衡盐溶液(HBSS)中(图1), 清洗三次。然后将洗干净的组织移至盛有L-15 培养液的培养皿中进行平衡。根据Freshney(2010)和薛庆善(2001)原代培养法, 采用组织块移植法进行原代细胞培养。将上述的脊髓组织剪成约 0.1mm3的组织块, 然后移植到25cm2的细胞培养瓶中, 均匀平铺于培养瓶底面, 倒置平放, 24°C 恒温培养, 放组织块的一面朝上, 培养瓶中添加3mL 含20%V/V胎牛血清、100U/mL 青霉素、100μg/mL 链霉素的L-15 培养液, 过夜, 慢慢将培养瓶正置过来进行培养, 每2—3 天更换培养液一次, 倒置生物显微镜观察细胞生长情况。

图1 培养皿中异育银鲫脊髓组织 Fig.1 Spinal cord tissue of C. auratus gibelio in culture dish
1.2.2 传代培养 参照肖艺等(2012)的方法进行细胞传代培养。当细胞从组织块中迁出单层达培养瓶底面积90%时, 采用胰蛋白酶消化法按1 瓶传2 瓶的方式进行传代, 24°C 培养, 待细胞再次形成单层后, 再同法进行传代培养, 直至获得稳定传代的异育银鲫脊髓组织细胞系CSC。并对稳定传代的细胞系添加细胞冻存液后进行液氮保存。
1.2.3 细胞染色体核型分析 对处于对数生长期的CSC 细胞, 加入终浓度为0.4μg/mL 的秋水仙素, 25°C 孵育4h 后胰酶消化收集细胞, 用0.075mol/L 的KCl 溶液低渗处理25min 后加入预冷的卡诺固定液, 1000r/min离心5min去上清后再用预冷的卡诺固定液固定3 次, 每次15min。冷滴片法滴片, 干燥后用5% Giemsa 染色25min, 流水冲洗, 干燥后显微镜观察。100倍油镜下随机选取100 个细胞, 统计其染色体数目。
1.3 CSC 细胞对CyHV-2 的敏感性
1.3.1 对CyHV-2 的敏感性 将鲤疱疹病毒Ⅱ型阳性的病鱼肾脏、脾脏、脑、脊髓组织剪碎, 并加等体积PBS 进行匀浆, 匀浆液5000r/min 4°C 离心15min 后, 上清经0.45μm 和0.22μm 滤膜过滤, 制备成无菌组织匀浆滤液。将病毒滤液按1︰10 和1︰20的稀释度感染培养至单层的CSC 细胞, 24°C 吸附1h后, 弃去病毒稀释液, 换成血清浓度为2%的L-15 维持液继续24°C 培养, 逐日观察细胞病变情况(Wanget al, 2016)。
1.3.2 病毒的TCID50测定 在96 孔细胞培养板中将CSC 细胞培养至单层细胞, 用维持液将CyHV-2 感染CSC 细胞7d 后的病毒裂解液作连续10 倍稀释, 即10-1、10-2……10-10, 每个稀释度取100μL 加入96孔细胞培养板中, 每个稀释度作8 个重复, 并设空白细胞培养对照。置24°C 培养箱中。逐日观察细胞病变, 并记录细胞病变孔数。按Reed-Muench 法计算病毒滴度TCID50值。
1.3.3 CSC 对CyHV-2 传代的稳定性 采用CSC细胞对1.3.1分离的病毒进行传代, 传代至第7代次, 保存每代次的病变细胞用于CyHV-2的检测。病变细胞的总DNA采 用 DNAzol 进 行 提 取, CyHV-2 检 测 引 物 为: CyHV-2-366F: 5′-GGACTTGCGAAGAGTTTGATTTC TAC-3′; CyHV-2-366R: 5′-CCATAGT CACCATCG TCTCATC-3′ (Waltzeket al, 2009)。
1.3.4 CSC 病变细胞的电镜观察 将感染第7 代CyHV-2 的CSC 病变细胞经2%戊二醛固定液(pH 7.2, 0.1mol/L PBS 缓冲液配制)预固定, 1%四氧化锇固定液后固定, 再经脱水包埋后进行超薄切片, 3%醋酸铀-枸橼酸铅双染色后, 透射电镜观察。
2 结果与分析
2.1 原代细胞特征
采用含20%胎牛血清的L-15 培养液, 对处理成小块的异育银鲫脊髓组织, 黏附细胞瓶后, 于24°C 进行恒温静止培养, 3—4d 后有些细胞从组织 块周围迁出, 细胞形态呈成纤维样(图2)。待单层细胞长至充满瓶底面积80%—90%时, 按1 传2 的方式进行传代。
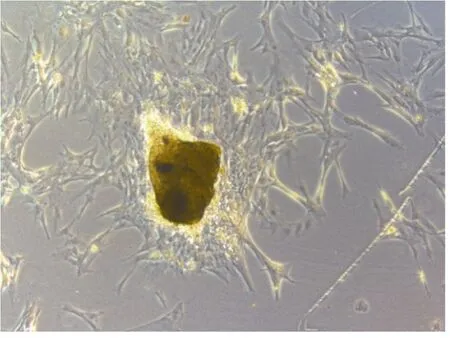
图2 原代异育银鲫脊髓组织细胞 Fig.2 The spinal cord tissue cells of C. auratus gibelio in the primary culture
2.2 传代细胞特征
CSC 细胞首次传代, 约30min 可完成贴壁, 群体倍增时间为48h。连续传代 8 次后, 传代细胞贴壁生长速度更趋稳定, 3d 后可形成单层细胞。在传代至第10 代后, 逐渐减少血清含量至10%, 通过连续传代, 采用10%胎牛血清的L-15 培养液, 24°C 培养, 可对CSC 细胞进行稳定培养, 至今CSC 细胞已传至128代。获得稳定传代的第10、第50 和第100 代次CSC细胞形态见图3, 并对CSC 细胞进行了保藏, 保藏号为CCTCC NO: C2018211。采用添加细胞冻存液, 将传代的细胞系于液氮中进行冷冻保存。

图3 异育银鲫脊髓组织细胞系 Fig.3 Morphology of CSC cells
2.3 传代细胞染色体分析
采用秋水仙素使分裂的细胞停止于分裂中期, 再通过低渗法进行染色体观察。通过对100 个分裂相细胞的观察, 第26 代异育银鲫脊髓组织来源细胞的染色体数分布在152—160 之间(图4a), 41%的细胞都含有156 条染色体(图4b), 表明该细胞的宿主为三倍体异育银鲫。
2.4 CSC 细胞对CyHV-2 的敏感性
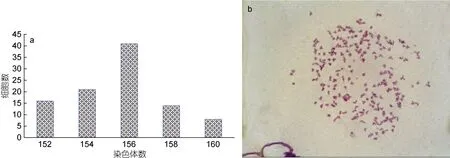
图4 第26 代异育银鲫脊髓组织细胞系的染色体 Fig.4 Chromosomes of CSC cells at passage 26
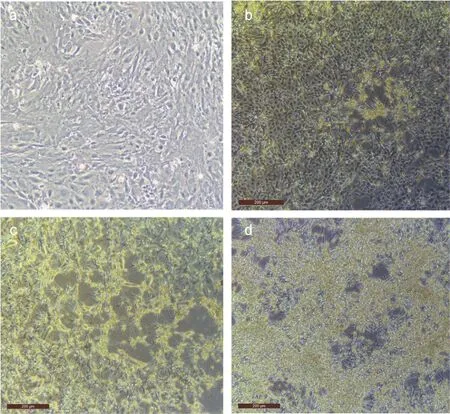
图5 CSC 细胞感染CyHV-2 后的病变特征 Fig.5 CPE features of CyHV-2 infected CSC cells
CyHV-2 阳性样品组织匀浆液感染CSC 细胞单层(图5a), 并以含2%血清的L-15 维持液培养, 逐日观 察细胞病变(CPE), 感染后第3 天细胞聚合后溶解出现空斑(图5b), 感染后第5 天空斑区域扩大(图5c), 感染后第7 天细胞出现大片聚合病变(图5d)。
2.5 传代病毒的TCID50 测定
不同稀释浓度的病毒裂解液接种96 孔的CSC 细胞单层后, 连续观察9d, 记录每个稀释度的细胞病变孔数, 结果见表1 所示, 按 Reed-Muench 法计算, 换算成1mL 所含的TCID50为109.33/mL。
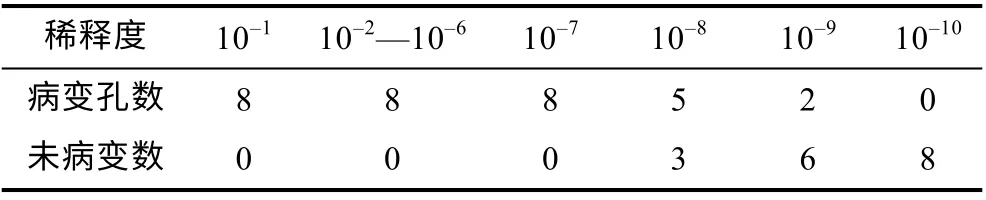
表1 TCID50 检测 Tab.1 Detection of TCID50 in different virus dilutions
2.6 CSC 细胞对病毒传代的稳定性
对收集的第2—7 代次的CyHV-2 细胞培养物进行DNA 提取, 并进行CyHV-2 的检测, 发现第2 代次至第7 代次培养物的总DNA, 都可扩增得到366bp的目的片段(图6), 表明CyHV-2 在CSC 细胞中可以稳定传代7 代以上。
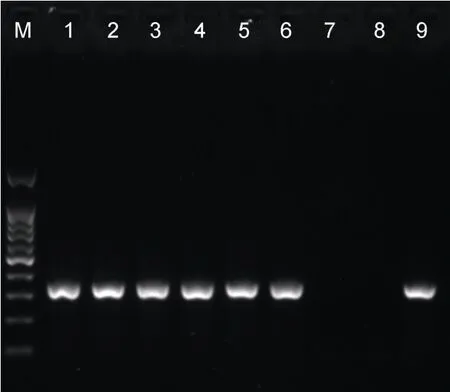
图6 不同培养代次CyHV-2 的PCR 检测结果示意图 Fig.6 Schematic results of PCR detection of CyHV-2 in different culture passages
2.7 鲤疱疹病毒Ⅱ型感染CSC 的电镜观察
通过透射电镜观察感染CyHV-2 后的CSC 病变细胞, 可观察到大量直径在128—134nm 的疱疹样病毒粒子, 呈球形颗粒状。说明CyHV-2 在CSC 细胞中能繁殖、扩增(图7a, 图7b)。
3 讨论
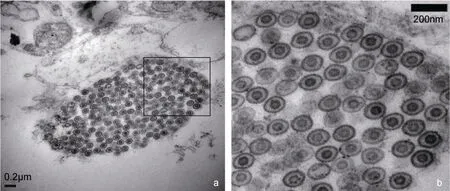
图7 第7 代CyHV-2 病毒感染CSC 的细胞电镜超薄切片示意图 Fig.7 Schematic view of ultrathin section of the 7th generation CyHV-2-infected CSC cells
鱼类细胞培养的研究始于20 世纪60 年代, Wolf等(1962)建立了虹鳟(Oncorhynchus mykiss)生殖腺细胞系RTG-2。此后, 鱼类细胞系的建立及其相关研 究进展迅速, 迄今为止, 已有300 株左右来自不同品种鱼类的不同组织的细胞系已被建立, 鱼类细胞培养已成为一项重要的技术, 在病毒学、免疫学、鱼类资源保护与遗传育种、病理学、环境毒理学、鱼类生理学、内分泌学和转基因等方面的理论及应用研究中发挥作用(Lakraet al, 2011)。而鲫鱼组织源的细胞系也被多位学者建立, 包括鳍条细胞系CFS、鲫鱼异倍体囊胚细胞系CAB-800、鲫鱼腮盖膜细胞系HCC-87、银鲫鱼背鳍细胞系SCC-DF、鲫鱼脑细胞系GiCB、鲫鱼尾鳍细胞系GiCF 等(陈敏容等, 1985; 李亚男等, 1992; Hasegawaet al, 1997; Maet al, 2015; Luet al, 2018)。
原代细胞培养主要有组织块贴壁法、胰蛋白酶消化法、机械分散法、络合剂分散法等(于淼等, 2003)。常用的是组织块贴壁法和胰蛋白酶消化法, 比较这两种原代细胞培养法的优缺点, 组织块贴壁法更适用于不易消化的组织。根据前期对CyHV-2 在鲫鱼内脏组织分布的研究发现, 脑和肾脏的病毒含量最高(袁雪梅等, 2019), 此外, 疱疹病毒容易在神经细胞中进行潜伏感染(Grinde, 2013), 因此, 本研究选择与脑连接的脊髓组织作为原代细胞培养的组织源。脊髓组织质地松软, 含有较多不易被消化的组织, 所以选择组织块贴壁法对鲫鱼脊髓组织进行原代细胞培养。采用胰蛋白酶消化法对鲫鱼脊髓原代细胞进行传代培养, 以1︰2 的比例顺利获得传代。细胞是否可以长期冻存和成功复苏, 对于建立稳定的细胞系至关重要。本实验中, 采用液氮保存法, 选取了细胞冷冻保护液, 有效避免了因细胞在降温过程中形成冰晶而造成的细胞损坏(陈爱平等, 2011)。
细胞系是分离病毒性病原的重要材料。而鲫鱼来源的对CyHV-2 敏感的细胞系较缺乏, 制约了有关鲫鱼疱疹病毒病的研究进展。本研究以鲤疱疹病毒Ⅱ型感染CSC 细胞系后, 细胞出现了明显病变效应, 在感染第7 天病毒滴度达到了109.33TCID50/mL。而已报道的对CyHV-2 最敏感的细胞系, 分离的病毒最高滴度只有104.9TCID50/mL (GiCF) (Luet al, 2018) 和107.5TCID50/mL (GiCB) (Maet al, 2015)。这表明CSC细胞系扩增 CyHV-2 的能力更强, 并且分离的CyHV-2 病毒可在CSC 细胞中稳定传代, 传代病毒的各代次病毒滴度稳定。通过对固定的病变细胞进行电镜观察, 在细胞中观察到大量的疱疹样病毒颗粒, 直径大小为 128—134nm, 病毒粒子的形状和大小与CyHV-2 病毒一致(李茂等, 2015)。根据电镜观察到的病毒量, 也间接证明了病毒CyHV-2 可以在CSC 细胞中进行高效的复制。这为制备鲫造血器官坏死病细胞培养灭活疫苗提供了可靠的病毒复制载体。
4 结论
综上, 本研究建立的CSC 细胞系对CyHV-2 敏感, 且病毒在该细胞系中能进行稳定高滴度地传代, 因此CSC 细胞系成为研究CyHV-2 复制与发病机制的有效工具, 还可用于CyHV-2 细胞培养灭活疫苗的制备。以此为基础研究获得的CyHV-2 细胞灭活疫苗将有助于我国鲫造血器官坏死病的预防和控制。

