2019年中国中心伦理制度落实现状调查研究
■ 吴大维 崔丹丹 阎 昭 柴慧婷 刚奕冰 韩娟娟韩帅玮琦 徐震纲 顾金辉 李 宁
近年来,我国临床研究进入了高速发展阶段,特别是在以肿瘤药物临床试验为代表的热门领域,试验项目和药物数量增长趋势明显[1]。整个行业快速发展的新形势,对伦理审查效率和质量提出更高要求。我国新政策[2-3]引入“中心伦理”制度,加速了多中心临床研究伦理审查模式的转变。但目前对国内医院中心伦理制度落实现状还没有相关报道,近两年来关于伦理审查的调研主要针对药物临床试验伦理审查体系的医疗机构管理[4]和审查能力[5],未涉及关于接受中心伦理意见等程序的调查;另有综述和评论探讨了多中心临床试验的协作审查模式[6-8],但缺乏调查数据。因此,我们开展了针对国内102所医院的电子问卷调查,分析了中国医学科学院肿瘤医院伦理委员会接受中心伦理程序实施效果,总结了2019年全国中心伦理落实情况。
1 资料与方法
1.1 调查对象和方法
本研究的调查对象为全国26个省市共102所医院,包括27所“重大新药创制科技重大专项示范性药物临床评价技术平台建设课题”承担单位(简称“新药专项课题承担单位”),于2019年5~11月采用电子问卷进行横断面现况调查,由国家卫生健康委员会科技教育司重大专项处和中国医学科学院肿瘤医院向上述医院发放和回收问卷。比较分析中国医学科学院肿瘤医院伦理委员会2019年1月1日至12月31日接受中心伦理程序和会议审查所需时间。
1.2 数据处理
本研究调查问卷内容包括4个模块:医疗机构基本情况、伦理委员会基本情况、临床试验门诊/病房基本情况和临床试验项目开展情况。根据2名伦理审查相关专家的意见,筛选出与伦理审查模式及其影响因素相关的3个模块共计15个问题纳入分析(表1)。选择伦理委员会是否接受组长单位中心伦理、是否接受区域伦理委员会2个变量作为关键指标,对中心伦理制度的实施情况和潜在影响因素进行分析。接受组长单位中心伦理或区域伦理定义为医院具有接受组长单位或区域伦理委员会审查意见的程序,包括有条件接受,即医院伦理委员会仍保留自主确定临床研究在本院可行性并提出建议的职能[2-3,7]。
中国医学科学院肿瘤医院伦理委员会审查时间调查针对接受中心伦理和会议审查两种程序,包括初始审查和跟踪审查两种审查类型,将接受中心伦理程序中资料接收到出具正式意见时间、会议审查中资料接收到上会时间和会议审查到出具正式意见时间3个变量作为关键指标,对比接受中心伦理程序和会议审查从资料接收到出具正式意见的总时间。

表1 纳入统计分析的问卷内容
1.3 统计分析
使用SPSS 25.0进行数据统计分析。描述性分析结果采用百分比、中位数等表示。中心伦理制度实施的影响因素分析采用χ2检验比较各分类变量的组间差别,以双侧P<0.05为差异具有统计学意义;医院开展的各类临床研究数量和接受核查次数以中位数为界值转换为二分类变量进行χ2检验。伦理委员会接受中心伦理程序和会议审查时间符合正态分布,采用独立样本t检验比较差异,以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 医院临床研究基本情况
本次调查共回收问卷92份,10所医疗机构未回应。回收的92份问卷均为有效问卷,有效回收率为90.2%。提供有效问卷信息的92所医院中,有90所(97.8%)是三级甲等医院;包括30所(32.6%)肿瘤专科医院;27所(29.3%)为新药专项课题承担单位,26所(28.3%)为国家临床医学研究中心,50所(54.3%)已经建立了临床研究相关激励机制或政策。92所医院在2018年立项的全部临床研究中位数为49项,范围为0~335项;其中新药注册临床试验中位数29项,范围为0~234项;新药注册临床试验牵头项目中位数1项,范围为0~55项;在研临床研究中位数59项,范围为0~493项。上述医院2018年接受药监部门核查中位数为2次,范围为0~36次。
2.2 医院伦理委员会和中心伦理落实情况
伦理委员会情况方面,92所医院中能够接受组长单位中心伦理和区域伦理意见的分别为27所(30.0%)和18所(19.6%)。28所(31.8%)医院的伦理委员会可以进行前置审批,30所(32.6%)医疗机构的伦理委员会获得过认证,17所(19.5%)医疗机构伦理会议频次每月少于1次,55所(69.3%)为每月1次,15所(17.2%)每月大于1次。能够同时实施接受组长单位中心伦理和区域伦理程序的医院有14所(15.2%),均为三甲医院,有3所肿瘤专科医院、7所新药专项课题承担单位、3所临床医学研究中心,分布于北京(4所)、上海(3所)、安徽和四川(各2所)、江苏和湖北以及湖南(各1所)。
2.3 中心伦理制度实施的影响因素分析
对医院是否接受组长单位中心伦理、接受区域伦理委员会的影响因素进行相关性分析表明,27所新药专项课题承担单位中有13所(48.1%)接受组长单位中心伦理,比例较非课题承担单位更高(P=0.014)。此外,有临床研究激励机制(P=0.047),实行前置伦理审批(P=0.022),2018年牵头新药注册临床试验≥1项(P=0.009)和接受核查≥2次(P=0.014)的医院接受组长单位中心伦理比例更高;2018年接受核查≥2次(P=0.047)的医院接受区域伦理比例更高(表2)。
2.4 中国医学科学院肿瘤医院接受中心伦理程序时间调查
中国医学科学院肿瘤医院伦理委员会自2018年11月开始正式实施接受中心伦理程序,程序规定医院作为多中心临床研究参与单位时,组长单位审查通过的新方案或方案、知情同意书等文件修订将采用简易程序决定是否接受中心伦理意见。2019年1月1日至12月31日,共进行接受中心伦理程序47项,包括30项初始审查、17项跟踪审查,从资料接收到正式意见中位时间4天,范围在1~22天。同时期共进行常规会议审查731项,包括230项初始审查、501项跟踪审查,从资料接收到会议审查中位时间4天,范围1~74天;从会议审查到正式意见中位时间4天,范围在1~12天;会议审查从资料接收到正式意见合计中位时间12天,范围在2~78天(图1)。接收中心伦理程序从资料接收到正式意见的时间较会议审查显著缩短(P=0.009)。
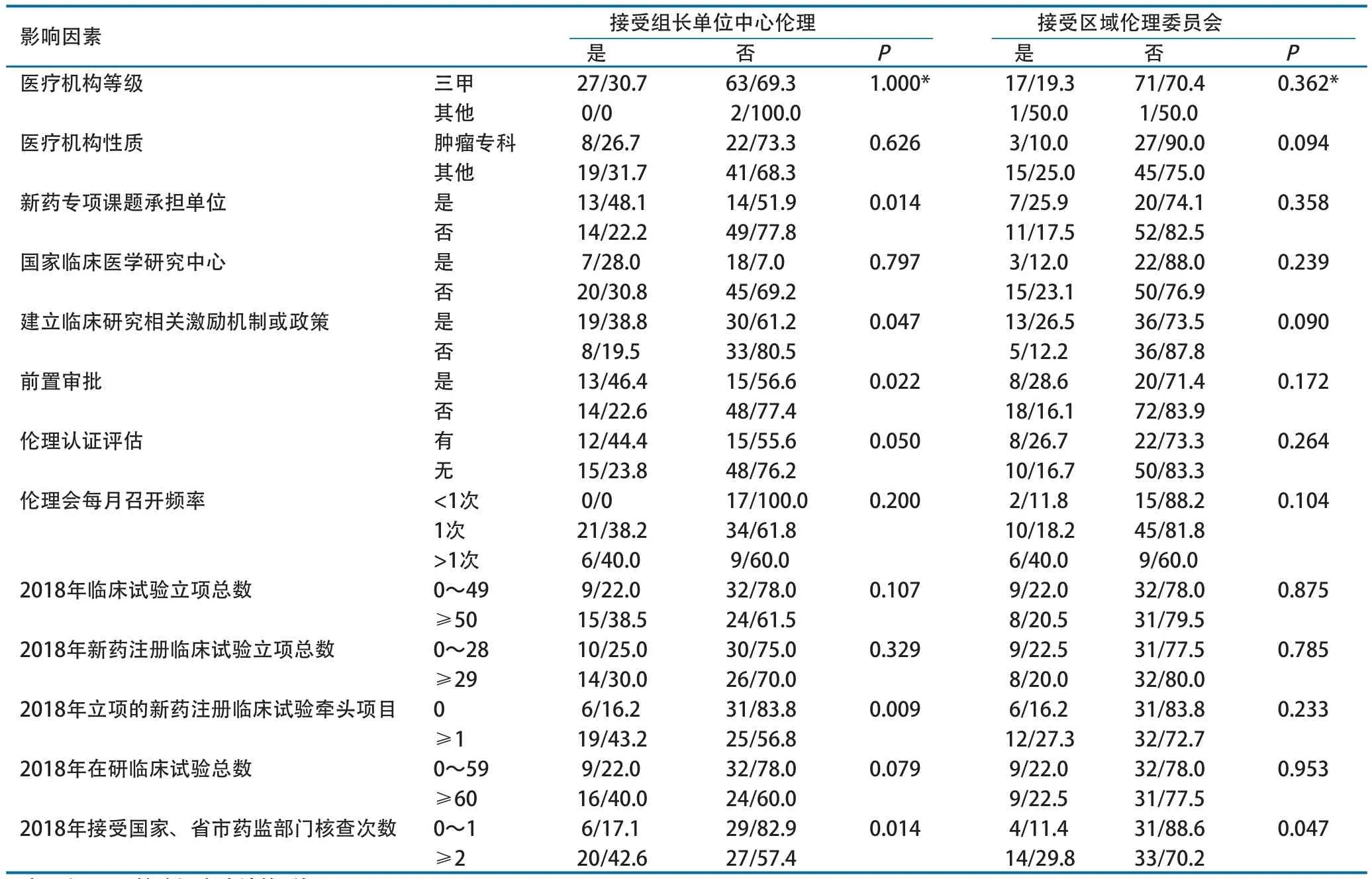
表2 中心伦理制度实施影响因素的相关性分析(n/%)
3 讨论
本次调查显示,中心伦理制度能够显著提升伦理审查效率,并且在国内部分医院已经率先实施,以新药专项课题承担单位为代表的高等级研究单位接受组长单位中心伦理比例更高。现阶段需要进一步加强中国整体临床研究和伦理审查能力建设,在更大范围内将中心伦理模式落实到位。
3.1 中心伦理制度符合国际规范,提升伦理审查效率
多中心临床研究中心或区域伦理审查模式起源于欧美国家,在上述地区已经成为常规程序并实行多年。2006年美国食品和药品监督管理局(FDA)发布中心伦理委员会使用指南[9],鼓励通过使用中心化伦理审查提高效率。美国国立卫生研究院(NIH)则从2017年开始要求在美国开展的由NIH资助的多中心研究采用“单一伦理审查”制度[10-11]。除了此种独立的中心化审查模式外,责任分担和联合审查也是美国常用的多中心协作审查方式[7,12]。欧盟则以独立中心审查模式为主,多中心临床研究需要在每个欧盟成员国获得单一中心伦理意见,但保留研究中心不接受该意见的权利[13]。以瑞典为例,该国有1个中央伦理委员会和多个区域伦理委员会,多中心研究先在主要研究者所在地区的区域伦理委员会进行审查,通过后在全国均有效,中央伦理委员会主要处理对区域伦理意见的申诉和分歧[7]。
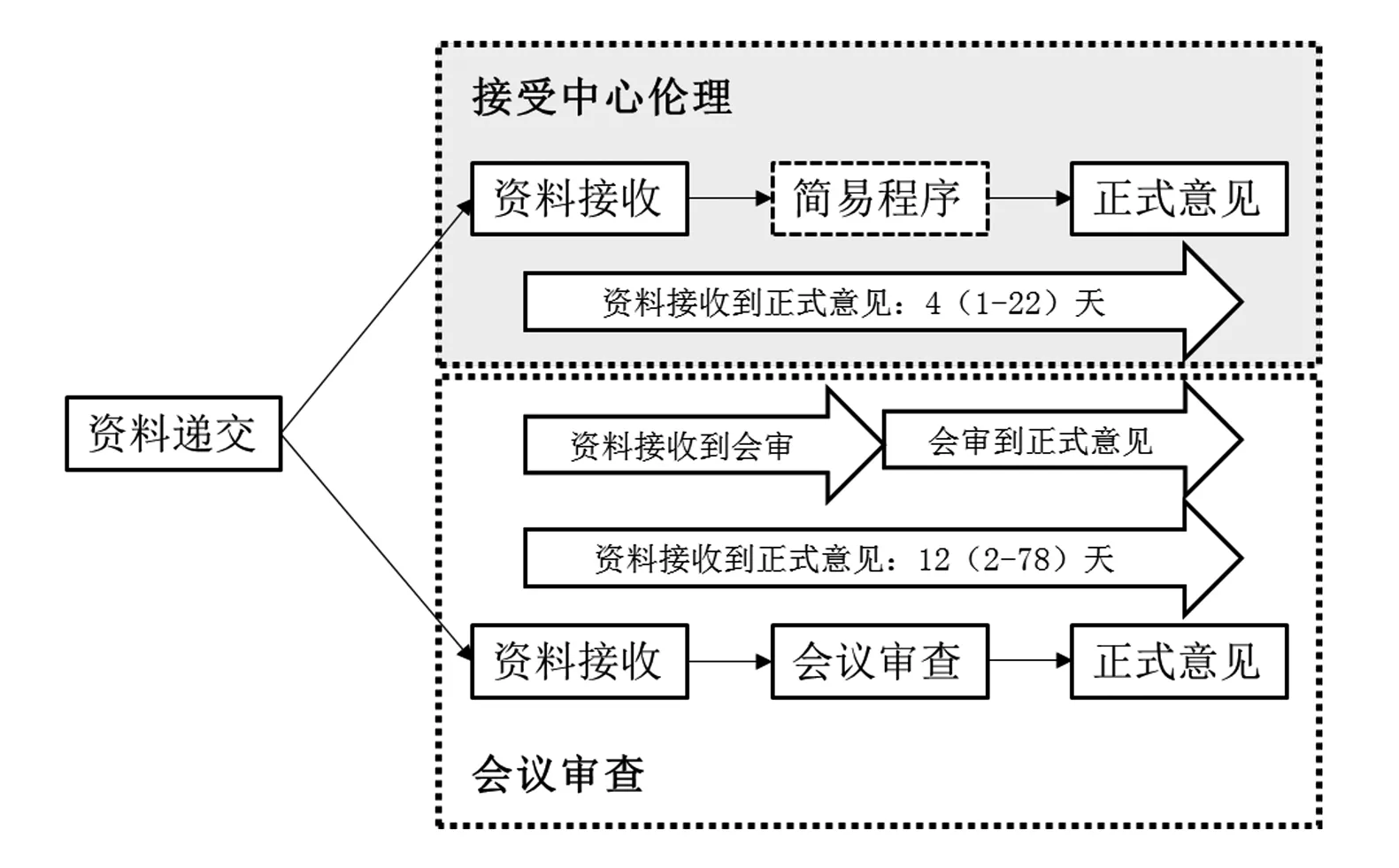
图1 中国医学科学院肿瘤医院伦理委员会接受中心伦理和会议审查程序比较
在实际审查效率方面,中国医学科学院肿瘤医院伦理审查数据已经体现了接受中心伦理程序较一般会议审查的优越性。美国REGAIN研究的多中心伦理审查过程则从项目层面说明了中心伦理制度的时间优势:部分参研中心也采用了接受中心伦理模式,通过简易程序进行审查,不修改研究方案但允许知情同意书做本地化处理;这些中心从伦理申请正式受理到批准的中位时间为27天,较采取常规审查的研究中心缩短了39天[14]。
3.2 对医院落实中心伦理制度的建议
中心伦理制度在我国的实施符合国际规范,也能够显著提高伦理审查效率,但本研究显示我国医院落实中心伦理制度的比例仍然不高,需要分析原因,探索改进措施。欧美国家推行独立中心伦理审查制度的重要社会因素是,部分参研机构没有伦理委员会,或伦理委员会不具备资质和审查能力;我国医疗机构大多设有监管部门备案的伦理委员会,直接对本院开展的项目负责,出于对于组长单位审查质量的担心、责任界定和管理衔接等问题[6,8,15],多年来一直采用重复审查模式。在这样的背景下,借鉴中国医学科学院肿瘤医院和REGAIN研究伦理审查[14]的经验,保留参加单位伦理委员会职能,明确对于组长单位或者区域伦理委员会审查意见的认可程序在我国可能是更具操作性的中心伦理落地方式[6,8]。保留参加单位伦理审查职能也有助于积累审查经验,提高审查能力。
本研究结果还表明以新药专项课题承担单位为代表的高等级研究单位能更早推行中心伦理制度。一方面是由于他们具有深厚的临床研究传统;另一方面《新药专项示范性药物临床评价技术平台建设课题工作要求》[3]明确了对组长单位伦理意见的认可程序,充分调动了承担单位高效开展临床研究的能动性,对落实新政起到巨大推动作用——因此对临床研究的重视程度和相关能力建设是医院优化管理程序的重要因素。现阶段我国临床研究单位的分布并不均衡[1],高等级研究单位集中于大城市,数量也有待提升。在我国医疗制度改革的纵深阶段,临床研究鼓励政策层出不穷,各地区各级医院均有开展临床研究的需求,如何挖掘新兴研究机构的潜力,全面而均衡地提升中国临床研究和伦理审查能力是监管部门和医院管理人员均需要考虑的关键问题
为解决这一问题,在国家卫生健康委员会和国家药品监督管理局的指导下,中国医院协会已开始积极构建“中国医院临床研究能力建设体系”[16],以期成为提高我国临床研究整体水平的重要举措。同时,中国医院协会发布《中国医院医学伦理审查建设宁波共识》[17],并在国家卫生健康委员会领导和指导下,与国家卫生健康委医学伦理专家委员会办公室组织制定了《涉及人的临床研究伦理审查委员会建设指南(2019版)》[18],旨在加强中国医院伦理委员会的能力建设,促进临床研究能力与伦理审查能力同步提升。
3.3 本研究的意义与不足
本研究在国内首次报告了2019年全国中心伦理制度的落实现状和实际审查效率,分析并提出全面落实中心伦理制度的潜在举措,但也存在一定局限性。首先,本次调查对象数量有限,没有覆盖所有地区的主要医疗机构,对中心伦理审查时间的调查也仅限于单中心,尚不足以充分展示我国伦理审查模式全景;针对伦理委员会的问题设置相对简单,未能深入挖掘伦理审查的具体程序要点,以及未能接受中心伦理的具体原因。
4 结语
推行中心伦理制度、提升审查效率和质量,不仅符合国家政策和国际潮流,更是迎合中国医药研发领域高速发展和广大患者临床需求的必然趋势,应当在监管部门和医疗机构的齐心协力下,通过优化方案尽快落实。

