高通量测序分析不同腌腊肉制品细菌多样性
赵 睿,邵长春,高世功,刘光瑞,杨富民,
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.兰州市食品药品检验所,甘肃 兰州 730030;3.中农威特生物科技股份有限公司,甘肃 兰州 730046)
腌腊肉制品属非即食肉制品,包括火腿、腊肉、咸肉、腊肠、酱鸭等。腌腊肉的品质和风味与地域微生物区系、加工方式(烟熏、腌制)密切相关。其中湖南产腊肉是典型的烟熏腊肉制品,川渝腊肉在腌制过程中通常加入较多的调味料然后经过烘烤、烟熏加工制作,陇西腊肉属于甘肃的传统名吃,陇西腊肉的加工过程主要是腌制56 d左右,风干暴晒20 d左右,而咸肉一般是单纯用盐腌制的肉制品。腊肉的保存期较咸肉长,有特殊的香味。研究不同产品微生物群落结构,对改善其品质、防止亚硝酸盐超标、延长货架寿命等有极其重要的意义。陈美春等[1]对四川腊肉微生物进行了研究,发现四川腊肉的主要优势菌为乳酸菌和葡萄球菌。全拓等[2]对渝腊肉货架期的微生物变化分析发现,优势菌主要为葡萄球菌和微球菌,其次是乳酸菌,假单胞菌和肠杆菌数量则较少。陈竞适等[3]对湘西陈年腊肉微生物群落研究表明,优势菌株主要为酵母菌、霉菌、微球菌、霉菌,这可能是湖南腊肉风味的重要组成因素。董蕴等[4]对湖北恩施传统腊肉的细菌多样性研究发现,主要为葡萄球菌属、嗜冷杆菌属和假交替单胞菌属。但目前对市场上消费量大的腊肉产品微生物群落结构进行比较分析则报道甚少。
高通量测序可快速准确全面地反映不同样品中微生物群落的组成,可鉴定一些低丰度及不可培养的微生物,16S rDNA扩增子测序技术已成为研究多种样本中微生物群落组成结构的重要手段[5-9],但是高通量测序的方法无法对当前腊肉中主要存活微生物的状况做出正确判断。采用传统分离培养与高通量测序技术相结合的方法,可进一步全面准确地鉴定微生物群落,本研究旨在对产自不同地区及不同加工方式的腌腊肉其微生物群落结构之间的共性及差异性进行研究,掌握不同腌腊肉制品细菌多样性,为其生产及品质控制等提供依据。
1 材料与方法
1.1 材料与试剂
依据市场占有率,选取销量大的3 类腌腊肉制品(烟熏腊肉、非烟熏腊肉、咸肉)13 个样品,分别为川渝烟熏腊肉(LR1、LR2、LR3、LR4)(group1)、湖南烟熏腊肉(LR5、LR6、LR7)(group2)、非烟熏甘肃陇西腊肉(LR8、LR9、LR10)(group3)、浙江咸肉(LR11、LR12、LR13)(group4),样品为生产企业市售产品,生产日期相差不超过10 d,均为真空包装。
PCA、VRBGA、MRS、BP培养基购自北京陆桥技术股份有限公司。
1.2 仪器与设备
2550 紫外分光光度计 日本岛津仪器有限公司;S210型pH计 梅特勒-托利多集团;DHG-9410A电热鼓风恒温干燥箱 上海一恒科学仪器有限公司;SWCJ-1CU超净工作台 苏净安泰科技有限公司;YXQSG46-280SA蒸汽压力灭菌锅 美国致微公司;Phred qualityYQX-II型厌氧培养箱 上海新苗医疗器械制造有限公司;HBM-400B型均质机 天津市恒奥科技发展有限公司;BS224S电子天平 北京赛多利斯仪器系统有限公司;5417R冷冻离心机 德国Eppendorf公司;MicroflexTM基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS) 德国Bruker公司。
1.3 方法
1.3.1 理化指标测定
pH值:依据GB 5009.237—2016《食品中pH的测定》测定;水分:依据GB 5009.237—2016《食品中水分的测定》中的直接干燥法进行测定;食盐:依据GB/T 12457—2008《食品中氯化钠的测定》中的间接滴定法。以上同一样品平行测定3 次。
1.3.2 高通量测序分析
1.3.2.1 样本微生物总DNA提取
微生物DNA提取采用CTAB方法,取同批次样品3 份混合,取2 份同时进行测定,称取混合后样品1 份180~220 mg于2 mL离心管中,吸取1 000 μL CTAB裂解液至2.0 mL EP管里,加入20 μL溶菌酶,将适量的样品加入裂解液中,65 ℃水浴(时间为2~3 h),期间颠倒混匀数次,以使样品充分裂解,离心取950 μL上清液,加入与上清液等体积的酚(pH 8.0)-氯仿-异戊醇(25∶24∶1,V/V),颠倒混匀,12 000 r/min离心10 min。取上清液,加入等体积的氯仿-异戊醇(24∶1,V/V),颠倒混匀,12 000 r/min离心10 min。吸取上清液至1.5 mL离心管,加入上清液3/4体积的异丙醇,上下摇晃,-20 ℃沉淀。12 000 r/min离心10 min,倒出液体。用1 mL 75%乙醇溶液洗涤2 次,剩余的少量液体可再次离心收集,然后用枪头吸出。室温晾干,加入51 μL ddH2O溶解DNA样品,加RNase A 1 μL消化RNA,37 ℃放置15 min。之后用1%琼脂糖凝胶电泳检测DNA的浓度和纯度。
1.3.2.2 16S rDNA扩增及Illumina NovaSeq测序
以提取的基因组DNA为模板,通过引物341F(5’-CCTAYGGGRBGCASCAG-3’)、806R(5’-GGACTACNNGGGTATCTAAT-3’)扩增16S rDNA V3-V4,PCR扩增循环条件:95 ℃预变性3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s;72 ℃终延伸5 min,扩增40 个循环。扩增结束后,扩增产物用1%琼脂糖凝胶电泳进行检测,对于符合条件的PCR产物进行纯化回收,回收产物的文库构建采用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒,利用Illumina NovaSeq测序平台进行上机测序。
1.3.2.3 高通量测序数据分析
根据Barcode序列和PCR扩增引物序列拆分各样本数据,截去Barcode和引物序列,FLASH(V1.2.7)[10]拼接获得的高质量Tags数据,利用Uparse[11](Uparse v7.0.1001)软件对所有样本的全部Effective Tags进行聚类,默认97%的一致性,选取OTU的代表性序列,用Mothur方法与SILVA132[12]的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1)。采用Qiime软件[11](Version 1.9.1)进行α多样性分析,并对不同样品检测结果进行韦恩图绘制,使用R软件(Version 2.15.3)绘制稀释曲线、Rank abundance曲线,用R软件进行α多样性指数组间差异分析。根据物种注释,统计每个样品在门(相对丰度<0.1%及unidentified归入others)、属(相对丰度<5%及unidentified归入others)分类水平上的序列数目。热图使用R语言绘制。
1.3.3 传统分离培养
1.3.3.1 微生物培养分离
取同批次样品3 份,搅碎混匀,称取混匀后的样品2 份各25 g同时进行测定,置于盛有225 mL生理盐水的无菌均质袋中,用拍击式均质器8 000 r/min均质5 min,制成1∶10的样品匀液,后进行10 倍倍比稀释,并取0.1 mL涂布于制备好的PCA、VRBGA、MRS、BP(加入5%亚碲酸钾卵黄增菌液)培养基上,在不同培养培养基上的主要培养条件如下:PCA培养基30 ℃培养48 h,MRS培养基放入厌氧袋中(海博)30 ℃厌氧培养48 h,BP培养基放入37 ℃培养48 h。选取菌落数在30~300 CFU之间的PCA平板、菌落数在15~150 CFU之间的其他平板,随机挑取10 个菌落,纯化2 次后,用于后续鉴定分析。
1.3.3.2 MALDI-TOF MS鉴定
鉴定菌落样本采用MALDI-TOF MS仪,样品制备采用扩展直接转移法,使用接种环挑取单个菌落,直接涂抹到MALDI靶板上,形成薄层,将1 μL 70%甲酸溶液滴加覆盖在每个样本上,室温晾干,将1 μLα-氰基-4-羟基肉桂酸仔细滴加覆盖在每个样本,室温晾干,后进行上机测试。数据图谱用FlexControl 3.4采集,结果用Biotyper 3.0 database处理分析。得分不低于2.0表明鉴定结果在种水平上可靠,得分1.7~2.0在属水平上可靠。
2 结果与分析
2.1 不同腌腊肉制品理化指标测定结果

表1 不同腌腊肉制品理化指标Table 1 Physicochemical properties of different styles of traditional Chinese bacon
由表1可知,腌腊肉样品中川渝腊肉的水分含量最高,与其他组别相比差异显著,湖南烟熏腊肉及陇西非烟熏腊肉水分差异不显著,浙江咸肉中水分含量最低,不同地区腌腊肉样品的pH值结果差异不显著,浙江咸肉及陇西腊肉中NaCl含 量高,与其他组相比差异显著。
2.2 分离培养结果
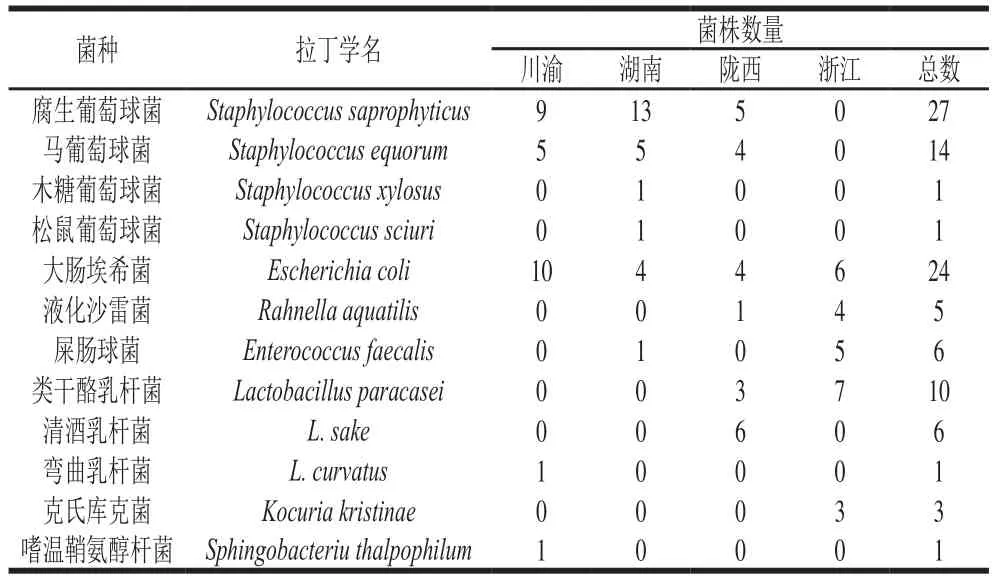
表2 腌腊肉样品可培养细菌分布情况Table 2 Distribution of culturable bacteria in traditional Chinese bacons
MALDI-TOF MS可鉴定至种属水平的分离结果见表2。13 种销售的腌腊肉商品中共分离得到了99 株菌株,位居前3的是腐生葡萄球菌株占27.3%,大肠埃希菌株占24.2%,马葡萄球菌株占14.1%,其余依次为类干酪乳杆菌、清酒乳杆菌、屎肠球菌。对不同地区样品微生物分离株总数及不同菌种占比进行分析,川渝烟熏腊肉共分离到26 株菌,其中大肠埃希菌及腐生葡萄球菌占比最高为38.5%和34.6%。湖南腊肉分离得到24 株菌,腐生葡萄球菌占比最高为54.1%,陇西腊肉中共分离到23 株菌,葡萄球菌属及乳杆菌属均为9 株。浙江咸肉中共分离到25 株菌,其中未分离到葡萄球菌属细菌,分离到类干酪乳杆菌、大肠埃希菌、屎肠球菌、液化沙雷菌、克氏库克菌分别为7、6、5、4、3 株,与其他地区分离菌株种类数量差异较大。表明不同产地烟熏及不同种类的腌腊肉其菌株类型、数量之间存在明显差异。腊肉腌制过程因虽然加入了一定的盐分,但葡萄球菌由于具有较高的耐盐特性,得以大量生长繁殖。此外,腌腊肉样品中还分布有少量的机会致病菌,如克氏库克菌属细菌。
2.3 高通量测序数据统计与质量分析
13 份样品共产生751 737 条有效序列,平均长度约为419 bp,由稀释曲线(图1A)可见,测序序列数大于30 000时,曲线上升缓慢,表明测序数据量继续加大,新增OTU数空间有限。等级聚类曲线(图1B)表明,样品微生物丰度和均匀度存在显著差异,其中川渝烟熏腊肉LR1、LR2、LR3、LR4样品曲线较陡峭、水平跨度小,微生物丰度、均匀度低。
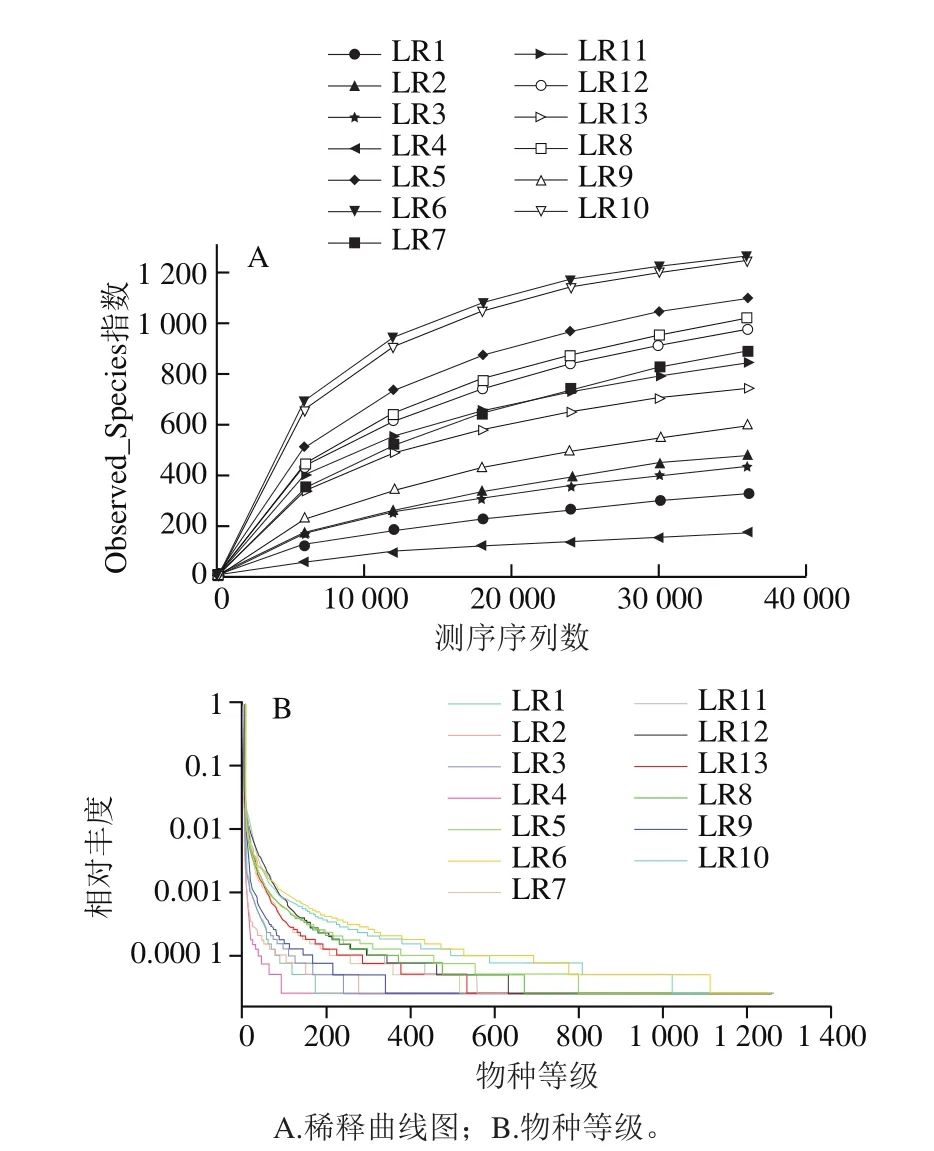
图1 16S rDNA高通量测序样本的多样性曲线Fig.1 Microbial diversity curves of the tested samples based on highthroughput sequencing of the 16S rDNA gene
2.4 样品OTU统计分析
按照97%相似度对所有序列进行聚类分析,共获得3 105 个OTU,涵盖37 个门,665 个属,468 个种。由图2可知,川渝烟熏腊肉的4 个样品(LR1、LR2、LR3、LR4)的OTU数最少,在239~630之间,而同样为烟熏腊肉的湖南地区样品OTU数量却较高,OTU数在1 139~1 392之间,其原因可能是地域微生物差异所致。甘肃陇西腊肉样品OTU数在758~1 352之间,浙江地区咸肉样品OTU数在711~978之间,可见非烟熏、咸肉与烟熏腌腊肉制品在微生物群落组成上存在较大差异。
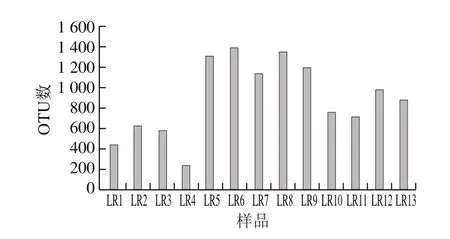
图2 不同样品OTU数与分布图Fig.2 Distribution of OTUs number in different samples
韦恩图展示了不同组别微生物群落的相似性及差异性,由图3可见,川渝烟熏腊肉、湖南烟熏腊肉、甘肃陇西腊肉、浙江咸肉样品OTU总数分别为934、1 795、1 486、1 526 个,其中独有的OTU数分别为98、517、314、717 个。浙江咸肉独有的OTU数占所有OTU的46.99%,占比最高,表明咸肉与腊肉相比在微生物区系上存在明显不同。
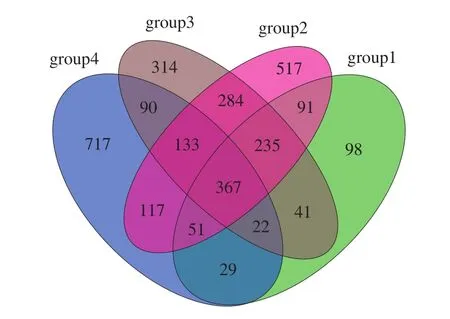
图3 不同组样品共有和独有OTU韦恩图Fig.3 Venn diagram of unique and shared OTUs of the bacterial communities in different samples
2.5 α多样性指数分析
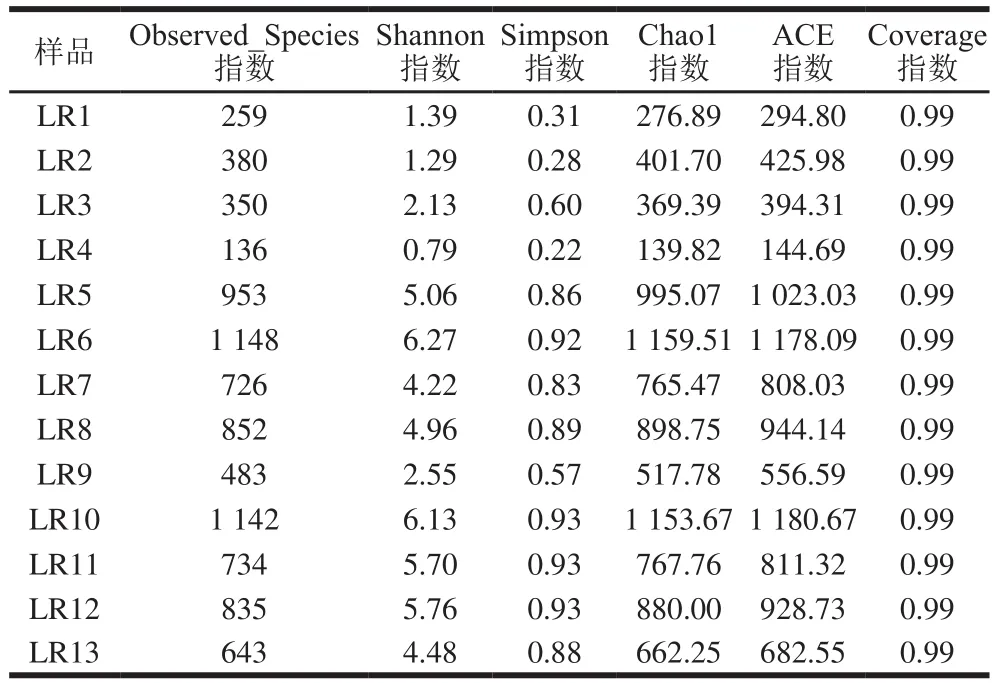
表3 腌腊肉样品中细菌α多样性Table 3 Diversity indexes of bacterial communities in traditional Chinese bacon samples
对不同样本在97%一致性阈值下的α多样性[14]指数进行统计,结果见表3。所有样本的Coverage指数均大于0.99,说明测序结果可信。但川渝烟熏腊肉Simpson指数和Chao1指数均较低,其菌落丰度及多样性水平相对较差。
2.6 门水平菌群结构
图4为各样品丰度最高的前10柱形图。优势物种分别为厚壁菌门(Firmicutes)平均占比64.19%、变形菌门(Proteobacteria)平均占比24.89%、放线菌门(Actinobacteria)平均占比4.02%,其余为拟杆菌门、酸杆菌门、蓝藻细菌门、绿弯菌门、芽单胞菌门、梭杆菌门以及其他未知分类(unclassified)以及未知细菌菌门(unidentified_Bacteria)。虽然主要优势菌门基本相同,但是相对丰度差异较大。川渝烟熏腊肉LR1、LR2、LR3、LR4样品厚壁菌门占比达95.24%~99.20%,是绝对优势菌门;湖南烟熏腊肉LR5、LR6、LR7分别为64.18%、52.42%、71.14%,说明不同地区烟熏腊肉的微生物组成存在差异。咸肉样品及未烟熏腊肉样品主要为2~3菌门占优势,占比相对较均衡,与烟熏腊肉相比微生物种类更为丰富。

图4 门水平的不同腊肉样品相对物种分布相对丰度Fig.4 Distribution of microbial communities in different traditional Chinese bacon samples at the phylum level
2.7 属水平菌群结构
在属的水平上统计(图5)显示,不同腊肉样品中位于前10 位的菌属有葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)、嗜冷杆菌属(Psychrobacter)、棒状杆菌属(unidentified_Corynebacteriaceae)、链球菌属(Streptococcus)、弧菌属(Vibrio)、环丝菌属(Brochothrix)、稳杆菌属(Empedobacter)。
由图5可知,川渝产烟熏腊肉样品(LR1、LR2、LR3、LR4)菌相较为单一,葡萄球菌属比例达到87.33%~97.35%;而湖南产烟熏腊肉样品的菌落组成较为丰富,3 份腊肉样品优势菌属组成和比例均不相同,其中LR5的优势菌属为乳球杆菌占比35.84%,LR6为葡萄球菌属占比29.90%,LR7样品优势菌属为乳杆菌属占比37.37%,说明不同腊肉样品的微生物群落组成存在差异。未烟熏腊肉样品LR8的优势菌属为嗜冷杆菌属占比28.46%,其次为乳杆菌属占比25.43%;LR9样品优势菌属为葡萄球菌属占比83.96%;LR10样品优势菌属为不动杆菌属占比22.50%,其次为嗜冷杆菌属占比16.08%;未烟熏腊肉微生物群落结构之间的差异可能是由于配料、加工方法、环境不同。由图5可见,咸肉样品的微生物菌落结构较为丰富和相似,但与腊肉相比微生物群落结构差异较大。咸肉样品LR11占比高的3 个菌属为不动杆菌属(24.46%)、乳杆菌属(18.39%)、葡萄球菌属(4.93%),LR12为不动杆菌属(32.51%)、葡萄球菌属(11.20%)、乳球菌属(10.46%),LR13为葡萄球菌(36.81%)、不动杆菌属(13.48%)、棒状杆菌属(13.48%)。葡萄球菌属在所有腊肉样品中均存在,但比例不同。腌腊肉中葡萄球菌属的大量存在,可能是由于葡萄球菌对于高盐以及其他复杂环境具有较好的耐受力。此外,葡萄球菌属也是腊肉特殊香味产生的来源之一[7,15]。乳酸菌同样在每个腊肉样品中检出,乳酸菌在肉制品发酵过程中起着非常关键的作用,可将碳水化合物转化为乳酸,降低腊肉pH值,改善腊肉品质,延长保质期[16]。
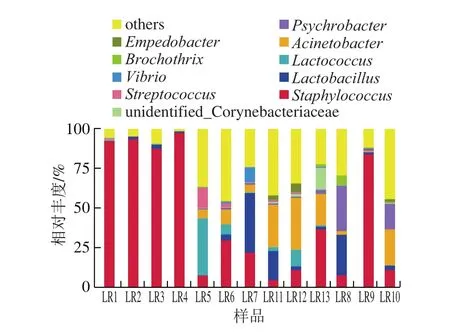
图5 属水平的不同腊肉样品相对物种分布相对丰度Fig.5 Distribution of microbial communities in traditional Chinese bacon samples at the genus level
2.8 基于属水平不同样品比较热图分析
在属分类水平上,取排名前25的属得到物种分类聚类热图,通过热图板块颜色深浅判断不同样品及不同分组样品之间微生物组成的差异,图6A显示,4 个不同分组样品在属水平的微生物群落结构差异较大,每个组别的微生物群落组成及优势菌属均不相同。图6B表明,川渝烟熏腊肉4 个样品菌落结构中除LR3存在高占比魏斯氏菌属(Weissella)外,其余均为葡萄球菌属为主要优势菌属。湖南烟熏腊肉、陇西非烟熏腊肉、浙江咸肉样品菌落结构较为丰富,存在多个优势菌群,每个组内的样品虽然菌落结构较为相似,但其含量不同,组内各个样品间存在一定差异,表明地域环境、原材料、加工方式不同,腌腊肉制品中微生物群落结构存在多样化。

图6 不同腌腊肉样品属水平分布热图Fig.6 Heatmaps of genus-level distribution of bacterial communities in different traditional Chinese bacon samples
3 讨 论
腌腊肉是中国传统发酵肉制品,历史悠久、地方特色突出。不同地域因环境、气候、饮食习惯及喜好不同,形成了各具特色的腌腊肉制品。不同种类的腌腊肉又因原料、加工方式不同,其品质、风味不同。影响腌腊肉制品品质的因素很多,但微生物菌群组成是其重要因素之一,菌落结构不但影响理化特性、风味,而且影响其货架寿命,关乎食品安全[2,4,17]。
本研究基于16S rDNA基因高通量测序技术及传统分离培养的方法,研究不同地区、不同加工方式腌腊肉制品的微生物菌落多样性情况,根据高通量测序结果对13 份腌腊肉进行菌相分析,结果表明不同地区烟熏腊肉样品、未经烟熏腊肉样品、咸肉样品微生物菌落结构各有差异。川渝烟熏腊肉样品的优势菌群主要是葡萄球菌属,湖南烟熏腊肉样品微生物结构更为丰富,乳杆菌属、乳球菌属、葡萄球菌属在不同样品中占比不同,这与前期其他研究学者对于腊肉样品微生物群落研究结果基本一致[18-20],葡萄球菌属及乳杆菌属由于较高的耐盐性因此在不同种类腌腊肉样品中都有不同比例的存在。其中乳酸菌能够抵抗加工肉制品中烟熏和亚硝酸盐的抑菌作用,能耐受较高浓度的盐,因此在发酵肉中广泛存在。此外,这两种菌也是腌腊肉制品特殊香气产生的重要微生物[21-23]。非烟熏的甘肃陇西腊肉样品微生物结构基本相同,但组成比例具有较大差异,嗜冷杆菌属(Psychrophilus)、不动杆菌属、葡萄球菌属在不同样品中分别占据优势菌属,王海燕等[24]在对湖南腊肉发酵过程中的细菌群落研究发现,烟熏对微生物结构会有较大的影响,所以非烟熏样品与烟熏样品的微生物结构存在差异。陇西腊肉未烟熏,腌制过程较长需要56 d,并且晒20 d,加工方式差异可能是导致其群落结构不同的原因。在烟熏、非烟熏腊肉样品中都含有较高比例乳酸菌,主要原因可乳酸菌在发酵过程中还会产生一些抑菌物质,包括乳杆菌素、乳链球菌肽等也会抑制其他微生物的生长。不同腌腊肉制品中的微生物菌落结构还与初始原料中微生物的污染程度及加工中的环境卫生状况相关。
咸肉样品中均存在不动杆菌属,且占比较高在13.48%~32.51%之间。不动杆菌属是生鲜肉制品中常见的微生物菌属之一[25-27],分析原因可能是咸肉的加工方式由于加工步骤较少,仅为盐渍腌而缺少晾晒,所以与新鲜肉中的微生物菌落结构更为接近。腌制、熏制等加工过程会使得导致原料肉腐败的革兰氏阴性细菌大大减少,而只剩下一些能适应这种特殊腌制环境的革兰氏阳性菌得以生长,因此腌制、熏制过程抑制了多数微生物的生长从而使得腌腊肉的产品保质期更为长久。在陇西腊肉中分离了共6 株清酒乳杆菌,清酒乳杆菌能耐受高盐及较低的温度,同时是腌腊肉制品特殊风味的来源,但是大量乳酸菌存在时会导致产品的腐败,乳酸菌含量在多大范围会增加风味或引起腐败还需要进一步研究[28]。
研究中还发现一些菌属特定存在于某些样品中,如弧菌属在LR7样品中占比较高,棒状杆菌在LR13样品中占比较高,而这两种菌属属于可能会产生致病性的菌属[29-30],嗜冷杆菌属在未烟熏LR8、LR10中占比较高,嗜冷杆菌是典型的耐寒性好氧菌,可产生脂肪水解酶,导致油脂水解,使产生腥臭味和霉味[31-32]。
4 结 论
研究采用高通量测序与传统分离鉴定相结合,传统分离培养获得了99 株可培养微生物,高通量测序获得了751 737 条有效序列数,12 122 个操作分类单元,更好地揭示了不同腌腊肉制品微生物群落的多样性。由于类别不同烟熏腊肉、未烟熏腊肉、咸肉微生物菌落结构存在明显的差异,其中烟熏腊肉样品葡萄球菌属占优势,非烟熏腊肉嗜冷杆菌属、不动杆菌属、葡萄球菌属占据优势菌属,咸肉中不动杆菌属则为占比高的优势菌属。因地域及加工方法不同川渝烟熏腊肉样品葡萄球菌属占绝对优势,而湖南产烟熏腊样品除葡萄球菌属外,优势菌属还有乳酸菌属和乳球菌属。所检测到的弧菌属、棒状杆菌、嗜冷杆菌等机会致病菌,在生产中应引起重视。
——家的味道

