蜂花粉微生物污染及菌群结构分析
唐 标,罗 怡,李 锐,周秀楠,张 玲,,钱鸣蓉,戴贤君,夏效东,杨 华,
(1.浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;3.中国计量大学生命科学学院,浙江 杭州 310018)
蜂花粉是蜜蜂从植物中采集花蜜后加入自身腺上分泌物和唾液后制成的呈扁圆形的团状物,是蜜蜂蜂群主要的蛋白质来源[1]。蜂花粉具有很高的营养价值,包含蛋白质、氨基酸、碳水化合物、维生素、脂类以及酶、辅酶、激素、黄酮、多肽、微量元素等多种生物活性物质,被誉为“微型营养库”[2-3]。蜂花粉中多酚类和黄酮类物质广泛存在,被认为是有效的抗氧化剂[4-7]。蜂花粉具有抗动脉粥样硬化活性[8]和抗菌活性[9-10],对心脏病、高血压、高血脂、高血糖等心脑血管疾病具有很好的预防和改善作用,可调节人体免疫能力和神经系统。因此蜂花粉作为天然营养保健品,其生物活性相关研究一直受到国内外研究学者关注,也是蜂花粉产品开发与应用的重要因素[11-13]。
蜂花粉的营养物质丰富,但在加工生产过程中,存在粗放加工现象,可能造成蜂花粉产品受到微生物二次污染,进而导致蜂花粉产品质量的下降,甚至危害消费者健康。此外,作为蜜蜂的重要营养来源,蜂花粉中大量微生物的存在会危害蜜蜂的生长繁殖,可能影响蜂群的生产能力,降低蜂产品的质量,危害蜂农的利益[14]。
蜂花粉产品的生产量及销售量日益增长,但关于蜂花粉产品产业链微生物污染状况的相关报道仍较少[15-17]。本研究收集了浙江省主要蜂花粉产区的代表性蜂花粉产品,参考国家标准对蜂花粉产品中细菌和真菌菌落总数进行检测,并使用16S rDNA和ITS扩增子测序技术对茶花粉和荷花粉的细菌菌群结构及真菌菌群结构进行分析讨论。本研究旨在较为准确地评估蜂花粉产品的微生物污染状况,提升蜂花粉产品的质量安全水平。
1 材料与方法
1.1 材料与培养基
在浙江省龙游、长兴、兰溪、江山、武义、宁波等市县共采集107 个蜂花粉样品,养蜂场购买59 份,其中17 份为现场新鲜采集;市场购买50 瓶。蜂花粉类型包括油菜花粉(44 份)、茶花粉(31 份)、荷花粉(11 份)、杂花粉(7 份)、伍倍子花粉(4 份)、荞麦粉(3 份)、野玫瑰花粉(3 份)、益母草粉(3 份)、葵花粉(1 份)。
平板计数琼脂(plate count agar,PCA)培养基、孟加拉红琼脂培养基 北京陆桥技术股份有限公司。
1.2 仪器与设备
Gel Doc凝胶成像系统 伯乐生命医学产品(上海)有限公司;MP FastPrep-24组织研磨仪 美国MP生物医疗公司;电热鼓风干燥箱 上海精宏实验设备有限公司;5424R微量高速离心机 艾本德中国有限公司;Nanodrop ONE核酸定量仪 赛默飞世尔科技中国有限公司;SW-CJ-ICU超净工作台 苏州安泰空气技术有限公司。
1.3 方法
1.3.1 细菌分离
称取5 g蜂花粉样品分别按GB 4789.2—2016《食品微生物学检验 菌落总数测定》和GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》进行菌落总数、霉菌酵母总数的测定。
1.3.2 含水量检测
称取2~5 g蜂花粉样品,按照GB 5009.3—2016《食品中水分的测定》中干燥法对水分含量进行检测。
1.3.3 16 S rDNA及ITS扩增子测序
DNA抽提使用试剂盒PowerSoil DNA Isolation Kit方法进行抽提,浓度使用Nanodrop进行定量,同时通过凝胶电泳检测。细菌的16S rDNA扩增子测序使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rDNA的V3-V4区进行扩增测序。真菌的ITS扩增子测序选用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)引物进行扩增测序。扩增子测序委托上海美吉生物医药科技有限公司使用Illumina MiSeq平台,PE reads的质控、OTU聚类分析、α多样性和β多样性等分析使用I-Sanger云平台(https://www.i-sanger.com/)。
1.4 统计学分析
本实验涉及的统计分析和相关图形绘制使用GraphPad Prism软件。
2 结果与分析
2.1 蜂花粉的含水量

图1 107 份蜂花粉的水分含量Fig.1 Water contents of 107 bee pollen samples
如图1所示,107 份蜂花粉总体的含水量在8.06%~32.92%之间。17 份在蜂场当天收集的新鲜蜂花粉的含水量较高,在18.92%~32.92%之间,42 份经过1~2 d晾晒后的蜂花粉含水量分布为8.06%~15.87%。在市场上流通的蜂花粉含水量主要集中在9.42%~16.86%之间。
2.2 微生物污染分析

图2 蜂花粉的细菌菌落总数与真菌菌落总数Fig.2 Bacterial and fungal colony counts of bee pollen
如图2所示,有8 个样品未培养出可见克隆,其中两个样品菌落总数在2.5×105CFU/g以上,其他样品在5×101~2.7×104CFU/g区间范围。霉菌总数只有2 个样品未培养出可见的克隆,其中两个样品的菌落总数在2.7×105CFU/g以上,其他样品在5×101~6.5×104CFU/g区间范围。从图2A可以看出,蜂花粉中的真菌菌落总数相比细菌菌落总数较大,并且差异有显著性。由于真菌可见培养的菌落绝大多数是霉菌,说明蜂花粉被污染霉菌的风险较细菌更高。
59 份在蜂场购买的蜂花粉(含水量高于18.92%的样品17 份与晾晒后的样品42 份)的菌落总数进行对比。结果显示,低含水量的蜂花粉无论是在细菌菌落总数(图2B)上还是真菌菌落总数(图2C)都高于高含水量的蜂花粉,差异具有显著性。高含水量(>18%)的蜂花粉较新鲜,直接从蜂箱外采集,可以基本排除后期加工贮运的污染;低含水量(<17%)的蜂花粉通过晾晒、贮运等环节,增加了霉菌污染的风险。
2.3 细菌菌群结构分析
对零售市场上购买的商品化的7 份荷花粉和5 份茶花粉样品进行16S rDNA扩增子测序,其中1 份测序获得reads数明显偏低,数值没有加入分析。根据稀释曲线可知11 个样本获得的reads数量饱和(图3A),并进行了细菌菌群结构分析。聚类分析后,共获得663 个无冗余的分类单元(operational taxonomic unit,OTU),可确定具有明确分类地位的属208 个。从图3可以看出,茶花粉与荷花粉细菌菌群多样性结构无显著性差异。从科水平统计,蓝细菌和肠杆菌占比例最大。在属水平上,主要的细菌污染源为蓝细菌、肠杆菌科类细菌及乳杆菌,其中乳杆菌也广泛存在于蜜蜂的肠道中[18-19]。另外,可以发现茶花粉相比荷花粉,含有的莫拉氏菌科的细菌更丰富。该科的细菌有部分是条件致病菌,茶花粉中更丰富的原因可能是与茶花的生长环境相关,或者是采集茶花特殊的蜂群肠道中含有该类菌,在蜜蜂加工的过程中传播到蜂花粉中。

图3 荷花粉和茶花粉细菌菌群多样性分析Fig.3 Diversity analysis of bacterial communities in lotus and camellia bee pollens
2.4 真菌菌落组成分析
对以上同样的7 份茶花粉与5 份荷花粉抽提的DNA进行ITS扩增子测序,根据稀释曲线可知测序深度已经饱和(图4A)。聚类分析后共获得1 171 个无冗余OTU,可以明确分类地位的共有263 个属。根据α多样性分析可以发现真菌菌群多样性要高于细菌。同时,两类样品真菌菌群组成差异极显著,茶花粉的真菌多样性高于荷花粉(图4B)。
在属水平上,unclassified_f_Davidiellaceae(未确定分类地位的,归属于小戴卫霉科)、曲霉属(Aspergillus)、青霉菌属(Penicillium)、镰孢菌属(Fusarium)占比例较高(图4C)。曲霉属、青霉菌属、镰孢菌属是产生真菌毒素的常见菌[20]。曲霉属可产生黄曲霉毒素,以黄曲霉为代表,是产生黄曲霉毒素的主要菌种[21],同样在预测的OTU中发现了黄曲霉菌。另外,镰孢菌属可产生镰刀菌素和伏马毒素,青霉菌属可以产生橘霉素[20]。尽管预测到了该类菌,有产生毒素的风险,但是并不说明蜂花粉污染的霉菌能够产生毒素;即使产生微量毒素,也未必能够达到相应的检出限。
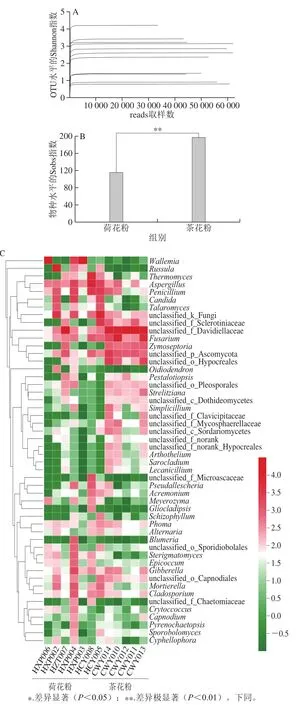
图4 荷花粉和茶花粉的真菌菌群多样性分析Fig.4 Diversity analysis of fungal communities in lotus and camellia bee pollens
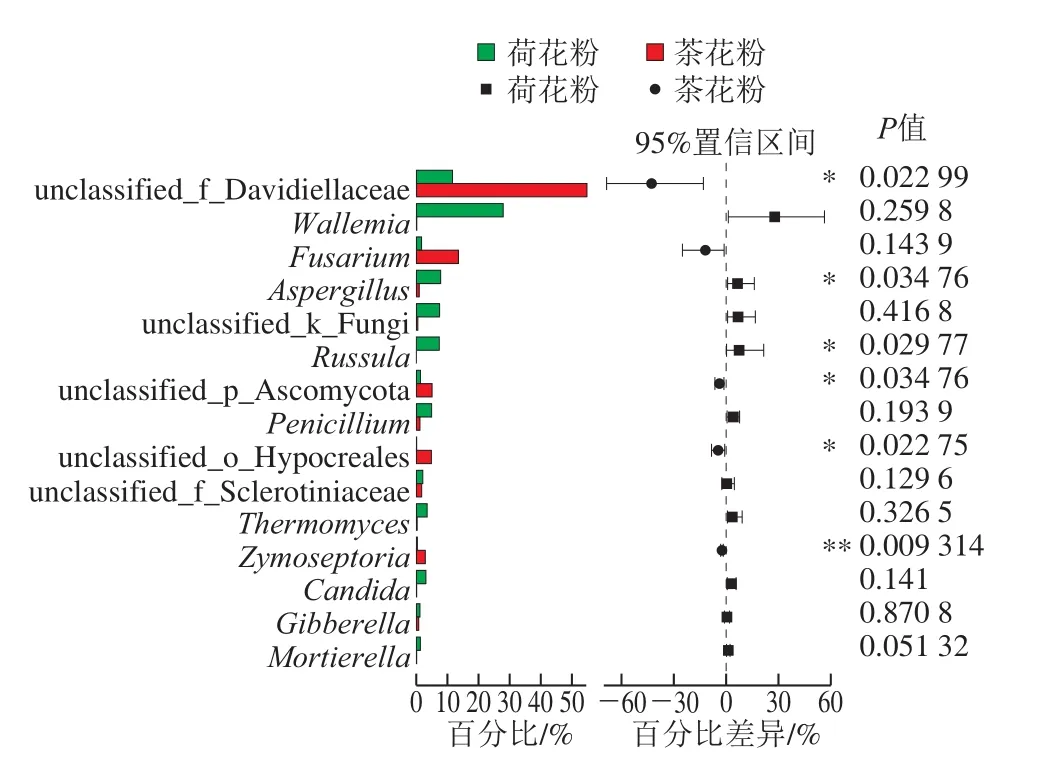
图5 荷花粉和茶花粉的真菌菌群在属水平上的Wilcoxon秩和检验Fig.5 Wilcoxon rank-sum test plots of fungal community structures of lotus and camellia bee pollens at the genus level
从图5可以看出,unclassified_f_Davidiellaceae、unclassified_p_Ascomycota、unclassified_o_Hypocreales、Zymoseptoria在茶花粉中相比在荷花粉中含量较高,差异具有显著性;其中Zymoseptoria含量在两者之间具有极显著差异,Zymoseptoria同时也是重要的植物致病菌[22-23]。Wallemia、Aspergillus、Russula在荷花粉中相比茶花粉含量高,差异具有显著性。从属水平主坐标分析(principal co-ordinates analysis,PCoA)看,这两种花粉的真菌菌群结构也可明显分成两个区域(图6)。这些真菌的菌群差异可能是花粉来自不同的植物,与植物本身的易感真菌、生长环境(空气、土壤、水)及后期加工运输过程的污染等因素相关。

图6 荷花粉和茶花粉的真菌菌群结构在属水平上的PCoAFig.6 PCoA plot of fungal community structures of lotus and camellia bee pollen at the genus level
3 讨 论
蜂花粉可以作为蜂粮,影响蜜蜂的肠道微生物[24-25]。蜜蜂对其利用会显著提高消化道细菌总数和特异性丰度,刺激对蜜蜂有毒的糖(木糖、阿拉伯糖、甘露糖)的水解,同时产生的糖苷水解酶与蜜蜂自身和花粉中存在的酶有协同作用[26]。同时蜂花粉作为保健品,关系到食品安全,直接影响人的健康。蜂花粉相比蜂蜜、蜂王浆等产品重视程度较低,蜂花粉的药物残留分析研究相对较多[27-29],但微生物污染研究极少报道。本实验对浙江省采集的蜂花粉从上游养蜂场到零售环节均有涉及,对可培养的微生物污染进行了分析,对茶花粉及荷花粉的细菌和真菌的菌群结构进行了研究,最后对于蜂花粉的污染概况具有了初步认识。
从研究结果看,蜂花粉的细菌污染水平小,菌群多样性水平低,没有发现常见的病原菌,例如沙门氏菌、克雷伯菌、金黄色葡萄球菌等;霉菌污染相对细菌严重,真菌菌群多样性相对细菌较高,同时发现可产生真菌毒素的真菌含量丰富,具有食品安全风险。通过对茶花粉与荷花粉细菌菌群结构分析,发现两者差异不显著,其中蓝细菌、肠杆菌科、乳杆菌含量高。据报道,乳酸菌同样是蜜蜂肠道的主要菌群之一[30-31]。
茶花粉与荷花粉的真菌菌群结构差异显著,unclassified_f_Davidiellaceae、unclassified_p_Ascomycota、unclassified_o_Hypocreales、Zymoseptoria在茶花粉中相比在荷花粉中含量高,差异显著;Wallemia、Aspergillus、Russula在荷花粉中相比茶花粉含量高,具有显著性差异。尽管预测了蜂花粉中存在产生真菌毒素的种属,具有真菌毒素感染的风险,但需要实验进一步验证是否能够检出相应的毒素,或者毒素含量达不到检出限。
蜂花粉的菌群多样性或结构较其他样品(如粪便、土壤、河流样品)简单[32-35]。已有研究报道,花粉的来源影响蜂房和蜜蜂幼虫的微生物组成[19,36-37]。蜂花粉中的微生物来源可能来源包括蜜蜂肠道菌[31]、植物花粉源微生物[38]、生长环境微生物[39]以及加工贮运环节污染的微生物,对于如何对含有的微生物溯源仍需进一步深入研究。蜂花粉类型较多,其微生物组成容易受到采集环境、贮运环节影响,单一的研究无法准确全面反映蜂花粉的污染。本实验侧重了蜂花粉中可培养微生物的菌落总数检测,并作了茶花粉和荷花粉的菌群分析与比较。
4 结 论
本实验从107 份蜂花粉中测定菌落总数和含水量,对荷花粉和茶花粉进行真菌与细菌菌群结构分析,发现新鲜的蜂花粉含水量高于18%,但是微生物污染水平较低。以荷花粉和茶花粉为研究对象,发现蜂花粉的细菌菌群中蓝细菌、肠杆菌科类细菌及乳杆菌较多,而真菌菌群Davidiellaceae、曲霉属(Aspergillus)、青霉菌属(Penicillium)和镰孢菌属(Fusarium)占比例较高。荷花粉与茶花粉的真菌菌群多样性差异显著。总体来看,蜂花粉真菌菌群多样性高,可以产真菌毒素的霉菌丰富,具有食品安全风险。本研究可为蜂花粉的安全评价提供依据。

