碱性溶液体系制备磷酸锂结晶过程优化
李丽君, 刘程琳, 宋兴福, 于建国
(华东理工大学国家盐湖资源综合利用工程技术研究中心,上海 200237)
我国是全球锂资源第一大消费国[1]。近年来,以家用锂离子电池、动力型锂离子电池和储能型锂离子电池为代表的锂电池市场规模迅猛扩张,使锂资源需求量急剧增加。随着未来锂离子电池的技术革新、新能源汽车的逐渐推广和电力储能技术的升级换代,锂资源的需求量还将持续保持上升势头,预计到2025 年我国锂资源需求量将达到4.3×105t。2017年我国锂资源对外依存度高达80%,在不考虑资源出口的情况下,仍有58%的锂资源需依赖进口,因此我国锂资源供应存在结构性风险[2]。针对我国锂资源禀赋现状,加速锂辉石矿绿色提取技术研究迫在眉睫。
作为锂离子电池正极材料,碳酸锂是锂产品中消耗量最大的一种锂盐,许多学者围绕锂矿石制备碳酸锂工艺开展了一系列研究工作[3-9]。但采用中低温碱浸低品位锂矿时产生的浸出液存在锂浓度低、杂质离子浓度高、碳酸锂结晶难等问题,制备溶解度低、价值高的磷酸锂能够实现锂资源的综合利用。磷酸锂具有优异的电化学和催化性能,不仅在众多领域有广泛的应用,如作为生产彩色荧光粉的理想原料[10]和环氧烷烃异构化反应[11]的专用催化剂,而且可用于制备正极材料磷酸亚铁锂[12],也可用于电池级碳酸锂的制备[13-14]。文献[11-12, 15]研究了LiOH·H2O 与NH4H2PO4、Na3PO4·12H2O 与H3PO4反应制备磷酸锂的方法,Kuang 等[16]研究了从锂云母提锂后的石膏渣浸取液制备磷酸锂的工艺,而有关锂辉石矿碱浸体系制备磷酸锂反应结晶过程的研究鲜有报道。
本文首先测定磷酸锂在碱性溶液体系中的溶解度,为磷酸锂反应结晶工艺研究提供基础热力学数据;然后以氢氧化锂和磷酸钠为主要原料,系统地研究了磷酸锂反应结晶过程中各工艺参数对磷酸锂收率和粒径的影响,着重考察K、Si、Al 这3 种常见杂质元素对磷酸锂产物尺寸和形貌的影响及其作用机理,以期制备收率高、粒度均匀且形貌一致的磷酸锂产物。
1 实验部分
1.1 实验试剂
主要试剂为磷酸锂(Li3PO4)、氢氧化钠(NaOH)、十二水磷酸钠(Na3PO4·12H2O)、一水氢氧化锂(LiOH·H2O),均为分析纯,购自国药集团化学试剂有限公司。
1.2 实验流程
1.2.1 溶解度测定 采用静态法(等温溶解法)测定不同质量分数NaOH 溶液下Li3PO4的溶解度。配制一系列不同质量分数的NaOH 溶液于聚四氟乙烯瓶中,待温度升至预设温度,分别加入3 g Li3PO4固体,在精密控温(±0.1 ℃)恒温振荡水浴槽中振荡至平衡,振荡速率设为150 r/min。振荡结束后,静置24 h 以确保平衡液相完全澄清。从上层清液取样,以分析Li3PO4、NaOH等各组分的含量;固液混合物过滤后得到固相,置于70 ℃烘箱中干燥,用于表征与分析。
1.2.2 反应结晶过程 磷酸钠沉淀法基本原理是LiOH 和Na3PO4反应生成Li3PO4沉淀,其主要化学方程式为:

实验装置如图1 所示。该装置由储料罐、蠕动泵、玻璃夹套三口反应器和恒温水浴4 个部分组成。配制一定浓度的LiOH 溶液加入反应器,搅拌,于恒温水浴槽中加热到一定温度。量取一定体积Na3PO4溶液,用蠕动泵将其以一定流速泵入反应器中;为保持体系恒温,Na3PO4溶液在进料前需预热至相同温度。进料完毕后保持体系温度恒定直至反应结束;采用真空抽滤方法进行固液分离,滤饼用去离子水和无水乙醇反复洗涤后于70 ℃烘箱内烘干12 h,用于后续表征与分析。

图 1 反应结晶装置Fig. 1 Reactive crystallizer
1.3 表征与分析方法
采用电感耦合等离子体光谱仪(ICP-OES,ARCOS FHS12,德国Spectro 公司)分析液相中元素含量;采用X 射线衍射仪(XRD,D/MAX-B 型,日本Rigaku 公司)表征固体产物晶型;采用马尔文粒度分析仪(Mastersizer 3000 型,英国Malvern 公司)测定固相粒度分布;采用扫描电子显微镜(SEM,Quanta250型,美国FEI 公司)观测样品晶体形貌;采用X 射线能谱分析(EDS,TEAM 型,美国EDAX 公司)进行晶体表面元素分析。
2 Li3PO4 溶解度测定
在40~70 ℃范围内,NaOH 不同质量分数下测定的Li3PO4溶解度数据如图2 所示。在一定温度下,Li3PO4溶解度与NaOH 质量分数近似呈线性关系,当NaOH 质量分数高于20%时,Li3PO4溶解度上升趋势加快,不同温度下变化趋势基本一致。在相同碱质量分数下,当温度由70 ℃下降至40 ℃时,Li3PO4溶解度反而随之增加,NaOH 质量分数越高,增加的趋势越明显。因此,降低体系中碱质量分数或者适当提高操作温度均有利于Li3PO4反应结晶过程。采用XRD 对不同碱质量分数与不同温度条件下得到的平衡固相进行鉴定分析,在实验范围内,得到的固相均为Li3PO4。

图 2 40~70 ℃下Li3PO4 在不同NaOH 质量分数下的溶解度及XRD 图谱Fig. 2 Solubility and XRD patterns of Li3PO4 in NaOH solution with different mass fraction from 40 ℃ to 70 ℃
3 操作参数对反应结晶过程的影响
3.1 反应温度
选取Li+初始质量浓度2.50 g/L、Na3PO4·12H2O用量为120%(理论化学计量数的1.2 倍,余同)、搅拌速率300 r/min,Na3PO4溶液采用迅速加料的方式,考察25、40、55、70、80、90 ℃时Li3PO4收率和粒径的变化,结果如图3 所示。随反应温度的升高,Li3PO4收率先增加得较快,后变化趋于平缓。温度为25 ℃时,Li3PO4收率较低,仅为70.58%;当温度上升至70 ℃,Li3PO4收率达到97.52%,而后基本不变。Li3PO4晶体的平均粒径(D[4,3])随温度升高而不断减小。

图 3 反应温度对Li3PO4 收率和平均粒径的影响Fig. 3 Effects of reaction temperature on the yield and average size of Li3PO4
不同温度下Li3PO4的平均粒径和变异系数(C.V.)列于表1。当温度由25 ℃升高至90 ℃时,Li3PO4晶体的平均粒径由26.5 μm 减小到4.27 μm,变异系数由45.35%上升至66.76%。表明反应温度越高,Li3PO4产物粒度越小,粒径分布越不均匀。反应温度主要通过影响物质的溶解度改变其过饱和度,从而影响反应结晶过程。由2.1 节可知,随温度升高,Li3PO4溶解度减小,因而Li3PO4过饱和度会逐渐增大,初级成核速率逐渐提高,促使体系生成大量细小晶粒,粒度分布更加不均匀。
由于70 ℃后继续升高温度对于Li3PO4收率的提升作用不大,综合考虑节能降耗和成本控制,选择70 ℃作为Li3PO4后续反应结晶过程中的最佳温度。
3.2 Li+质量浓度
固定其他条件不变,改变LiOH 的质量浓度,分别选取Li+质量浓度为0.47、0.66、0.87、1.74、2.54、3.93、5.11 g/L 进行实验。反应平衡后Li3PO4的收率和平均粒径如图4所示。随着Li+初始质量浓度的上升,Li3PO4收率先迅速增加,之后变化趋于平缓。当Li+质量浓度为0.47 g/L 时,Li3PO4收率较低,仅为79.66%;当Li+质量浓度增加至2.54 g/L 时,Li3PO4收率达到97.58%,而后基本不变。这是由于Li+初始质量浓度的升高使反应向有利于生成Li3PO4的方向进行,从而Li3PO4收率有所上升。在一定范围内,Li+质量浓度是影响Li3PO4收率的关键因素之一,进一步浓缩溶液提高Li+质量浓度,不仅增加成本,对提高收率影响也不大。因此选择2.54 g/L 作为后续反应结晶过程的最佳Li+初始质量浓度。此外,还可以看出,Li3PO4晶体的平均粒径随Li+质量浓度的增大而不断减小。
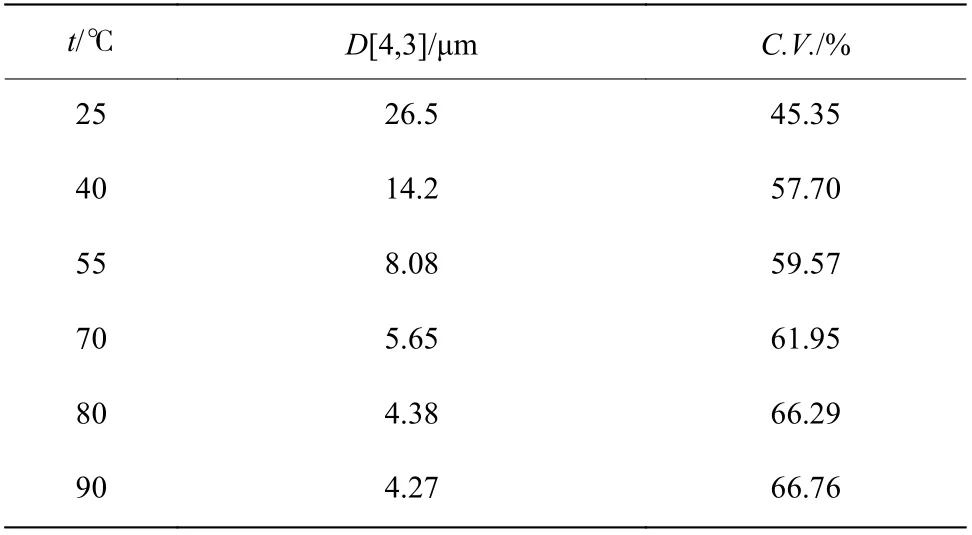
表 1 不同温度下LI3PO4 晶体的平均粒径和变异系数Table 1 Average size and C.V. of Li3PO4 at different reaction temperatures
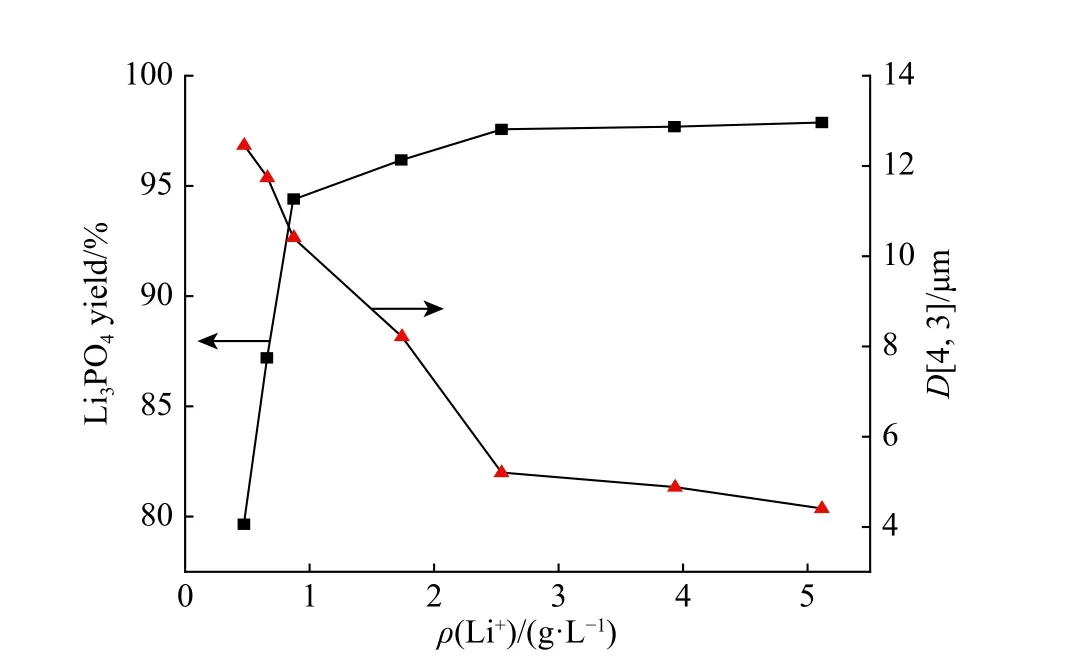
图 4 Li+ 质量浓度对Li3PO4 收率和平均粒径的影响Fig. 4 Effects of Li+ mass concentration on the yield and average size of Li3PO4
不同Li+初始质量浓度下制得Li3PO4产物的平均粒径和变异系数列于表2。当Li+质量浓度由0.47 g/L增加至5.11 g/L 时,Li3PO4晶体平均粒径由12.5 μm下降至4.20 μm,变异系数由52.27%上升至68.30%。这是由于Li+质量浓度的增加导致溶液过饱和度增加,反应结晶过程中的初级成核量也相应增加,从而使生成的Li3PO4粒度较小,粒径分布不均匀。
3.3 Na3PO4·12H2O 用量
维持其他条件不变,考察Na3PO4·12H2O 用量分别为100%、110%、120%、130%、140%时,Li3PO4收率和粒径的变化规律。由图5 可知,当Na3PO4·12H2O用量由100%增加至130%时,Li3PO4的收率由93.11%提升至97.10%。由于温度和Li+质量浓度均为前文确定的最佳条件,因而Li3PO4收率增加空间不大。当Na3PO4·12H2O 用量大于130%时,Li3PO4的收率变化减缓。由于质量浓度的提高使反应向有利于生成Li3PO4的方向进行,从而Li3PO4的收率有所上升。

表 2 不同Li+质量浓度下Li3PO4 晶体的平均粒径和变异系数Table 2 Average size and C.V. of Li3PO4 at different Li+ mass concentrations
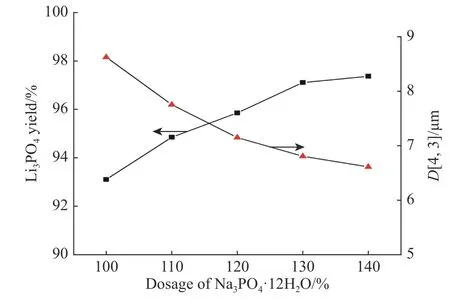
图 5 Na3PO4·12H2O 用量对 Li3PO4 收率和平均粒径的影响Fig. 5 Effects of Na3PO4·12H2O dosage on the yield and average size of Li3PO4
由 图5 可 知,随 着Na3PO4·12H2O 用 量 增 加,Li3PO4粒径逐渐减小。当Na3PO4·12H2O 用量刚好等于理论化学计量数时,Li3PO4晶体粒径较大;随着用量增加,产物粒度开始减小,且粒径变化逐渐减缓。粒径分布的变异系数(见表3)则随着Na3PO4·12H2O用量的增加而增大。这是由于Na3PO4·12H2O 用量的增加会导致溶液的过饱和度升高,容易造成局部成核现象发生,使得Li3PO4晶体主粒度较小和粒度分布变宽。
Na3PO4·12H2O 用量的增加,一方面会提高工艺成本,另一方面由于杂质的增加而影响产物的纯度。且Na3PO4·12H2O 用量对于Li3PO4收率影响较小,因此选择Na3PO4·12H2O 用量为110%为最佳用量。

表 3 不同Na3PO4·12H2O 用量下磷酸锂晶体的平均粒径和变异系数Table 3 Average size and C.V. of Li3PO4 at different dosages of Na3PO4·12H2O
3.4 搅拌速率
固定其他条件不变,考察搅拌速率分别为100、300、500、700、900 r/min 时Li3PO4收率和粒度的变化。如图6 所示,随着搅拌速率的增加Li3PO4收率基本保持不变,其平均粒径则先增大后减小。

图 6 搅拌速率对Li3PO4 收率和平均粒径的影响Fig. 6 Effects of stirring speed on the yield and average size of Li3PO4
不同搅拌速率下Li3PO4晶体的平均粒径和变异系数如表4 所示。Li3PO4产物平均粒径随搅拌速率增加先增大后减小是由于搅拌速率过低时,溶液在反应体系中混合不均匀,容易造成局部过饱和度偏大,从而导致初级成核现象,故产品粒径较小且分布不均匀;搅拌速率过高时,晶体与搅拌桨叶的碰撞强度增加,晶浆内流体剪应力增大,容易加大晶体破碎的概率,减小Li3PO4晶体粒度。随着搅拌速率的增加,反应体系混合越来越充分,变异系数先减小而后趋于平稳。
当搅拌速率为100 r/min 时,生成的Li3PO4晶体在玻璃夹套反应器内部产生比较严重的黏壁效应,对设备影响不利。同时搅拌速率过小产品的粒径分布不均匀。因此选择300 r/min 作为最佳搅拌速率参与后续Li3PO4反应结晶过程的研究。

表 4 不同搅拌速率下Li3PO4 晶体的平均粒径和变异系数Table 4 Average size and C.V. of Li3PO4 at different stirring speeds
3.5 加料速率
维持其他反应条件不变,考察Na3PO4溶液加料速率分别为1、5、10、15、20 mL/min 时Li3PO4收率和平均粒径的变化。如图7 所示,随加料速率的增加,Li3PO4收率变化不大,维持在94.4%左右,其平均粒径则逐渐减小。

图 7 加料速率对Li3PO4 收率和平均粒径的影响Fig. 7 Effects of feeding rate on the yield and average size of Li3PO4
不同加料速率下制得Li3PO4的平均粒径和变异系数列于表5。加料速率由1 mL/min 上升至20 mL/min时,产物粒径由39.3 μm 减小到25.8 μm,变异系数由36.77%逐渐增大至55.49%。这是由于加料速率越快,反应体系中局部过饱和度越高,容易造成爆发成核,导致细晶粒生成,进而引起粒径分布均匀性变差即变异系数增大。选择5 mL/min 为适宜的加料速率,以期获得粒径较小且均匀的Li3PO4晶体。
3.6 NaOH 质量分数
选取其他最优操作条件,考察体系NaOH 溶液初始质量分数分别为0、6%、13%、20%和27%时Li3PO4收率和粒径的变化。如图8 所示,随NaOH 质量分数增加,Li3PO4收率迅速下降。这是由于NaOH质量分数的升高会增大Li3PO4溶解度,不利于Li3PO4的结晶。

表 5 不同加料速率下Li3PO4 晶体的平均粒径和变异系数Table 5 Average size and C.V. of Li3PO4 at different feeding rates

图 8 NaOH 质量分数对Li3PO4 收率和平均粒径的影响Fig. 8 Effects of mass fraction of NaOH on the yield and average size of Li3PO4
表6 列出了不同NaOH 质量分数下制得的Li3PO4产物的平均粒径和变异系数,可以看出,Li3PO4晶体平均粒径随NaOH 质量分数上升逐渐减小。这是由于NaOH 质量分数增加会导致体系溶液黏度增大,影响反应结晶过程中晶体的附聚,使得产物粒径减小,小颗粒的增加导致粒径分布不均匀因而变异系数随之增大。
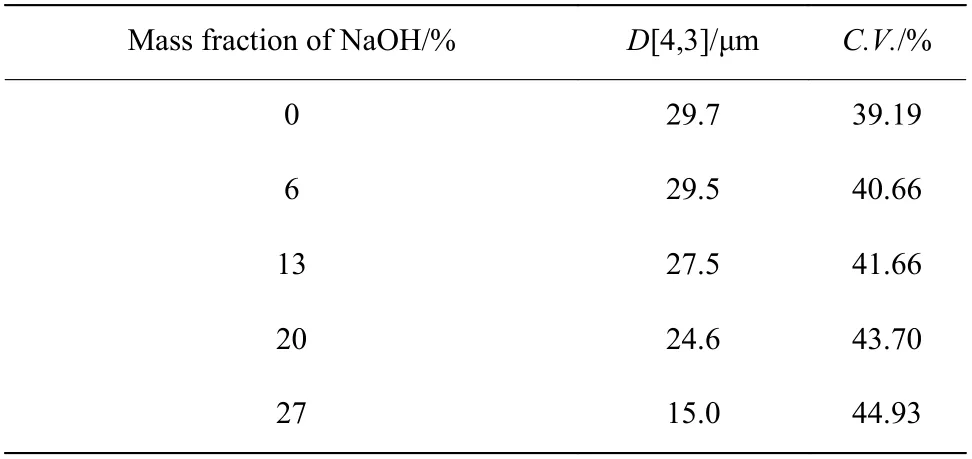
表 6 不同NaOH 质量分数下Li3PO4 晶体的平均粒径和变异系数Table 6 Average size and C.V. of Li3PO4 at different mass fractions of NaOH
NaOH 质量分数的增加对Li3PO4收率产生不利影响,同时会降低粒径均匀性,因此制备Li3PO4时应尽可能降低锂矿碱浸液NaOH 质量分数。
3.7 工艺参数系统优化
基于单因素试验结果,不考虑NaOH 质量分数的影响,选取影响最大的4 个因素即反应温度、Li+质量浓度、Na3PO4·12H2O 用量和加料速率为变量,以获得高收率和小粒径的Li3PO4产物为优化目标,利用中心复合设计(CCD)响应曲面法模型设计安排实验(见表7)。预测最优工艺条件为反应温度80 ℃、Li+初始质量浓度1.60 g/L、Na3PO4·12H2O 用量130%以及加料速率10 mL/min 时,得到Li3PO4收率和平均粒径的预测值分别为97.37%和18.57 μm,相应的实验值分别为96.85%和18.70 μm。说明预测值与实验值吻合良好,响应曲面法得到的Li3PO4的反应结晶优化工艺数值准确可靠。

表 7 CCD 试验设计及结果Table 7 Central composite design and experimental results
4 杂质元素对反应结晶过程的影响
4.1 K 元素的影响
当K 元素浓度分别为0、5.2、49.8、99.5、201.2、298.7 mmol/L 时,随K 元素浓度逐渐上升,Li3PO4晶体的平均粒径分别为25.2、25.7、27.5、27.6、30.4 、31.4 μm,粒径会逐渐增大。这意味着K 元素的存在会促进晶体的生长或者加剧晶粒之间的团聚现象。图9 比较了不同浓度K 元素存在的情况下生成的Li3PO4晶粒形貌。当K 元素浓度低于50 mmol/L 时,产物形貌基本不发生变化,能明显看到呈现出较为规整的棱柱状;当K 元素浓度≥50 mmol/L 时,产物的形貌开始变得不规则。说明K 元素浓度高于一定范围时,会影响产物的规整度。
4.2 Si 元素的影响
考察Si 元素浓度分别为0、0.35、1.78、3.57、7.15 mmol/L 时对Li3PO4反应结晶产物的影响。测定不同浓度Si 元素时,Li3PO4产物的粒径随着被引入Si 元素浓度的逐渐增加,晶体平均粒径分别为25.2、25.3、26.7、27.1、28.6 μm。结果表明,Si 杂质元素含量的升高,会使Li3PO4晶体粒径逐渐增大。图10 比较了不同浓度Si 杂质下Li3PO4产物的扫描电镜图。当Si 杂质浓度较低时,如Si 元素浓度为0.35 mmol/L 时,晶体颗粒未发生明显变化,呈现较为规则的棱柱状;当加入的Si 杂质浓度增加,晶体柱身变粗,长径比减小。

图 9 K 元素不同浓度下Li3PO4 晶体电镜图Fig. 9 SEM images of Li3PO4 prepared with different K concentrations

图 10 Si 元素不同浓度下Li3PO4 晶体扫描电镜图Fig. 10 SEM images of Li3PO4 prepared with different Si concentrations
4.3 Al 元素的影响
考察Al 元素浓度分别为0、0.36、0.92、1.47、2.11 mmol/L 时对Li3PO4反应结晶产物的影响。本实验反应结晶体系为碱性,Al 元素极易沉淀,加入Al 元素的浓度以初始氢氧化锂反应液中开始析出氢氧化铝沉淀为上限。
测定添加不同浓度Al 元素时Li3PO4产物的粒度,随着被引入Al 元素浓度的逐渐增加(0、0.36、0.92、1.47、2.11),晶体的平均粒径分别为25.2、25.0、24.5、24.2、23.8 μm,产物粒径随Al 元素含量增加而略微减小。图11 对不同情况下制得的Li3PO4的SEM 图进行了比较。与未添加杂质的产物相比,Li3PO4晶体的形貌由于Al 元素的加入规整度下降,也生成了更多的细小晶粒。

图 11 Al 元素不同浓度下Li3PO4 晶体扫描电镜图Fig. 11 SEM images of Li3PO4 prepared with different Al concentrations
4.4 杂质元素作用机理
杂质元素对于主体结晶产品的影响,其机理主要分为两种[17-18]:一种是杂质元素的离子选择性吸附在产物晶体表面,促进或者抑制该晶面的生长,从而改变晶体的尺寸或者形貌;另一种是杂质元素的离子通过嵌入到晶体晶格中,取代了晶粒中部分离子,生成不同结构或形貌的产物晶体。为了进一步确认各杂质元素对Li3PO4晶体的影响作用,分别采用ICP-OES 和EDS 对固体产物的组成进行定量和定性分析。基于ICP-OES 的测量结果,可以计算杂质元素的摄取率(U),如式(2)所示:

其中:nimpurity为产物所含杂质元素的物质的量(mol),nsolid为固体产物的物质的量(mol)。

图 12 Li3PO4 产物中K、Si 和Al 元素质量分数及各元素摄取率Fig. 12 Mass fraction of K, Si, Al and their uptake of Li3PO4
图12(a)显示了Li3PO4产物中K、Si 和Al 杂质元素的质量分数分别与其加入浓度的变化关系;图12(b)给出了Li3PO4对于K、Si、Al 元素的摄取率。Li3PO4产物中K、Si 杂质元素质量分数及摄取率均随其加入浓度的增加而升高。结合SEM 分析结果(图9~10),当K 元素含量较低时,Li3PO4形貌和纯度变化并不大。当加入的Si 元素浓度为1.78 mmol/L时,产品中Si 杂质离子含量已经达到1%,说明Si 元素对于Li3PO4产品的纯度影响很大。实际生产中,为了得到高纯度Li3PO4产品,应该尽可能将Si 除掉。尽管Si 元素的添加浓度远远低于K 元素浓度,但Li3PO4晶体对其摄取率却显著高于K 元素,说明Si 元素对于Li3PO4产物的作用更强。同时,在加入相同浓度杂质元素的情况下,Li3PO4产物中Al 元素的含量大大低于Si 元素的含量,表明Si 元素对Li3PO4晶体产物的作用也比Al 元素强。Li3PO4对于Al 元素的摄取率非常低,几乎等于0,可能是由于本实验探究的Al 杂质浓度范围有限。
用EDS 分析加入不同浓度杂质元素制得的Li3PO4固体,结果如图13 所示。所有固体产物均由O、P、Na 等元素组成(EDS 无法检测Li 元素),未分析到K 元素。结合ICP-OES 分析结果,说明Li3PO4晶体中确实存在微量的K 元素,可能是由于嵌入Li3PO4晶体中的K 杂质含量很少,低于EDS 的检测下限。当加入Si 元素的浓度较高时,Li3PO4晶体中能检测到Si 元素的存在。加入的Al 元素浓度为2.11 mmol/L 时可扫描到固体产物中有Al 存在,但由于比较微量,图13 中没有明显的峰出现。

图 13 杂质元素不同浓度下Li3PO4 晶体产物能谱图Fig. 13 EDS analysis of Li3PO4 prepared with different concentrations of impurity elements
综上所述,各杂质元素通过选择性吸附在晶体表面和离子嵌入晶格共同作用的方式来影响Li3PO4晶体的尺寸和形貌。
5 结 论
(1)Li3PO4溶解度随NaOH 质量分数增加而近似呈线性增加、随温度降低呈上升趋势,且NaOH 质量分数高于20%时变化更加显著。降低体系NaOH质量分数或者适当提高操作温度均有利于Li3PO4反应结晶过程。
(2)Li3PO4收率随反应温度、Li+浓度和Na3PO4·12H2O 用量的增加而上升,随NaOH 质量分数的增加而下降,搅拌速率和加料速率对其收率影响不大;Li3PO4晶体粒径随反应温度、Li+浓度、Na3PO4·12H2O用量、加料速率以及NaOH 质量分数的提高而减小,随搅拌速率的增加先增大后减小。以高收率和小粒径的Li3PO4晶体为目标,采用响应曲面法获得预测最优工艺参数为:反应温度80 ℃,Li+初始质量浓度1.60 g/L,Na3PO4·12H2O 用量130%,加料速率10 mL/min,产物收率和平均粒径的预测值分别为97.37%和18.57 μm,相应的实验值分别为96.85%和18.70 μm。预测值与实验值接近,误差较小。
(3)K、Si、Al 元素均会影响Li3PO4产品的纯度、形貌和粒度,杂质元素的作用机理为杂质离子选择性吸附在晶面和嵌入晶格的共同作用。低浓度的K 元素影响不明显,可根据经济性考虑是否除去;Si 元素对于产品纯度的影响最大,应尽量除去。

