槲皮苷铜配合物作为P-糖蛋白抑制剂的研究
邓 燕, 刘 慧, 张飞旭, 吴 侠, 郑 静, 张井岩
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
P-糖蛋白(P-glycoprotein,P-gp)是一种能量依赖性药物外排泵,通过腺苷三磷酸(Adenosine Triphosphate,ATP)水解供能发挥转运作用[1]。为了防止机体对有害物质的吸收,P-gp 可以介导细胞外源性物质的排出,从而保护一些重要组织和器官,这是机体在生理状态下的自身防御保护机制之一[2]。但是在P-gp 过表达的癌细胞中,P-gp 的转运外排作用也会将抗肿瘤药物逆浓度梯度泵出细胞外,导致细胞内药物浓度不断降低,这是癌细胞产生多药耐药性(Multidrug Resistance,MDR)的关键因素之一[3-4]。在过去20 多年里,P-gp 抑制剂的开发作为逆转P-gp 介导的肿瘤细胞MDR 的一个重要的方向,一直受到广泛关注[5]。到目前为止,P-gp 抑制剂的开发已历经3 代,但临床上使用的P-gp 抑制剂的特异性不高,副作用较大,使治疗功效受到明显限制[6]。虽然许多天然产物,如黄酮类化合物、萜类化合物等都表现出对P-gp 的活性抑制作用[7−8],但往往抑制剂活性较低。
自顺铂抗癌活性被发现以来,金属配合物在医药领域的应用受到广泛关注[9]。金属离子的结构和化学性质多样性可以不断丰富候选药物库,给药物设计领域提供了众多可能性[10-12]。近年来,研究者对酶结构和功能等知识的丰富积累以及许多金属离子对多种酶活性的特异性抑制活性[13-16],均极大地推动了具有酶抑制活性的新型金属药物的发展。目前,已开发出针对蛋白质脂质激酶、基质金属蛋白酶、端粒酶、拓扑异构酶和谷胱甘肽转移酶等具有活性抑制的金属配合物[17]。
相比于合成的小分子抑制剂,天然产物抑制剂虽然活性低,但是有它们自身的优势。为了提高天然产物抑制剂的活性,本文以具有低抑制活性的黄酮类化合物槲皮苷为配体,通过金属离子与槲皮苷配位,合成槲皮苷铜配合物(Cu-Quercitrin)和槲皮苷锌配合物(Zn-Quercitrin)。结果表明槲皮苷铜配合物表现出较好的抑制P-gp 活性的能力,表明槲皮苷金属配合物在抑制P-gp 转运、逆转细胞MDR 方面具有潜在应用价值。
1 实验部分
1.1 材料与方法
1.1.1 材料与试剂 槲皮苷(纯度98%)、一水合醋酸铜(纯度99%)、醋酸锌(纯度99%)、无水甲醇(纯度99%),均购于阿拉丁试剂有限公司;罗丹明123(Rhodamine 123,Rh123)、阿霉素(Doxorubicin,DOX)、维拉帕米,均购于西格玛奥德里奇上海有限公司;RPMI 1640 完全培养基购于赛默飞世尔科技有限公司;胎牛血清购于美国Gibco 公司;噻唑蓝(MTT)试剂盒、细胞腺苷三磷酸(ATP)检测试剂盒均购于上海碧云天生物科技有限公司;P-gp 单克隆抗体和二抗购于艾博抗(上海)贸易有限公司。
1.1.2 细胞培养 人乳腺癌耐阿霉素细胞MCF-7/ADR 和人乳腺癌细胞MCF-7 购于中科院上海细胞库。RPMI 1640 完全培养基用于MCF-7 和MCF-7/ADR 的培养,RPMI 1640 培养基中额外补充体积分数10% 的加强新生牛血清及体积分数1% 的青霉素-链霉素溶液,MCF-7/ADR 的培养需额外添加1 μmol/L DOX 以维持耐药性。细胞置于37 ℃,体积分数为5% 的CO2培养箱中培育。
1.2 测试与表征
紫外-可见光谱(UV-vis)使用Cary 50 型紫外分光光度仪测定;元素分析(EA)采用Elementar III Vario EI 型分析仪测定;电感耦合等离子发射光谱(ICP-OES)采用Agilent 725 型光谱仪测定;红外光谱(IR)通过Bruker Vortex 10 型在波长4 000~400 cm−1范围内测定;细胞毒性和ATP 含量检测通过Biotek Synergy H1 型多功能酶标仪进行测定;细胞成像通过Nikon Eclips Ti-S 型荧光显微镜拍摄完成。
1.3 实验步骤
1.3.1 槲皮苷金属配合物Cu-Quercitrin 和Zn-Quer citrin 的合成及表征 称取一水合醋酸铜(0.08 mmol,17.8 mg)溶于8 mL 水中,逐滴加入到槲皮苷(0.04 mmol,20 mg)的甲醇溶液(20 mL)中。将反应溶液加热至60 ℃,搅拌回流反应24 h,得到棕黄色浑浊液。过滤,滤渣用甲醇洗涤3 次后真空干燥得到棕黄色产物16 mg,产率为50%。Anal. Cacl. for C27H36Cu2O19:C 40.96%; H 4.58%; Cu 16.05%。Found: C 40.55%;H 4.19%; Cu 15.6%。IR(KBr,ν): 3 391、2 931、1 624、1 573、1 476、1 352、1 270、1 204、1 092、1 059、995、959、810、629 cm−1。UV(DMSO, 二甲基亚砜):287 、 450 nm 和675 nm。
称取醋酸锌(0.08 mmol,14.7 mg)溶于8 mL 水中,逐滴加入到槲皮苷(0.04 mmol,20 mg)的甲醇溶液(20 mL)中。将反应溶液加热至60 ℃,搅拌回流反应24 h,得到黄色浑浊溶液。过滤,滤渣用甲醇洗涤3 次后真空干燥得到黄色产物6 mg,产率20%。Anal. Cacl. for C25H32Zn2O19: C 39.13%; H 4.20%;Zn 17.04%。Found: C 38.69%; H 3.83%; Zn 18%。IR(KBr,ν): 3 408、2 932、1 622、1 575、1 476、1 352、1 271、1 202、1 089、1 060、996、964、807、620 cm−1。UV(DMSO, 二甲基亚砜):270 、 431 nm。
1.3.2 Rh123 和DOX 细胞中累积的检测 取干净的盖玻片置于24 孔板中,用质量分数为0.1%的明胶包备4 h 后,将MCF-7/ADR 或MCF-7 细胞以1.5×105个/mL 的细胞密度分别接种于24 孔板中,贴壁。分别加入浓度均为0、10、30、50 μmol/L 的槲皮苷,槲皮苷金属配合物Cu-Quercitrin 和Zn-Quercitrin, 以及50 μmol/L 维拉帕米的无血清的MCF-7/ADR 或MCF-7 培养基,置于37 °C 培养箱中共培育12 h,然后吸出培养基,加入10 μmol/L Rh123 或10 μmol/L DOX 的无血清培养基培育30 min。细胞经质量分数4%的多聚甲醛固定后制片并拍照。Rh123 在蓝光激发下可以呈现出绿色荧光,DOX 在绿光激发下可以呈现出红色荧光。
1.3.3 MTT 检 测DOX 的 细胞毒性 MCF-7/ADR 细胞以1.5×105个 /mL 的细胞密度分别接种于96 孔板中,24 h 贴壁。分别加入浓度为0、10、30、50 μmol/L的Cu-Quercitrin 与MCF-7/ADR 细胞共培育12 h,再加入0、30 和50 μmol/L 的DOX 共培育12 h。最后加入 20 μL 5 mg/mL 的MTT 溶液培育4 h、120 μL DMSO 溶解紫色结晶后通过酶标仪检测570 nm 处的吸光度A(A=Atotal-Ablank, 其中Atotal为实验组检测的吸收值,Ablank为空白对照组(未生长细胞) 测定的吸收值)。其中未加药组细胞存活率设为1,其570 nm处吸光值为A0,加药组各检测孔570 nm 处吸光值为A,A/A0即为MCF-7/ADR 细胞的存活率。
1.3.4 蛋白质印迹法 (Western-Blot) MCF-7/ADR细胞以1×105个 /mL 的细胞密度、毎孔2 mL 分别接种于6 孔板中,24 h 贴壁。分别加入浓度为0、10、30、50 μmol/L 的Cu-Quercitrin 与MCF-7/ADR 细 胞共培育12 h 后,置于冰上进行细胞裂解。细胞裂解物在4 °C、12 000 r/min 条件下离心5 min,取上清液。BCA 蛋白检测试剂盒测定各个样品蛋白的浓度,每个蛋白样品取10 μg 的进样量,进行SDSPAGE 电泳(分离胶体积分数为8%)。然后,通过转膜装置将蛋白转移至聚偏氟乙烯(PVDF)膜上。转膜结束后,取出PVDF 膜,其中蛋白正面朝上,TBST(Tris(hydroxymethyl) aminomethane)缓冲液洗3 次,每次10 min。再将膜置于质量分数为5% 的脱脂牛奶中进行封闭,在室温环境下缓慢摇动1 h。之后将膜置于体积比1∶5 000 稀释的P-gp 一抗中,4 °C 孵育过夜。一抗孵育后的聚偏二氟乙烯(PVDF)膜用TBST 缓冲液清洗4 次,每次5 min,再将膜置于体积比1∶3 000 稀释的二抗中,室温环境下孵育1 h。二抗孵育后的PVDF 膜用TBST 缓冲液洗涤5 次,每次10 min,将膜上未结合的二抗清洗干净。PVDF 膜经超敏ECL(Electro-Chemi-Luminescence)化学发光检测试剂盒显色,并置于暗室中显色进行拍照。
1.3.5 细胞中ATP 含量检测 MCF-7/ADR 和MCF-7 细胞以1×105个 /mL 的细胞密度,毎孔2 mL 分别接种于6 孔板中,24 h 贴壁。分别加入浓度为0、10、30、50 μmol/L 的Cu-Quercitrin 及50 μmol/L 维拉帕米与细胞共培育12 h。12 h 后,6 孔板中每孔加入200 μL ATP 检测裂解液,置于冰上进行细胞裂解。细胞裂解物在4 °C、12 000 r/min 条件下离心5 min,取上清液。采用ATP 检测试剂盒在多功能酶标仪中检测蛋白中ATP 含量的变化。同时采用BCA 蛋白检测试剂盒测定各个样品中蛋白的浓度。
1.3.6 统计学分析方法 在Excel 中通过T-test 进行统计学分析,其中*P < 0.05,**P < 0.01,***P <0.001(P 为计算所得的统计学概率)。

图 1 Cu-Quercitrin、Zn-Quercitrin 和Quercitrin 的紫外吸收光谱(a),红外光谱(b);Cu-Quercitrin(c)和Zn-Quercitrin(d)的化学结构Fig. 1 UV-vis spectra (a), FT-IR spectra (b) of Cu-Quercitrin, Zn-Quercitrin and Quercitrin; Chemical structures of Cu-Quercitrin (c) and Zn-Quercitrin (d)
2 结果与讨论
2.1 Cu-Quercitrin 和Zn-Quercitrin 的表征和结构
图1(a)所示为Cu-Quercitrin 和Zn-Quercitrin 溶解于DMSO 中的紫外-可见吸收光谱。配体槲皮苷在考察范围内有两个重要吸收峰,其中357 nm 处的吸收峰是来自槲皮苷中的肉桂酰共轭体系,260 nm处的吸收峰属于槲皮苷结构中苯甲酰共轭体系。从图中可以看出,Cu-Quercitrin 吸收峰在287 nm 和450 nm处,Zn-Quercitrin 吸收峰在270 nm 和431 nm 处,即配体槲皮苷中苯甲酰和肉桂酰共轭体系的吸收峰均发生不同程度的红移,初步表明槲皮苷中苯甲酰共轭体系的羟基和羰基及肉桂酰共轭体系中邻酚羟基都参与金属离子配位。此外,Cu-Quercitrin 在675 nm处有一个吸收峰,属于Cu-Quercitrin中Cu2+八面体几何构型的特征吸收峰[18]。根据朗伯-比尔定律,测得槲皮苷铜配合物Cu-Quercitrin 在675 nm 处的摩尔吸光系数(λ)为473 L/(mol·cm)。
图1(b)所 示 为Cu-Quercitrin 和Zn-Quercitrin的红外光谱,Cu-Quercitrin 和Zn-Quercitrin 分别在3 391 cm−1和3 416 cm−1处有一个特征宽带峰,属于槲皮苷中OH 基团和配位水分子中的O―H 伸缩振动峰[19]。相比于槲皮苷在3 268 cm−1处的羟基特征带,Cu-Quercitrin 和Zn-Quercitrin 的羟基特征峰分别向高频率移动了123 cm−1和148 cm−1,表明槲皮苷中邻酚羟基参与配位。另外槲皮苷中1 657 cm−1处的C=O 在槲皮苷金属配合物Cu-Quercitrin 和Zn-Quercitrin中分别转移到低频率的1 624 cm−1和1 622 cm−1处,表明槲皮苷中羰基氧原子参与配位。另外,C-O-C在1 270 cm−1处的伸缩振动峰和C= C 在1 573 cm−1处的伸缩振动峰并没有发生明显位移,表明配体槲皮苷中环氧没有参与金属配位。Cu-Quercitrin 和Zn-Quercitrin 的化学结构见图1(c)~(d),其中两个水分子和甲醇分子参与Cu-Quercitrin 的配位,四个水分子参与Zn-Quercitrin 的配位。综合谱图特征说明Cu-Quercitrin 和Zn-Quercitrin 的化学结构非常相似,但是没有晶体结构,不排除它们的立体结构有差异。
2.2 槲皮苷金属配合物Cu-Quercitrin 和Zn-Quercitrin的P-gp 抑制活性
2.2.1 Cu-Quercitrin 和Zn-Quercitrin 对Rh123 和DOX在MCF-7/ADR 细胞中累积的影响 Rh123 和DOX作为P-gp 的底物,会通过P-gp 转运而被排出细胞,在P-gp 过表达的细胞中难以积累到一定浓度。按照1.3.2 节方法进行检测,结果如图2 和图3 所示。与对照组和槲皮苷实验组相比,Cu-Quercitrin 处理的MCF-7/ADR 细胞中Rh123 和DOX 的荧光强度有明显增强,并且增强趋势呈浓度依赖性,Cu-Quercitrin的作用浓度越高,细胞中Rh123 和DOX 的荧光越强。在Cu-Quercitrin 的浓度为30 μmol/L 和50 μmol/L时,细胞中Rh123 的绿色荧光和DOX 的红色荧光明显强于配体槲皮苷和P-gp 抑制剂作用的细胞。但是Zn-Quercitrin 对Rh123 和DOX 在耐药细胞中积累的作用相对Cu-Quercitrin 的积累作用较弱。这可能与两种配合物的立体结构有关。这些结果表明槲皮苷与铜离子配位后,其活性得到明显提高,Rh123和DOX 在耐药细胞中积累明显增加。初步推测Cu-Quercitrin 对P-gp 转运可能具有抑制作用,且其抑制作用要强于P-gp 抑制剂维拉帕米。
2.2.2 Cu-Quercitrin 对Rh123 和DOX 在MCF-7 细胞中的积累 Cu-Quercitrin 可以增加Rh123 和DOX 在耐药株MCF-7/ADR 细胞中的积累,因此探究了Cu-Quercitrin 对Rh123 和DOX 在野生株MCF-7 细胞中积累的影响,结果如图4 所示。表明Cu-Quercitrin对Rh123 和DOX 在MCF-7 细胞中的积累没有明显影响。Cu-Quercitrin 可以增加耐药株MCF-7/ADR 细胞中Rh123 和DOX 的积累(图2 和图3),但不会影响在野生株MCF-7 细胞中的积累,进一步表明Cu-Quercitrin 可以明显抑制P-gp 的转运功能。
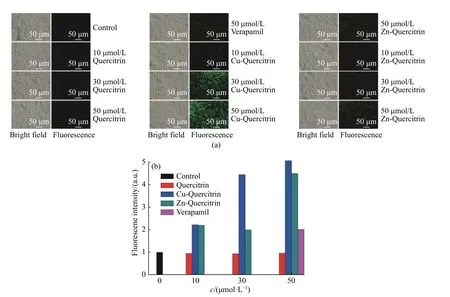
图 2 Rh123 在MCF-7/ADR 细胞内的积累Fig. 2 Accumulation of Rh123 in MCF-7/ADR cells
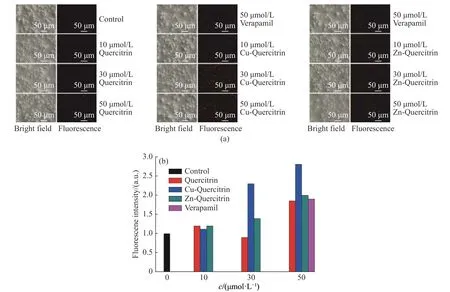
图 3 DOX 在MCF-7/ADR 细胞内的积累Fig. 3 Accumulation of DOX in MCF-7/ADR cells

图 4 DOX 和Rh123 在MCF-7 细胞内的积累Fig. 4 Accumulation of DOX and Rh123 in MCF-7 cells
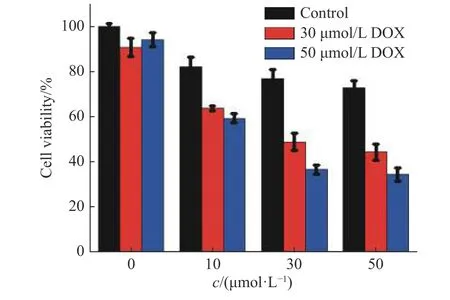
图 5 Cu-Quercitrin 对DOX 在MCF-7/ADR 细胞中细胞毒性的影响Fig. 5 Effect of Cu-Quercitrin on cytotoxicity of DOX in MCF-7/ADR cells
2.2.3 Cu-Quercitrin 对DOX 的细胞毒性的影响 在细胞DOX 荧光积累实验中发现Cu-Quercitrin 可以明显增加DOX 在MCF-7/ADR 细胞中的累积,因此通过MTT 实验检测Cu-Quercitrin 对DOX 在MCF-7/ADR 细胞中细胞毒性的影响,实验结果如图5 所示。对比黑色柱状图形可以看出Cu-Quercitrin 单独处理的细胞中,随着Cu-Quercitrin 作用浓度的增加,细胞存活率有所下降,但仍表现出较低的细胞毒性;在Cu-Quercitrin 的浓度为0 时(红色柱状图)可以看出DOX 有较低的细胞毒性,这是基于MCF-7/ADR对DOX 耐药性的结果。但是Cu-Quercitrin与MCF-7/ADR 细胞共培育12 h 后,DOX 再作用于细胞时,细胞存活率有明显下降,且Cu-Quercitrin 的浓度越高,细胞存活率越低。表明Cu-Quercitrin 通过抑制P-gp转运功能,增加DOX 在细胞中的积累,提高MCF-7/ADR 细胞对DOX 的敏感性,从而增强DOX 在细胞内的累积毒性,缓解P-gp 介导的细胞多药耐药。基于以上实验结果,Cu-Quercitrin 在30 μmol/L 浓度下表现出较强的P-gp 转运功能的抑制作用和较低的细胞毒性,因此目前实验条件下Cu-Quercitrin 的最优作用浓度为30 μmol/L/。
2.3 Cu-Quercitrin 的P-gp 抑制机制的研究
2.3.1 Cu-Quercitrin 对P-gp 在蛋白水平表达的影响P-gp 抑制剂一般是通过降低P-gp 的蛋白水平、RNA 水平的表达,或者通过影响细胞的ATP 的含量,进而影响P-gp 的转运功能[20]。MCF-7/ADR 细胞与0、10、30、50 μmol/L 的 Cu-Quercitrin 共培育12 h后,裂解细胞并提取总蛋白。通过Western-Blot 分离条带转膜后,Tanon 化学发光照胶仪采集图像如图6(a)所示,其中上面条带为目标蛋白P-gp,下面条带为内参蛋白Tubulin。图6(b)所示为由Tanon Gis 分析软件得出的条带分析结果。从图中可以看出Cu-Quercitrin 对细胞中P-gp 蛋白水平的表达没有明显影响,表明Cu-Quercitrin 并不会通过影响Pgp 蛋白水平的表达抑制P-gp 转运功能。
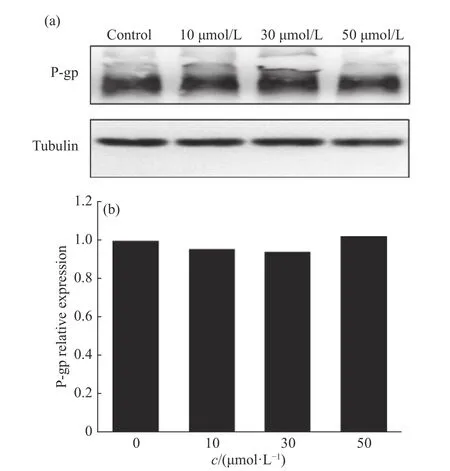
图 6 Cu-Quercitrin 对P-gp 在MCF-7/ADR 细胞中表达的影响Fig. 6 Effect of Cu-Quercitrin on the expression of P-gp in MCF-7/ADR cells
2.3.2 Cu-Quercitrin 对细胞中ATP 含量的影响 P-gp作为一种能量依赖的跨膜药物外输泵,在将外源性物质逆浓度从细胞内泵出细胞外的过程中需要ATP 水解释放能量。因此,ATP 对于P-gp 的转运功能至关重要,一旦细胞内ATP 含量发生变化,必然会影响P-gp 的转运功能。例如P-gp 抑制剂中GF-120918,LY-335979 和XR9576 等第三代抑制剂以及黄酮类化合物都可以通过影响ATP 含量抑制Pgp 药物转运功能[20]。因此,考察了Cu-Quercitrin 对细胞中ATP 含量的影响。
使用ATP 检测试剂盒(ATP Assay Kit)检测了Cu-Quercitrin 对细胞中ATP 含量的影响。当用0、10、30、50 μmol/L 的 檞皮苷、Cu-Quercitrin 及50 μmol/L的维拉帕米与MCF-7/ADR 和MCF-7 细胞分别共培育12 h 后,裂解细胞后提取总蛋白,基于ATP 检测试剂盒测定荧光素的荧光值与ATP 含量成正比,从而反映细胞中ATP 含量的变化,结果如图7 所示。从图7(a)中可以看出,与配体檞皮苷相比,Cu-Quercitrin 可以明显降低MCF-7/ADR 细胞中单位蛋白的ATP 含量。随着培养基中Cu-Quercitrin 浓度的增加,MCF-7/ADR 细胞中单位蛋白的ATP 含量逐步降低,而且明显低于使用同等浓度的P-gp 抑制剂。与之对应的是Cu-Quercitrin 对MCF-7 细胞中ATP含量没有明显影响(图7(b))。这与Cu-Quercitrin能够影响P-gp 底物在耐药细胞中的积累,但不会影响在非耐药细胞中的积累结果一致。与MCF-7 细胞相比,耐药细胞MCF-7/ADR 中P-gp 往往过度表达,而P-gp 结构中核苷酸结合位点参与ATP 水解释放能量,进而推动P-gp 的转运功能。这一结果表明Cu-Quercitrin 可能通过降低耐药细胞中ATP 含量,减少P-gp 转运功能所需的能力,进而抑制其转运功能。
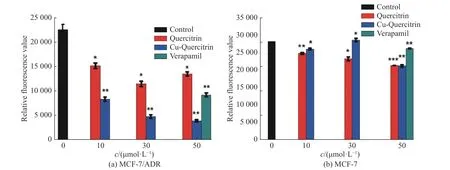
图 7 Cu-Quercitrin 对MCF-7/ADR 细胞(a)和MCF-7 细胞(b)中ATP 含量的影响Fig. 7 Effect of Cu-Quercitrin on the ATP content in MCF-7/ADR (a) and MCF-7 (b) cells
3 结 论
合成了槲皮苷金属配合物Cu-Quercitrin 和Zn-Quercitrin,探究了其P-gp 抑制活性。Cu-Quercitrin可以明显增加P-gp 底物Rh123 和DOX 在耐药细胞中的累积,但是对非耐药细胞没有明显影响。相比于Cu-Quercitrin,Zn-Quercitrin 对Rh123 和DOX 在耐药细胞中积累的作用较弱。这一实验结果初步表明Cu-Quercitrin 具有抑制P-gp 转运功能的作用,而且其抑制作用比同等浓度的维拉帕米强。同时Cu-Quercitrin 增强DOX 对耐药细胞的细胞毒性的实验结果也证明Cu-Quercitrin 抑制P-gp 药物外排功能,增加了抗癌药物在耐药细胞中的累积。通过进一步对Cu-Quercitrin 抑制P-gp 转运功能的机制研究发现,Cu-Quercitrin 对P-gp 蛋白水平的表达没有影响,但是能降低耐药细胞中ATP 含量,且降低趋势也明显高于维拉帕米。因此,Cu-Quercitrin 有望成为一种新型的P-gp 抑制剂。

