木蹄层孔菌液体发酵工艺条件优化*
崔驰浩,黄 亮,班立桐,孙 宁,王 玉,杨红澎
(天津农学院农学与资源环境学院,天津 300384)
我国真菌资源丰富,至少有10万余种,具有药效的超过540种,这些真菌大多为担子菌亚门和子囊菌亚门[1]。木蹄层孔菌(Fomes fomentarius),又名火域层孔菌,属于担子菌纲(Basidiomycetes) 多孔菌目 (Polyporales) 多孔菌科 (Polyporaceae) 层孔菌属(Fomes),是一种白腐菌[2]。木蹄层孔菌是生长于桦树、杨树、梨、苹果等阔叶木树干上的一种大型真菌,常在环境阴湿或光少的环境下生长,其子实体为药用部位[3]。
木蹄层孔菌是一种具有重要应用价值的真菌,其子实体对肿瘤细胞有很强的抑制作用,子实体和菌丝中均含有多种生物活性物质,其中重要代表物质为多糖[4]。中外医药研究成果证明,该多糖具有抗氧化、利尿、退烧、止痛、消炎、抗肿瘤等作用[4]。
液体培养有周期短、流动快、菌丝及其代谢产物较多等优点,且从其发酵液中提取的有效成分具有保健和药用功能[5]。合适的碳氮源及其比例、无机盐的用量、培养条件对液体菌种的生长发酵有很大影响[6],因此,选用优良的液体培养基配方及培养条件至关重要,在液体发酵过程,营养菌丝在适宜的条件下生长更快,新陈代谢更加旺盛。目前关于木蹄层孔菌发酵液中多糖的研究较少。通过对培养木蹄层孔菌液体培养基的碳、氮源、初始pH、转速、装液量进行单因素比较试验以及正交试验,测定木蹄层孔菌液体培养菌丝球及发酵液多糖含量;分析不同因素对液体菌种发酵液多糖含量的影响,从而找到最佳碳源、氮源及其培养条件,以及明显提高多糖浓度的方法,从而对于木蹄层孔菌发酵液中多糖的开发提供重要的理论支持。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
木蹄层孔菌TNCY001,保藏在天津农学院食用菌研发中心。
1.1.2 培养基
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,pH自然。
初始液体培养基:蔗糖25.0 g·L-1、MgSO40.5 g·L-1、K2HPO41.5 g·L-1、KH2PO41.5 g·L-1、蛋白胨15.0 g·L-1,VB10.045 g·L-1,初始 pH 6.0,装液量100 mL,转速 140 r·min-1。
1.2 试验方法
1.2.1 葡萄糖标准曲线绘制
以葡萄糖量(mg·mL-1)为横坐标,吸光度为纵坐标,绘制标准曲线。
1.2.2 绘制液体培养的生长曲线
按照基础培养条件及配方,在摇瓶培养过程中的1 h~168 h之间取样,前3 d每24小时取样1次,之后每12小时取样1次,过滤、烘干,计算菌丝球干重。以培养时间为横坐标,菌丝球干重、发酵液多糖产量为纵坐标绘制菌丝生长曲线图,并根据生长曲线图确定取样时间。
1.2.3 液体菌种培养基碳源、氮源筛选
分别以蔗糖、马铃薯、葡萄糖、麦芽糖作为碳源,每个处理3组重复,测定菌丝球干重及发酵液多糖含量,确定最佳碳源。
在确定的最佳碳源基础上,分别以酵母浸粉、牛肉浸膏、蛋白胨、硫酸铵、玉米浆作为氮源,3组重复,测定菌丝球干重及发酵液多糖含量,确定最佳氮源。
1.2.4 液体菌种培养基碳源、氮源添加量的筛选
在基础培养基条件下,最佳碳源根据1.2.3确定其添加量为 5 g·L-1、10 g·L-1、15 g·L-1、20 g·L-1、25 g·L-1,3组重复,取样时间根据1.2.2确定的最佳培养时间,测定菌丝球干重以发酵液多糖含量,确定最佳添加量。
在最佳碳源添加计量条件下,使最佳氮源的添加水平为 5 g·L-1、10 g·L-1、15 g·L-1、20 g·L-1、25 g·L-1,3组重复,最佳培养时间取样,测定菌丝球干重以发酵液多糖含量,确定氮源最佳添加量。
1.2.5 液体菌种培养基培养条件筛选
在上述优选的培养基基础上,设置不同装液量梯度,装液量依次为50 mL、70 mL、90 mL、110 mL,最佳培养时间取样,测定菌丝球干重以发酵液多糖含量,确定最佳装液量。
在上述优选的培养基基础上,最佳装液量条件下,设置不同初始pH梯度,依次为 4.0、5.0、6.0、7.0、8.0,最佳培养时间取样,测定菌丝球干重以发酵液多糖含量,确定最佳初始pH。
在上述优选的培养基基础上,转速梯度为110 r·min-1、140 r·min-1、170 r·min-1、200 r·min-1,最佳培养时间培养,测定菌丝球干重以发酵液多糖含量,确定最佳转速。
1.2.6 正交试验设计
通过单因素试验,确定木蹄层孔菌菌丝液体培养的碳源和氮源,K2HPO4、KH2PO4为培养基中主要的无机盐成分,并在筛选最佳碳源、氮源添加量试验的基础上,以初始pH、转速、装液量为培养条件,设计L16(45)正交试验,正交试验因素与水平设计见表1。根据菌丝生长曲线明确最佳培养时间,并测定菌丝球干重与发酵液多糖含量,确定木蹄层孔菌的最佳液体发酵工艺条件。
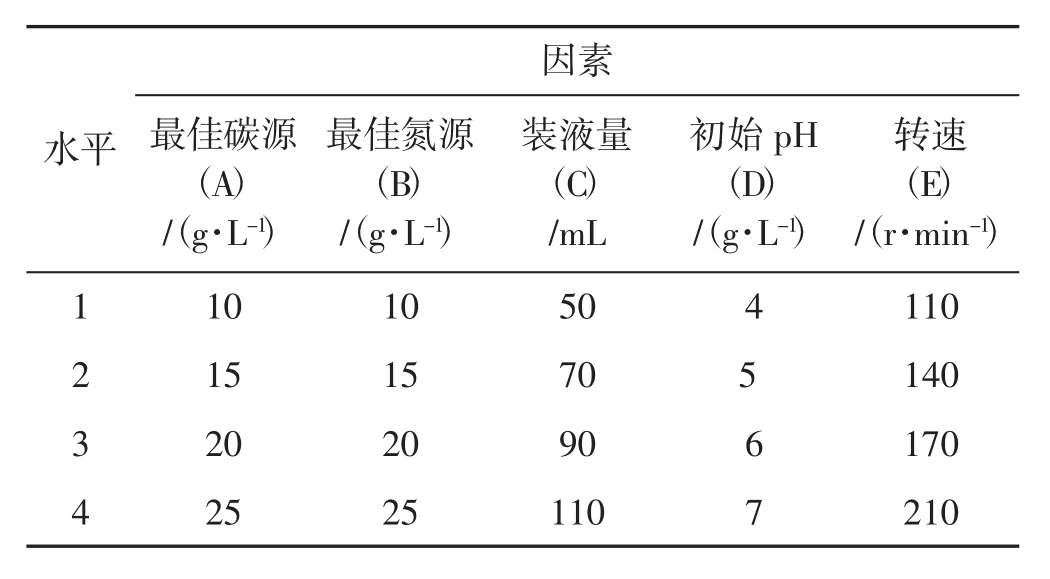
表1 L16(45)正交试验因素水平设计表Tab.1 Factors and their level of L16(45)orthogonal test
1.3 数据处理与分析
采用Excel 2010和DPS 7.05软件对试验数据进行统计分析,应用Duncan’s新复极差法进行差异显著性检验。
2 结果分析
2.1 葡萄糖标准曲线绘制
葡萄糖标准曲线见图1。
由图1可以看出,葡萄糖标准曲线R2=0.999 6,线性关系良好,可以用于发酵液多糖浓度计算。
2.2 木蹄层孔菌液体培养的生长曲线
木蹄层孔菌菌丝生长情况见图2。
由图2可知,菌丝球在培养过程中干重呈现先增加达到稳定后迅速下降的趋势,在培养前24 h有萌发现象,在接种的菌块表面有少量绒毛状菌丝;48 h~84 h,菌丝开始缓慢生长,培养基中出现少量菌丝和较小的菌球;84 h~120 h,菌丝生长达到快速生长期,培养基中的菌球数量明显增多,菌球变大;至第156小时,菌丝球干重达到稳定值且最大为0.270 g·L-1,156 h后菌丝球干重开始下降,因此,根据木蹄层孔菌菌丝生长曲线确定最佳取样时间为156 h。木蹄层孔菌发酵液多糖情况见图3。
由图3所示,发酵液中多糖浓度在培养过程中呈现先增加后下降的趋势,在培养的前132 h中,发酵液多糖浓度缓慢增加,在132 h~168 h,发酵液多糖浓度达到稳定值且最大为0.199 g·L-1,在168 h之后发酵液多糖浓度迅速下降,因此,根据木蹄层孔菌发酵液多糖浓度变化曲线确定最佳取样时间为156 h~168 h。综合考虑,确定木蹄层孔菌最佳取样时间为156 h。
2.3 木蹄层孔菌液体菌种碳源、氮源筛选
不同碳源对木蹄层孔菌发酵液中多糖浓度及菌丝球干重的影响见图4。
由图4可知,不同碳源下,菌丝球干重相差不大,使用葡萄糖作为碳源的菌丝球干重稍高于使用麦芽糖、蔗糖、马铃薯作为碳源的菌丝球干重,木蹄层孔菌菌丝对葡萄糖的利用能力最强,菌丝球干重为0.15 g·L-1;不同碳源下,以蔗糖为碳源的发酵液多糖产量最高达到0.424 g·L-1,以菌丝球干重及发酵液中多糖产量为指标,综合考虑,选取最佳碳源为蔗糖。以不同氮源对木蹄层孔菌进行培养,发酵液中多糖浓度及菌丝球干重见图5。
由图5可知,含酵母浸粉的液体培养基中菌丝球干重最大为0.736 g·L-1,表明木蹄层孔菌菌丝对酵母浸粉的利用能力最强;以酵母浸粉为氮源的发酵液多糖产量最高达到1.102 g·L-1,以菌丝球干重及发酵液中多糖产量为指标,选取最佳氮源为酵母浸粉。
2.4 木蹄层孔菌菌液体菌种碳源、氮源添加量的筛选
2.4.1 碳源添加量的筛选
以最佳碳源蔗糖不同添加量对木蹄层孔菌发酵液中多糖浓度及菌丝球干重影响见图6。
由图6可知,在蔗糖添加水平为5 g·L-1~25 g·L-1的条件下,菌丝球干重呈现先增加后下降的趋势,且在蔗糖添加量为15 g·L-1时,菌丝球干重达到最大为0.533 g·L-1,高于其他处理;在蔗糖添加量为20 g·L-1时,发酵液多糖产量达到最大为1.341 g·L-1。以菌丝球干重及发酵液中多糖产量为指标,综合考虑,碳源最佳添加量为20 g·L-1。
2.4.2 氮源添加量的筛选
最佳氮源酵母浸粉不同添加量对木蹄层孔菌发酵液中多糖浓度及菌丝球干重影响见图7。
由图7可知,在酵母浸粉添加水平为5 g·L-1~25 g·L-1的条件下,菌丝球干重呈现先增加后下降的趋势,且在酵母浸粉添加量为15 g·L-1时,菌丝球干重达到最大为2.413 g·L-1,高于其他处理;在酵母浸粉添加量为20 g·L-1时,发酵液多糖产量达到最大为1.114 g·L-1,以菌丝球干重及发酵液中多糖产量为指标,综合考虑,氮源最佳添加量为20 g·L-1。
2.5 木蹄层孔菌液体菌种发酵条件筛选
不同装液量对木蹄层孔菌发酵液中多糖浓度及菌丝球干重影响见图8。
由图8可知,摇瓶装液量越大,摇瓶中溶氧量反而降低,菌丝球干重也降低,当装液量为110 mL时,摇瓶中溶氧量高,菌丝生长较快,代谢旺盛,菌丝球干重最大为3.022 g·L-1,显著高于其他各处理;发酵液多糖含量先上升后下降,在装液量为70 mL时,发酵液多糖含量最高为1.488 g·L-1。以菌丝球干重及发酵液中多糖产量为指标,综合考虑,最佳装液量为70 mL。
pH高低影响细胞膜的电荷变化,酶活性以及菌丝生物量也会受该因素影响[7]。不同pH对木蹄层孔菌发酵液中多糖浓度及菌丝球干重的影响见图9。
图9表明,发酵液初始pH为5.0、6.0时菌丝球干重变化不大,当初始pH为7.0时,菌丝球干重下降,在初始pH为5.0时,菌丝球干重最大为2.402 g·L-1;发酵液多糖含量先上升后下降,在初始pH为6.0时,发酵液多糖含量最高为1.517 g·L-1。以菌丝球干重及发酵液中多糖产量为指标,综合考虑,选取最佳初始pH为6.0。
转速越高,摇瓶中的溶氧量越多,越有利于菌丝的生长;但转速过高会产生较大的剪切力,在培养过程中不能够形成菌球,进而影响菌丝生长[8]。不同转速条件下发酵液多糖浓度及菌丝球干重变化见图10。
由图10可知,随着摇床转速的增加,摇瓶中溶氧量逐渐增加,但球丝球干重呈现先增加后降低的趋势,在转速为140 r·min-1的条件下,菌丝球干重达到最大为2.176 g·L-1;发酵液多糖浓度在200 r·min-1达到最大为1.111 g·L-1,以菌丝球干重及发酵液中多糖产量为指标,综合考虑,选取最佳转速为 200 r·min-1。
2.6 正交试验结果分析
L16(45)正交试验结果直观分析表见表2,最佳碳源确定为蔗糖,最佳氮源为酵母浸粉。菌丝球干重方差分析见表3。

表2 L16(45)正交试验结果直观分析表Tab.2 Intuitive analysis table for the result of L16(45)orthogonal test
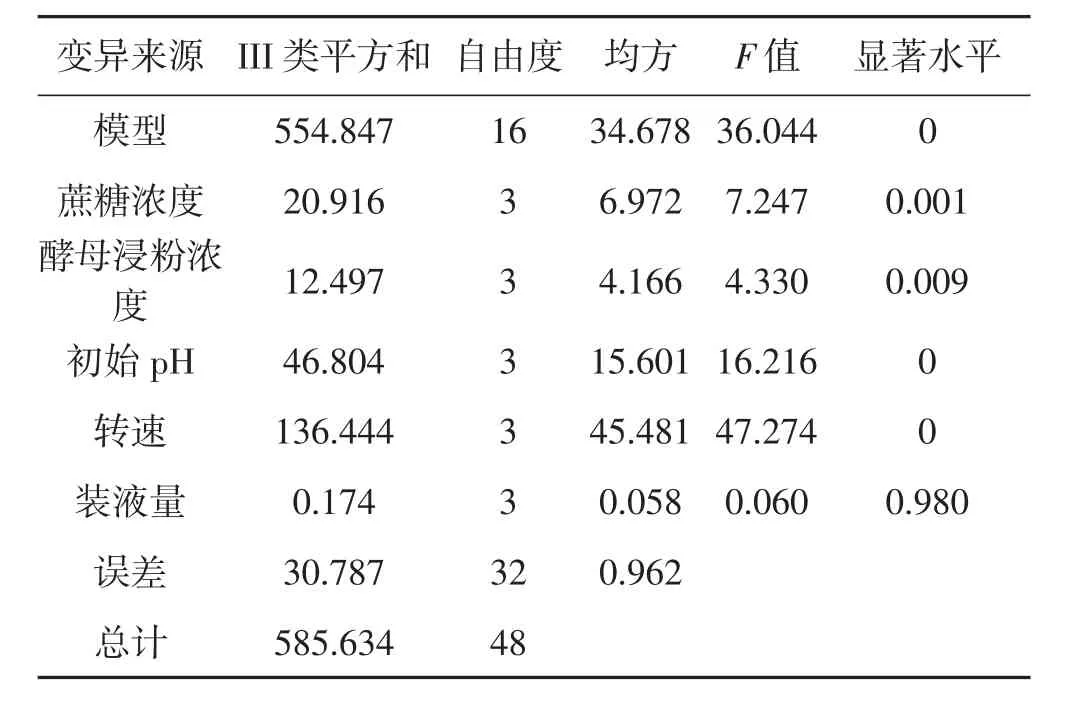
表3 菌丝球干重方差分析Tab.3 Variance analysis on mycelium dry weight
由表2可知,在不同的培养基组分下,摇瓶中木蹄层孔菌菌丝球干重以编号8(A2B4C3D2E1)最大,为6.685 g·L-1;根据极差分析结果,影响木蹄层孔菌菌丝球干重的各因素的主次顺序为:初始pH>装液量>蔗糖>酵母浸粉>转速。
由表2结合表3方差分析结果表明,除装液量对菌丝球干重无显著差异,其余各因素对菌丝球干重呈极显著差异,说明氧气含量、养分供应、pH对木蹄层孔菌发酵菌丝球干重影响较大,其中转速是发酵过程中增加氧气供应的主要因素,碳氮源是菌种进行生长发育的主要营养物质,另外木蹄层孔菌又是一种喜酸菌种,适合的pH对其生长影响很大。从上述分析来看,极差分析与方差分析结果稍有偏差,可能是因为极差分析未能利用全部测量指标的信息,只指明了测定值的最大范围,不能细致地反映测量值彼此相符合的程度,正交试验弥补了极差分析缺陷。因此应以正交方差分析结果为主。根据正交试验筛选出满足木蹄层孔菌生长代谢的最佳培养基以及发酵条件组合为A2B4C4D2E1,这与16个处理中编号8(A2B4C3D2E1)的结果不一致;经验证,在配方8条件下培养,木蹄层孔菌丝球干重达到6.685 g·L-1,优于正交试验筛选最佳培养基。即适合木蹄层孔菌菌丝球生长的最佳液体发酵培养基配方为蔗糖15 g·L-1,酵母浸粉25 g·L-1,装液量90 mL,转速 110 r·min-1,初始 pH 5.0。
由表2可知,在不同的培养基组分下,在不同的培养基组分下,木蹄层孔菌液体发酵多糖浓度以A2B3C4D1E2处理最大,为1.444 g·L-1;根据极差分析结果,影响发酵液多糖浓度的各因素的主次顺序为:转速>酵母浸粉>装液量>蔗糖>初始pH。发酵液多糖产量方差分析见表4。
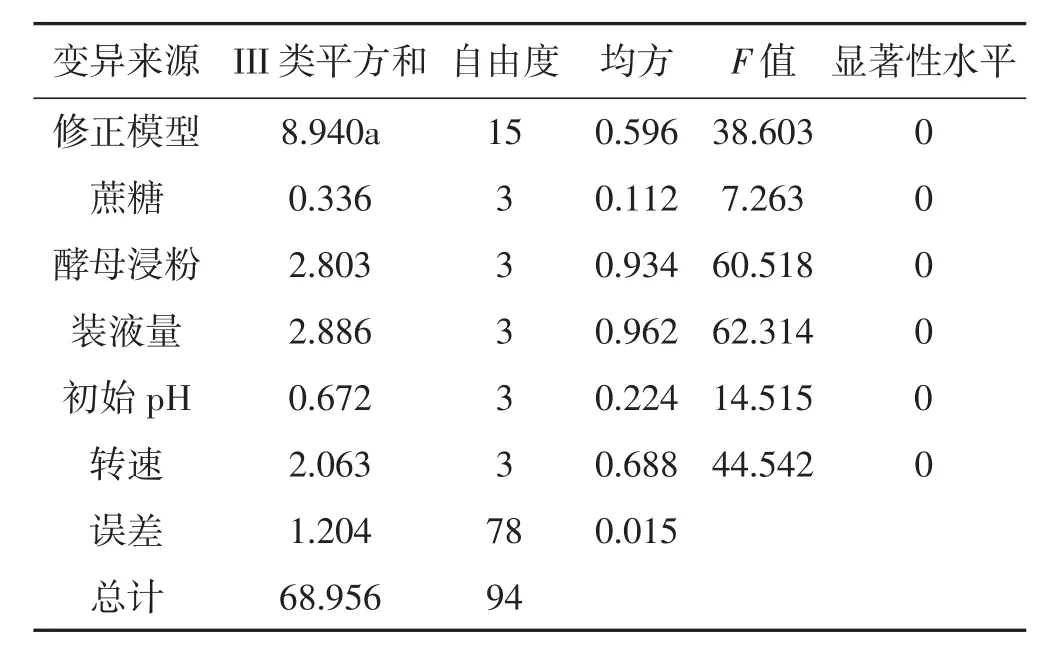
表4 发酵液多糖产量方差分析Tab.4 Variance analysis on fermentation liquid polysaccharide yield
由表2结合表4方差分析结果表明,各因素均达极显著水平;根据正交试验筛选出适合木蹄层孔菌产发酵多糖液体培养的培养基组合为A1B4C4D4E2,这与16个处理中最大值组合编号7(A2B3C4D1E3)不一致;经验证,在组合正交试验筛选出的配方下培养,木蹄层孔菌液体发酵多糖浓度量达到1.512 g·L-1,优于A2B3C4D1E3,即适合木蹄层孔菌菌株多糖含量的最佳培养基配方为蔗糖10 g·L-1,酵母浸粉25 g·L-1,装液量110 mL,转速140 r·min-1,初始为pH 6.0。
3 结论
野生木蹄层孔菌的多糖获得较难,本试验通过对保藏菌种进行分离、培养、纯化、液体发酵并筛选出适宜培养条件获得较高的多糖产量,为木蹄层孔菌多糖开发研究提供依据。
碳源和氮源是菌丝生长过程中最主要的营养物质,菌丝在不同的营养物质条件下的生长速率以及在生长过程中产生的代谢产物含量不同[9]。聂建军等[10]研究表明,当培养基中碳源为葡萄糖时,菌丝生物量和胞外多糖产量均明显高于蔗糖,分别提高了5.83倍和0.85倍。因此,筛选合适的碳氮源在提高木蹄层孔菌液体发酵多糖产量上十分重要。
总体来看,试验中所采用的氮源均适合木蹄层孔菌菌丝的生长,但对酵母浸粉的利用效率最高,故选用酵母浸粉为最佳氮源。初始pH筛选结果表明木蹄层孔菌菌丝液体培养最佳初始pH为5.0,与大部分野生真菌喜欢酸性环境生长研究结果一致。将单因素试验与正交试验相结合,最终筛选出适合木蹄层孔菌液体培养基以及培养条件为:蔗糖10 g·L-1、酵母浸粉 25.0 g·L-1、MgSO40.5 g·L-1、磷酸二氢钾 1.5 g·L-1、磷酸氢二钾 1.5 g·L-1,VB10.045 g·L-1,初始pH 6.0,装液量110 mL,培养温度25℃,静置时间24 h,转速140 r·min-1,在此条件下木蹄层孔菌液体发酵多糖浓度量达到1.512 g·L-1,是优化前(0.199 g·L-1)的7.6倍。目前关于多糖尤其是野生真菌发酵液中多糖的研究较少,因此本文的研究结果对于野生真菌发酵液中多糖的开发具有十分重要的意义。

