基于流式细胞仪对杏属植物基因组大小的测定
张俊环,杨 丽,姜凤超,张美玲,孙浩元,王玉柱
(1.北京市林业果树科学研究院,北京 100093;2.国家林业和草原局杏工程技术研究中心,北京 100093)
基因组大小(或称C-值)是指单倍体细胞中全套染色体的DNA总量,以质量pg(Picogram)或碱基对数目Mb(Million base pair)为单位[1],而1 pg相当于978 Mb[2]。流式细胞仪法由于方法简便、快捷、灵敏度高、检测结果稳定可靠,已成为测量植物基因组大小的主要手段[3-5]。用流式细胞仪检测细胞DNA含量,通常采用特异的荧光染料碘化丙啶(Propidium iodide,PI)对其进行染色,PI通过均匀地插入双链DNA的碱基对中,对细胞核DNA进行特异性染色,荧光分子结合DNA的量与细胞内DNA含量呈正比,通过检测被激发的染色细胞发射的荧光强度,并与内参比较可换算出被测样品的DNA含量[1]。近年来,多种植物在进行高通量测序之前,先通过流式细胞仪进行基因组大小的测定,以期为高通量测序文库的构建和基因组组装提供数据参考[6-8]。
杏(Prunusarmeniaca)是原产我国的特色果树,我国杏栽培面积和产量均居世界首位。杏属于蔷薇科(Rosaceae)李属(PrunusL.)李亚属(Prunophora)杏组/属(Armeniaca)植物,杏属植物共有6~12个种[9],其中普通杏(P.armeniaca)、西伯利亚杏(P.sibirica)、辽杏(P.mandshurica)和紫杏(P.dasycarpa)这4个种是杏生产中常见并得到公认的种类。另外,仁用杏(又称大扁杏)被认为是由普通杏(P.armeniaca)和西伯利亚杏(P.sibirica)自然种间杂交形成的类型[10-11]。杏资源种类极其丰富,不同种类在生态适应性、形态特征等方面表现出多样性,即使同一个种内,不同品种在某些性状上的变异也较显著。近年来,对这些杏属植物的研究主要集中在遗传多样性、亲缘关系以及分类地位等方面[12-14],而针对它们基因组大小的分析鲜见报道。基因组反映了生物物种全部和特定的遗传信息,基因组大小是植物最基本也是最重要的生物多样性特征参数。因此,本研究用流式细胞仪,通过单独进样和混合进样结果分析,筛选出理想的内参基因组,并以此为内参,测定分属于普通杏、辽杏、西伯利亚杏、仁用杏和紫杏5个种的12个杏品种资源的基因组大小,并以引进的欧洲品种Canino为参照,比较不同种、变种及品种之间基因组大小的差异,以期为相关杏属植物的物种进化和分类研究以及基因组研究提供基础数据。
1 材料和方法
1.1 试验材料
供试的13份杏资源(表1)分别属于5个种和变种,其中普通杏4份(包括1份欧洲品种)、普通杏变种5份、西伯利亚杏1份、辽杏1份、紫杏1份、仁用杏1份。13份供试材料的嫩叶均采自北京市林业果树科学研究院的杏资源圃,试验作为内标的桃品种早艳、葡萄品种瑞都科美和枣品种金丝小枣的嫩叶均采自北京市林业果树科学研究院的资源圃。
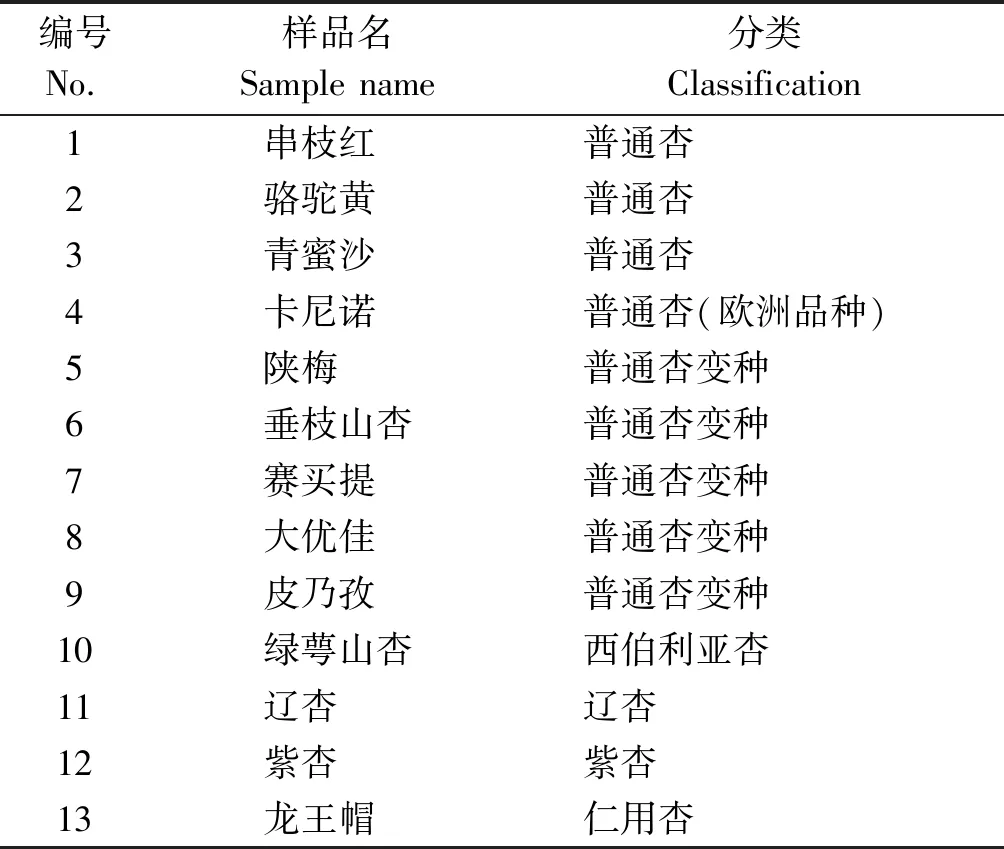
表1 供试的杏资源信息Tab.1 Information of tested apricot materials
1.2 试验方法
1.2.1 细胞核悬液制备 按照试剂盒Cystain®PI Absolute (sysmex)的说明书进行,取幼嫩、干净的新鲜叶片,剪取小于0.5 cm2大小的新鲜嫩叶,放入培养皿中,加入500 μL提取缓冲液,用锋利的刀片一次性快速切碎,材料整个过程浸没在提取液里;完全切碎后再加入4 ℃下预冷的2 mL含有碘化丙啶(Propidium iodide, PI)12 μL和RNaseA 6 μL的染色液,之后立即用50 μmol/L滤膜过滤到5 mL收集管中,置4 ℃下避光染色1~2 h,获得细胞核悬浮液,置于冰上备用。每个样品设3个生物学重复。以二倍体的桃品种早艳、葡萄品种瑞都科美和枣品种金丝小枣分别做内标,筛选适宜的内标植物。
1.2.2 流式细胞仪检测 用德国Partec流式细胞仪(CyFlow-Space)进行检测,每组样品至少收集10 000个粒子,然后根据内标植物和待测植物的核浓度,调整比例进行混合,使内标植物和代谢植物的核浓度尽量一致,再次共进样检测,流式细胞仪测定内标与待测植物的荧光峰图,以FlowMax软件进行数据分析,CV值控制在5%以内。
1.2.3 样品基因组大小的计算 荧光信号的强度代表了细胞核内物质的浓度,与细胞核DNA含量呈正比。样品的基因组大小按照以下公式计算:待测样品基因组大小=(待测样品荧光强度/内标样品荧光强度)×内标植物基因组大小。
2 结果与分析
2.1 内标植物基因组的确定
以杏串枝红、陕梅和大优佳杏为例,分别以二倍体葡萄品种瑞都科美、二倍体桃早艳和二倍体枣金丝小枣的基因组做内标,进行内标基因组的筛选。杏、葡萄、桃和枣的基因组大小测定结果如图1,可见,在优化的试验条件和仪器参数设定下,4种植物基因组的流式直方图中均出现了清晰的吸收峰,并且,杏和桃的流式直方图中均出现了双峰(图1-A、C),且双峰出峰位置比例保持较为稳定,通过计算发现,2个峰的道数值(出峰位置)呈2倍关系,由此可知,第1个峰代表的是G0/G1期的DNA含量,第2个峰代表的是G2/M期的DNA含量。流式细胞仪测定植物基因组大小,通常是通过比较G0/G1期的峰值来计算基因组大小。由图1可知,杏、桃、葡萄和枣的G0/G1期峰的荧光强度值分别为119.93,103.54,190.86,176.99,根据基因组大小计算公式,在内标植物相同时,基因组大小与荧光峰值呈正比,由此判断4种植物的基因组大小顺序为桃<杏<枣<葡萄,与已经发表的这4种植物基因组大小顺序相符(杏294 Mb、桃265 Mb、枣438 Mb、葡萄487 Mb)[1]。
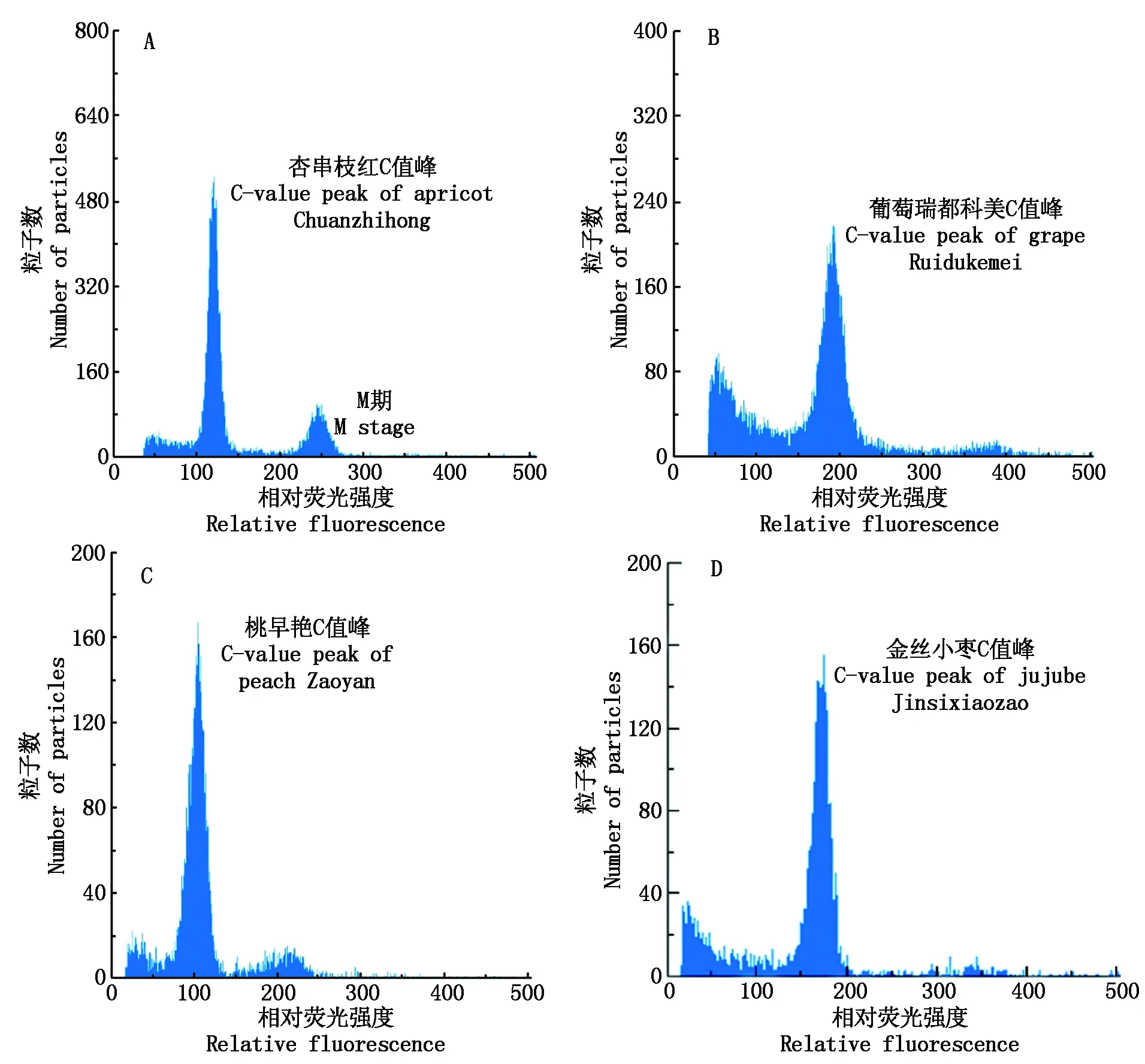
图1 杏、葡萄、桃和枣分别单独进样的流式细胞仪测试结果Fig.1 Flow cytometric fluorescent detection image of apricot, grape, peach and jujube
为了准确测定杏属植物基因组的大小,避免流式细胞仪在不同时间点对PI核染色灵敏度的差异,一般采取测试植物样品与内参样品共进样,在相同条件下同时测定待测植物与内标植物的荧光峰值,通过比值估测待测植物基因组的大小。杏与不同内参共进样得到的混合峰如图2所示。在优化的试验条件下,混合样品的吸收峰均可同时被检测到,但是杏的细胞核和桃的细胞核却不易分开,2C值吸收峰几乎重叠(图2-B),因为二者的基因组大小比较接近。葡萄瑞都科美的2C荧光峰(G0/G1)位于杏的G0/G1期峰与G2/M期峰之间(图2-A),并且与杏细胞分裂的G2/M期几乎重叠,互相干扰。由图2-C可以看出,金丝小枣的2C值峰也位于杏的G0/G1期峰与G2/M期峰之间,但金丝小枣的基因组比葡萄小,它的G0/G1期峰的荧光强度值小于葡萄,故距离杏G2/M期峰相对稍远,杏与金丝小枣混合样品的检测直方图中无重叠峰,且区分度良好,可获得较少杂峰的峰型图。因此,选用基因组大小已知的金丝小枣作为内标,可保证测定杏属植物基因组大小的合理性和准确性。通过比较单独进样和共进样,确认杏和枣荧光峰的相对位置,从而估算杏基因组的大小。其他杏属植物基因组的大小测定均以枣基因组做内参。
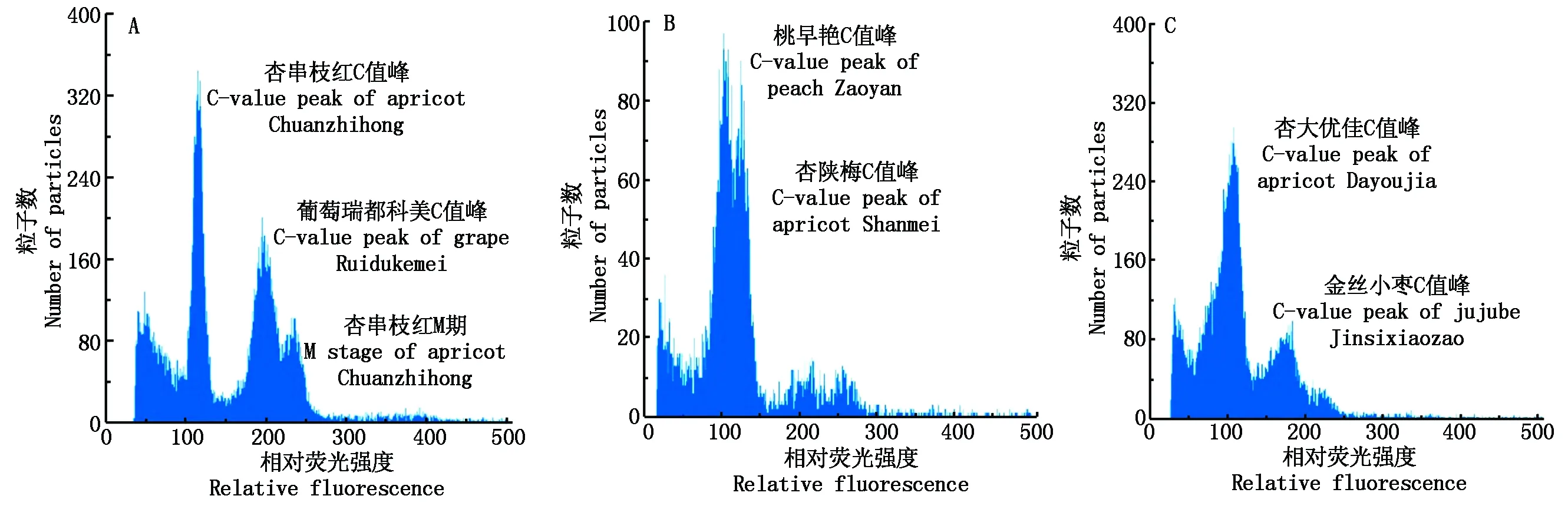
图2 杏与葡萄、杏与桃、杏与枣合样品流式细胞仪检测结果Fig.2 The result of mixed samples of apricot with grape, peach or jujube, respectively
2.2 不同杏属植物基因组大小的比较
以二倍体枣品种金丝小枣(C值0.44 pg,基因组大小为424 Mb)[2]为内标,通过比较待测样品和内参G0/G1期峰,计算得出杏属植物不同种和品种的基因组大小,发现杏属植物的基因组大小在(245.07±0.842)~(300.60±1.181)Mb。杏属植物不同种和品种间基因组大小均有一定的差异,其中所测试的5个种间的差异均达到了显著水平。由表2可知,基因组相对较大的是普通杏变种陕梅,为(300.60±1.181)Mb,其次为串枝红,基因组大小为(291.59±1.642)Mb,二者差异显著且均显著高于其他品种;然后依次是Ⅲ组(辽杏及普通杏变种赛买提和皮乃孜),Ⅳ组(西伯利亚杏的绿萼山杏及普通杏品种骆驼黄和青蜜沙),Ⅴ组(普通杏变种垂枝山杏和仁用杏品种龙王帽),Ⅳ组(普通杏变种李光杏类型大优佳和普通杏欧洲品种类型卡尼诺),组间差异均显著但组内差异均不显著;基因组相对较小的是紫杏(245.07±0.842)Mb ,显著低于其他品种。在普通杏的3个品种中,骆驼黄与青蜜沙杏的基因组大小无显著差异,但均显著小于串枝红杏。另外,同属于李光杏类型的3个品种间也有一定的差异,赛买提和皮乃孜的基因组大小分别是(279.45±4.619)Mb和(278.36±0.859)Mb,二者无显著差异,但均显著大于大优佳杏。
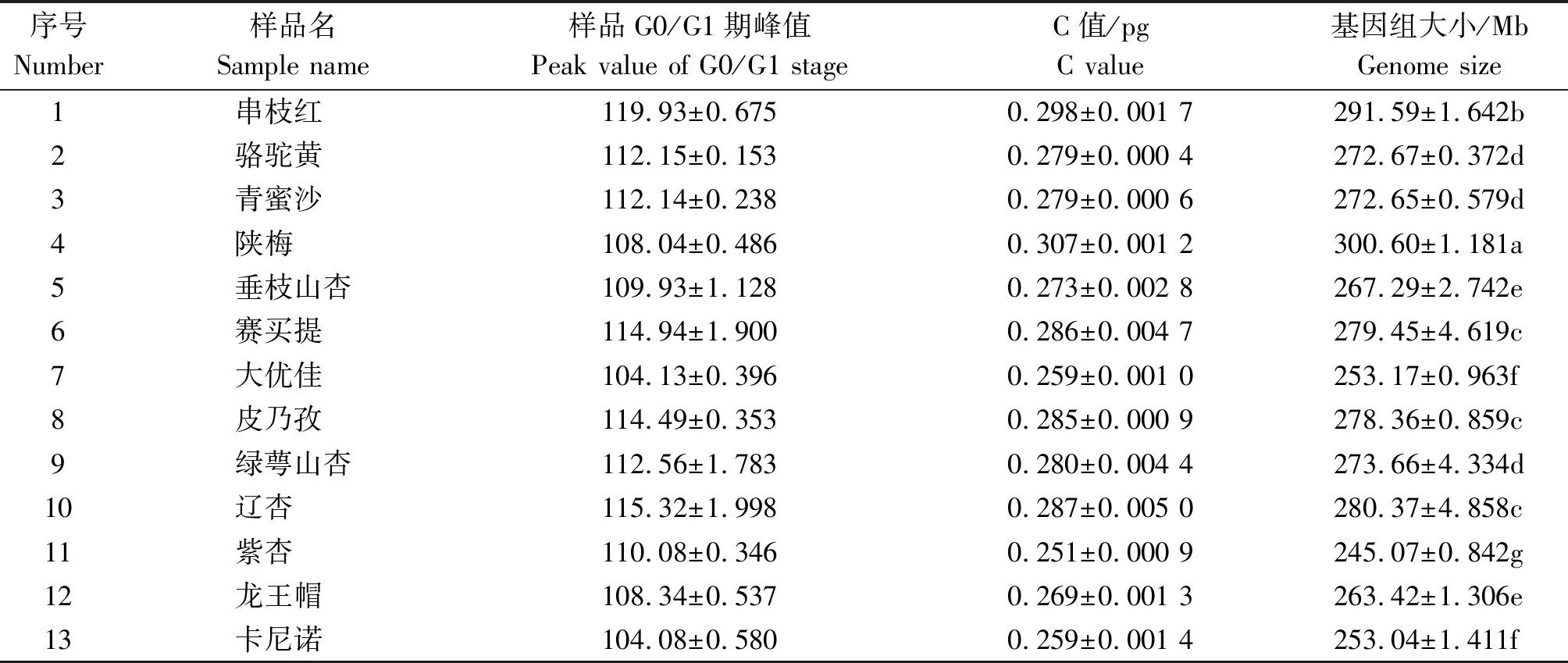
表2 13个杏品种的基因组大小Tab.2 The genome size of 13 cultivars of P. armeniaca
3 结论与讨论
基因组大小的测定一般采用内标法[5],使用内标的分析能够降低样品制备以及仪器自身引起的误差,因此更适用于精确的分析[15]。有研究表明,同一个植物类型材料,选择的内标植物不同、测定方法不同(包括内标法和外标法、染色方法等)而得到大小不同的基因组测定值[2, 16-17]。内标植物的选择对准确测定待测植物的基因组很重要[18],本研究内标基因组的选择标准,主要考虑了以下几方面:已经发表基因组大小的二倍体果树植物,基因组大小与杏基因组大小相差不是太大,但要保证2种材料的荧光峰(G0/G1期峰)不能重叠。在实际检测时发现,可能是因为杏这一物种细胞分裂间期较短,杏材料同时出现了细胞分裂的G0/G1期(二倍体DNA)荧光峰和G2/M期(DNA加倍)荧光峰;因此,内参植物的荧光峰需要满足与杏基因组的2个荧光峰均不重叠的条件。本研究中待测植物的2个荧光峰与金丝小枣测定的直方图中荧光峰均无重叠,区分度良好,试验结果准确可靠,故金丝小枣在本研究中是一种较为理想的内标植物。以金丝小枣为内参测定普通杏基因组大小为272.65~291.59 Mb,与以鸡血红细胞为内参测定杏基因组大小为294 Mb相接近[1],这也表明本研究内标植物的选择是准确可信的。
基因组大小是指真核生物单倍体基因组所含DNA的总量,可反映植物种间和品种间的差异[19-21],本研究也得到了类似的结果。测试的杏5个种间基因组大小差异较大,达到了显著水平,普通杏基因组相对较大,尤其是串枝红杏(291.59 Mb),紫杏基因组最小(245.07 Mb);西伯利亚杏品种绿萼山杏与普通杏品种骆驼黄和青蜜沙差异不显著,辽杏与普通杏变种赛买提和皮乃孜差异不显著,两组间差异小于其与紫杏之间的差异,说明普通杏与西伯利亚杏和辽杏的亲缘关系较近,而与紫杏的亲缘关系较远,这与冯晨静等[22]采用ISSR分析的结果相一致。另外,目前研究支撑杏属植物的演化趋势为:普通杏→辽杏→山杏[9],从普通杏这一最原始的植物学种到山杏的进化过程中,基因组大小没有明显的变化,与沈慧等[23]在枣属植物上的研究结果不一致,酸枣到枣的进化中则可能伴随着基因组的缩减。“C值悖论”认为基因组的大小和物种的进化复杂度之间没有严格的对应关系[24],因此,杏基因组大小与杏属植物种类进化间的关系有待进一步的研究揭示。
同一种内不同变种类型的基因组大小差异也较大,普通杏的变种陕梅与垂枝山杏及李光杏类型(赛买提、大优佳和皮乃孜)的基因组大小差异均显著,且李光杏类型中的赛买提和皮乃孜与大优佳的基因组大小差异亦达显著水平,其中陕梅的基因组是所测13份杏材料中基因组最大的,达到了300.60 Mb。以李光杏类型中的大优佳品种为例,与普通杏变种陕梅进行比较,二者植物形态也差异较大,花、果实和叶片都明显不同。陕梅杏在杏属中花朵最大、花瓣最多、开花期最迟,适宜观赏,很少结果实;属于李光杏变种的大优佳的最大特点是果实表面光滑无毛,果实小,含糖量高,叶片小而厚,抗旱性强[25]。基因组大小与其表型性状有着复杂的关系。关于基因组大小与植物表型之间的相关性研究较少,目前比较确定的观点认为,基因组大小和细胞大小呈正相关关系[24,26]。DNA含量通过影响细胞大小和有丝分裂周期时间而影响表型,特别是在植物进化和适应性方面起着关键作用[17]。Knight等[27]研究得出相似的结果,基因组大小与细胞体积的大小、保卫细胞的长度以及表皮细胞面积等表型性状相关性较强,而与单位面积叶质量、光合作用效率等表型相关性较弱。本研究基因组相对较小的大优佳杏原产我国新疆地区,新疆光照强、干旱少雨,为了适应这种自然环境,叶片变小、变厚,可能是由于叶片细胞体积的大小、保卫细胞的长度以及表皮细胞面积变小的结果。而细胞的大小是为了适应于基因组大小的改变而形成的被动改变[24]。基因组相对较大的陕梅杏花朵较大,其细胞大小是否大于同属的其他种类和品种,仍有待进一步的研究。本研究对杏5个种或类型的13个变种或品种基因组大小的测定研究,可为杏属植物基因组、转录组和资源的鉴定及分类等方面的深入研究提供参考。

