高血压合并2型糖尿病患者大血管病变的影响因素分析及对策
宋国良 万珍英 谢 樱
1.南昌市第三医院心血管内科,江西南昌 330001;2.南昌市第三医院内分泌科,江西南昌 330001;3.江西省鄱阳县人民医院麻醉科,江西鄱阳 334000
经流行病学调查发现,我国高血压人群为28.6%,2 型糖尿病为11.6%,进行门诊诊断时发现30%糖尿病患者伴有高血压,患者出现心血管疾病的风险较两种单一疾病可增加2 倍[1]。而胰岛素抵抗是两种疾病的共同基础,胰岛素抵抗主要是由遗传和环境因素引起的,当机体对胰岛素的生理作用反应性降低,耐糖性受损最终导致糖尿病,引起代谢异常,从而损伤多种器官及功能[1-2]。胰岛素抵抗发生后常伴有高血压、高胰岛素血症,而高胰岛素血症加速动脉粥样硬化的发生与发展,使机体处于一种炎症状态,损伤内皮功能,最终引起大血管疾病的发生[3]。因此,分析胰岛素抵抗对心血管疾病发生、发展的影响,利于寻找有效的放置对策。基于此,本研究旨在探讨高血压合并2 型糖尿病患者大血管病变的影响因素,并寻求对策,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年11月~2019年11月于南昌市第三医院就诊的200 例高血压合并2 型糖尿病患者的临床资料。2 型糖尿病均符合《内科学》[4]中的诊断标准;高血压符合《中国高血压防治指南》[5]中诊断标准。排除1 型糖尿病、脑出血或高血压脑病者。根据颈动脉内膜有无异常变化分为病变组(n=120)和未病变组(n=80)。病变组中,男74 例,女46 例;年龄20~65 岁,平均(43.62±3.12)岁。未病变组中,男48 例,女32 例;年龄24~65 岁,平均(43.59±3.11)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 方法
1.2.1 检查 入组后,测量体重指数(BMI)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)等指标,仪器为TBA-120FR 全自动生化仪;采用西门子ACUSONX+S2000 彩色超声多谱仪检测患者颈动脉、股动脉及腘动脉内膜厚度,查看是否存在斑块。其中颈总动脉中膜厚度(IMT)为各动脉的平均值;稳态模式评估法(HOMA)评估基础状态胰岛素抵抗(HOMA-IR)、胰岛β 细胞功能(HOMA-βF)。若超声显示颈动脉内膜光滑,无斑块形成则为未病变组;若显示总动脉内膜增厚或斑块形成则为病变组。
1.2.2 干预 检查后,将病变组按照干预方式不同为两组,每组各60 例。其中A 组进行常规治疗,包括降压、降糖、降脂、抗凝治疗,FPG 控制<110 mg/dl,血压<130/80 mmHg,体重需减少5%~10%;B 组在此基础上调整生活方式。①控制饮食:定时、定量原则,少食多餐,平衡膳食;②运动疗法:散步、健身操等有氧运动,3~5 次/周,30 min/次,改善胰岛素抵抗水平。均持续干预12 周。
1.3 观察指标
收集患者的临床资料及检查数据,分析高血压合并2 型糖尿病患者发生大血管病变的影响因素,对比干预前、干预12 周患者的情况。
1.4 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用t 检验,不符合正态分布者转换为正态分布后行统计学分析;计数资料用率表示,组间比较采用χ2检验;多因素采用Logistic 回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 病变组和未病变组患者一般资料及各项生化指标情况的比较
病变组和未病变组患者的BMI、FPG、HbA1c 水平比较,差异无统计学意义(P>0.05);病变组患者的FINS、IMT、HOMA-IR、HOMA-βF 水平均高于未病变组,差异有统计学意义(P<0.05)(表1)。

表1 病变组和未病变组患者一般资料及各项生化指标情况的比较[n(%)]
2.2 影响高血压合并2 型糖尿病患者发生大血管病变的多因素Logistic 回归分析
将2.1 中初次经χ2检验单因素分析证实为可能的影响因素纳入自变量,并对其进行赋值(FINS:1=≥55.50 pmol/L,2=<55.50 pmol/L;IMT:1=≥1.10 mm,2=<1.10 mm;HOMA-IR:1=≥3.25%,2=<3.25%;HOMA-βF:1=≥3.40%,2=<3.40%),将发生大血管病变作为因变量,进行Logistic 多因素分析,结果显示,FINS≥55.50 pmol/L、IMT≥1.10 mm、HOMA-IR≥3.25%、HOMA-βF≥3.40%是高血压合并2 型糖尿病患者发生大血管病变的危险因素(OR>1,P<0.05)(表2)。
2.3 病变组患者干预前后效果的比较
干预前,A 组和B 组患者的FINS、HOMA-IR 水平、斑块发生率比较,差异无统计学意义(P>0.05);干预后,B 组患者的FINS、HOMA-IR 水平均低于A 组,差异有统计学意义(P<0.05);两组患者干预后的FINS水平低于干预前,差异有统计学意义(P<0.05);B 组患者干预后的HOMA-IR 水平、斑块发生率均低于干预前,差异有统计学意义(P<0.05);A 组和B 组患者干预后的斑块发生率及A 组干预前后的斑块发生率、HOMA-IR 比较,差异无统计学意义(P>0.05)(表3)。

表2 影响高血压合并2 型糖尿病患者发生大血管病变的多因素Logistic 回归分析
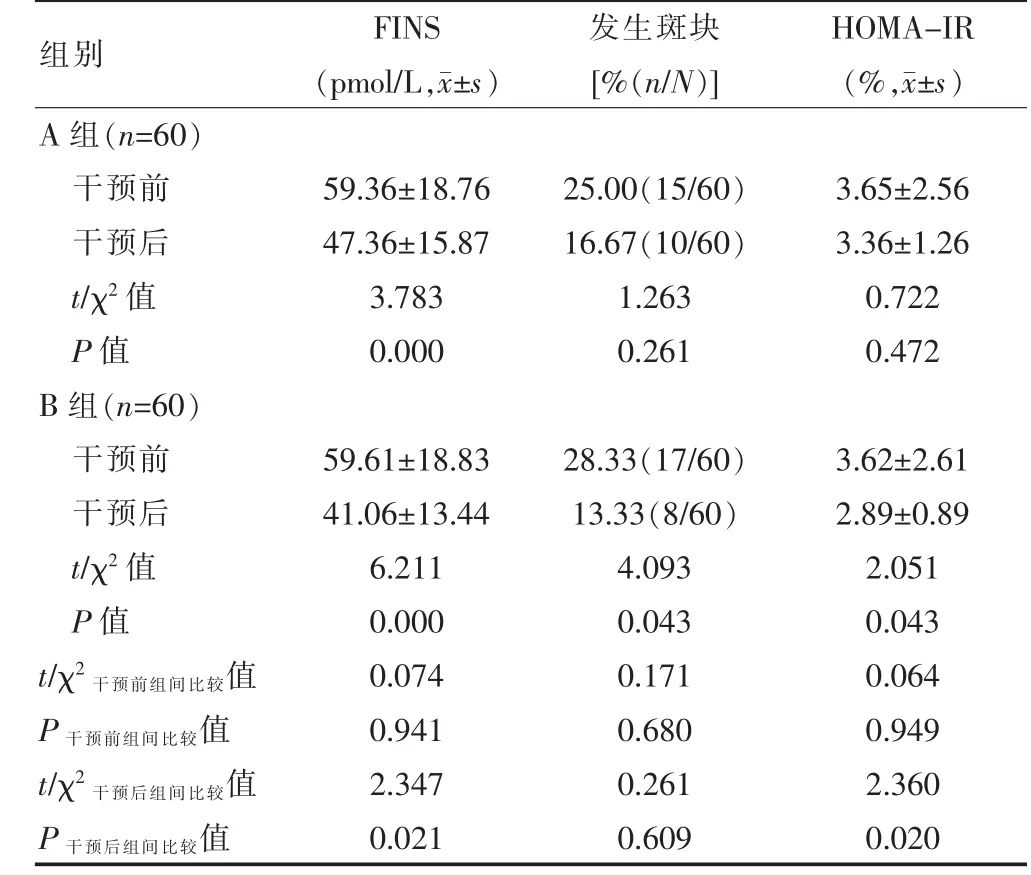
表3 病变组患者干预前后效果的比较
3 讨论
高血压是心脑血管疾病发生的常见危险因素,患者多表现为糖代谢紊乱,可加重血管病变,而肾血管损害又可加重高血压和动脉粥样硬化[6]。目前,高血压伴有糖尿病的患病率为18%,需引起警惕,而高血压出现糖耐量降低和糖尿病患者共同的病理基础为胰岛素抵抗[7]。虽然胰岛素抵抗是一种较为常见的病理生理状态,即胰岛素无法发挥正常的生物作用,实际上是机体的自我保护机制,主要为了保证大脑能量供应[8]。血糖是大脑的能量来源,大脑对葡萄糖具有绝对依赖性,当血糖不足时,机体会启动能量供应机制,但一过性胰岛素抵抗变为持久性胰岛素抵抗,则会造成病理的变化,胰岛素抵抗时高胰岛素血症可促进动脉壁脂质的合成与摄取,防止胆固醇的清除及促进动脉平滑肌细胞的增殖,可诱导和加剧动脉粥样硬化[9-10]。
本研究通过对200 例高血压合并2 型糖尿病患者进行回顾性分析,结果显示,病变组的FINS、IMT、HOMA-IR、HOMA-βF 水平均高于未病变组,多因素Logistic 回归分析发现,FINS≥55.50 pmol/L、IMT≥1.10 mm、HOMA-IR≥3.25%、HOMA-βF≥3.40%是高血压合并2 型糖尿病患者发生大血管病变的危险因素(P<0.05),提示高胰岛素抵抗及IMT 值是高血压合并2 型糖尿病患者发生大血管病变的独立危险因素,因为高血压合并2 型糖尿病患者需有效控制血糖,降低胰岛素抵抗水平,从而降低IMT 值。其中FINS 是评价糖尿病的常见指标,敏感性较强;胰岛素β 细胞的分泌功能与胰岛素抵抗相关,若胰岛素β 细胞的分泌功能能够代偿胰岛素抵抗时,可出现胰岛素血症,不能代偿时进一步加重糖尿病[11]。IMT 增厚可伴有平滑肌细胞和纤维基质成分的增殖,逐渐形成动脉粥样硬化性斑块,从而导致大血管病变,是评价心血管事件发生、预后的指标[12-13]。因而高血压合并2 型糖尿病患者需控制胰岛素水平,并进行及早治疗,以降低大血管病变的风险。目前,除了基础用药治疗外,多采用控制饮食和运动疗法来改善患者的临床症状,患者需控制每日摄入总能量,平衡膳食,同时坚持定时定量的原则,少食多餐;科学进行运动,如采用有氧运动的方式降低血糖,提高机体免疫力,预防并发症发生[14-15]。本研究中,干预后,B 组的FINS、HOMA-IR 水平均低于A 组(P<0.05),提示对高血压合并2 型糖尿病者进行有效的生活干预可改善胰岛素抵抗,延缓大血管病变的进展[16]。
综上所述,FINS≥55.50 pmol/L、IMT≥1.10 mm、HOMA-IR≥3.25%、HOMA-βF≥3.40%是高血压合并2 型糖尿病患者发生大血管病变的危险因素,及早治疗与有效的生活干预可改善胰岛素抵抗,延缓大血管病变的进展。

