全反式视黄酸诱导人视网膜色素上皮细胞凋亡的实验研究△
吴娟 崔冬梅 曾骏文
年龄相关性黄斑变性(age-related macular degeneration,AMD)是视网膜黄斑区光感受器细胞凋亡导致中心视力缺失的一种眼部疾病。AMD的光感受器凋亡主要由于视网膜色素上皮(retinal pigment epithelial,RPE)细胞失去向光感受器提供氧气和营养并运走废物的功能导致的[1]。氧自由基堆积引起RPE细胞损伤,是AMD发病的主要原因。全反式视黄酸(all-trans retinoic acid,ATRA)是视觉循环中不可缺少的部分,但ATRA代谢障碍引起RPE细胞毒素及活性氧(ROS)生成脂褐素的积累,造成光感受器细胞和RPE细胞的凋亡[2-5],在眼底变性疾病的病因中起重要作用。先前的研究已证明[6-8],ROS的产生可以由ATRA诱导,并通过NAPDH氧化酶介导,参与光感受器和RPE的退化。但ATRA引起RPE变性的内在分子机制尚未完全清楚。本研究通过从分子水平探讨梯度浓度ATRA诱导RPE细胞凋亡,旨在对AMD等以 ATRA 清除延迟为特征的视网膜病变有更深入的了解。
1 材料与方法
1.1 材料ARPE-19细胞(美国ATCC细胞库);DMEM/F12培养基(美国Gibco公司);胎牛血清、ATRA(美国Sigma公司);Annexin V凋亡试剂盒(美国Becton公司);ROS检测试剂盒、ECL流式检测系统、Western blot检测系统(美国默克公司); Trizol试剂(美国Invitrogen 公司);Brilliant SYBR Green 试剂盒(日本Takara公司);引物序列(上海生工科技公司);抗BIP抗体(CST3177)、 抗VEGF-A抗体(ab46154)、抗CHOP抗体(CST 2895)、抗GAPDH抗体(CST5174)、Powerwave XS微孔板分光光度计(美国BioTek公司);Bio-Rad Quantity One成像软件(美国Bio-Rad公司);酶标仪(日本Olympus公司);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 ARPE-19细胞培养ARPE-19细胞常规复苏后,将细胞置于含体积分数10%胎牛血清的DMEM培养液中,于CO2恒温培养箱中培养,细胞融合至80%时进行传代,取3~6代细胞用于实验。
1.2.2 CCK-8法检测RPE细胞存活率将ARPE-19细胞密度调至50×103个· mL-1后置于96孔板中,每孔90 μL混悬液,细胞约为5000个,96孔板设置空白对照组(培养液+CCK-8检测试剂)、实验组(培养液+不同浓度ATRA+ CCK-8检测试剂),在含有100 g·L-1BSA的DMEM/F12中预培养24 h后,用10 μL ATRA在不同梯度浓度(0 μmol·L-1、2 μmol·L-1、4 μmol·L-1、6 μmol·L-1、8 μmol·L-1、10 μmol·L-1、12 μmol·L-1、14 μmol·L-1、16 μmol·L-1、18 μmol·L-1和20 μmol·L-1)下进行实验,仅含有培养基的作为空白对照。培养24 h或48 h后,去除上清液,每孔加入含有10 μL CCK-8的100 μL DMEM/F12。然后将平板在37 ℃下再培养4 h。采用CCK-8法检测各组细胞增生情况,使用微孔板阅读器在450 nm处测量吸光度(D)值。所有实验均重复3次。
1.2.3 流式细胞仪检测RPE细胞凋亡水平采用Annexin V凋亡试剂盒检测RPE细胞凋亡。取ARPE-19细胞以25×106个· mL-1接种于6孔板,用不同浓度(0 μmol·L-1、2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、15.0 μmol·L-1和20.0 μmol·L-1)ATRA分别处理ARPE-19细胞24 h后收集细胞,使用2.5 g·L-1胰蛋白酶消化收集细胞,用预冷PBS洗1次,离心收集细胞,并将其悬浮在含有Annexin V和碘化丙啶(PI)的1×结合缓冲液中30 min,暗室,用流式细胞仪在488 nm激发波长下检测红色荧光及光散射情况,根据阴性对照组设定阴性对照区,并进行固定分区,分为死细胞区、晚凋细胞区、早凋细胞区、活细胞区,流式细胞仪检测各分区的数值,列入统计计算的为死细胞区+晚凋细胞区+早凋细胞区。所有实验均独立重复 3次。
1.2.4 流式细胞仪检测ROS水平使用DCFH-DA染色法测试总ROS的产生。取ARPE-19细胞以0.25×106个· mL-1接种于6孔板,用不同浓度的ATRA(0 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、15.0 μmol·L-1和20.0 μmol·L-1)分别处理ARPE-19细胞24 h后,使用2.5 g·L-1胰蛋白酶消化收集细胞,用预冷PBS洗1次,离心收集细胞,每组加入1 μmol·L-1ROS和荧光探针DCFH-DA孵育30 min,用流式细胞仪在488 nm激发波长下检测红色荧光及光散射情况,红色波形代表ROS阳性细胞,统计阳性细胞数值。所有实验均独立重复3次。
1.2.5 Western blot检测靶蛋白表达取ARPE-19细胞以0.25×106个· mL-1接种于10 cm的培养皿中进行下面检测:(1)检测ERS标记蛋白实验:用不同浓度的ATRA(0 μmol·L-1、2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、15.0 μmol·L-1和20.0 μmol·L-1)分别处理ARPE-19细胞24 h后收集细胞,并按浓度分为6组,包括对照组和5个浓度实验组。(2)检测抗氧化剂NAC和ERS抑制剂Salubrinal抑制实验:ATRA工作浓度为10 mmol·L-1,抗氧化剂NAC工作浓度为5 mmol·L-1,Salubrinal为ERS抑制剂,工作浓度为40 μmol·L-1,均无细胞毒性。设5组,即对照组、模型组(ATRA处理组)、NAC-ATRA处理组、Salubrinal-ATRA处理组和NAC-Salubrinal-ATRA联合处理组,经处理24 h后收集细胞。用PBS洗涤细胞,用RIPA裂解缓冲液溶解,然后在4 ℃以14 000 r·min-1离心15 min。上清液蛋白采用SDS-PAGE凝胶电泳。转膜,并在室温下用50 g·L-1脱脂牛奶封闭1 h。分别加入BIP(11000)、VEGF-A (11000)、CHOP(11000)和GAPDH(1500),于4 ℃过夜后漂洗;加入与辣根过氧化物酶(HRP)结合抗兔或抗鼠二抗(1400),37 ℃下孵育1 h。用ECL Western blot检测系统观察条带,并使用Bio-Rad Quantity One成像软件分析条带,结果纳入统计。所有实验均重复3次。

2 结果
2.1 不同浓度ATRA处理后ARPE-19细胞形态变化0 μmol·L-1、2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、20.0 μmol·L-1ATRA处理ARPE-19细胞24 h发现,ATRA浓度在2.5 μmol·L-1和5.0 μmol·L-1时细胞形态保持正常;ATRA浓度在10.0 μmol·L-1时细胞开始皱缩;当ATRA浓度达到20.0 μmol·L-1时细胞皱缩明显,数量显著下降(见图1)。

图1 不同浓度ATRA对ARPE-19细胞形态的影响 A、B、C、D、E分别表示0 μmol·L-1、2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、20.0 μmol·L-1ATRA处理后ARPE-19细胞形态的变化
2.2 CCK-8检测ARPE-19细胞活性CCK-8检测结果显示:ATRA在2.0~6.0 μmol·L-1时促进细胞生长,但在10.0~20.0 μmol·L-1时显著抑制细胞生长,20.0 μmol·L-1ATRA处理后细胞存活率下降到30%以下。培养24 h和48 h后,ATRA均表现出剂量依赖性的细胞存活效应,低剂量增加存活率,高剂量抑制存活率。经不同浓度ATRA处理细胞24 h和48 h后,半数最大抑制浓度(IC50)分别为13.88 μmol·L-1和11.99 μmol·L-1(见图2)。
2.3 流式细胞术检测细胞凋亡水平经不同浓度ATRA处理24 h后,当ATRA浓度为2.5 μmol·L-1及5.0 μmol·L-1时,ARPE-19细胞凋亡水平均对照组下降,当ATRA浓度为10.0 μmol·L-1、15.0 μmol·L-1和20.0 μmol·L-1时,ARPE-19细胞凋亡水平均较对照组呈浓度依赖性升高,差异均有统计学意义(均为P<0.001)(见图3)。

图2 不同浓度ATRA对ARPE-19细胞存活的影响CCK-8检测细胞经不同浓度ATRA处理后24 h及48 h的存活率(相对于对照组)
2.4 流式细胞术检测细胞ROS水平当ATRA浓度分别为2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、20.0 μmol·L-1时,与对照组相比,ARPE-19细胞内ROS的生成显著增加,差异均有统计学意义(均为P<0.001)(见图4)。当ATRA浓度高于10.0 μmol·L-1时,ARPE-19细胞凋亡明显增加。因此,10.0 μmol·L-1ATRA被用作实验浓度。
2.5 ATRA诱导ARPE-19细胞引起ERS反应CHOP、BIP为ERS的标志性蛋白。Western blot检测结果显示,用不同浓度的ATRA(0 μmol·L-1、2.5 μmol·L-1、5.0 μmol·L-1、10.0 μmol·L-1、15.0 μmol·L-1和20.0 μmol·L-1)处理ARPE-19 细胞24 h后,ARPE-19细胞内CHOP蛋白、BIP蛋白表达随着ATRA浓度累积而上调(见图5)。

图3 流式细胞术检测ATRA诱导细胞凋亡水平 A:采用Annexin V/PI染色,流式细胞术检测细胞凋亡水平;B:细胞凋亡水平定量分析;与对照组相比,***P<0.001

图4 流式细胞术检测ATRA诱导ARPE-19细胞ROS水平 A:采用FITC-A染色,流式细胞术检测ARPE-19细胞内ROS水平;B:定量分析;与对照组相比,***P<0.001
2.6 NAC和Salubrinal对ATRA诱导的VEGF-A、CHOP蛋白的抑制作用对照组、模型组、NAC-ATRA处理组、Salubrinal-ATRA 处理组和NAC-Salubrinal-ATRA联合处理组治疗24 h后,进行Western blot检测结果显示(见图6A),与对照组相比,模型组中ATRA能显著增加ARPE-19细胞CHOP蛋白和VEGF-A蛋白的表达,而NAC-ATRA处理组、Salubrinal-ATRA处理组及NAC-Salubrinal-ATRA联合处理组能显著抑制ATRA诱导的ARPE-19细胞CHOP蛋白和VEGF-A蛋白的表达升高(见图6B、6C)。
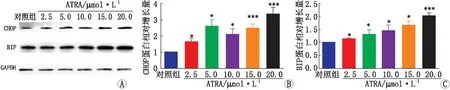
图5 Western blot检测ARPE-19细胞中CHOP蛋白和BIP蛋白的表达水平 A:蛋白表达情况;B: CHOP蛋白定量分析;C:BIP蛋白定量分析。与对照组相比,*P<0.05,***P<0.001

图6 Western blot检测ARPE-19细胞中CHOP蛋白和VEGF-A蛋白的表达水平 A:蛋白表达情况;B: VEGF-A蛋白定量分析;C:CHOP蛋白定量分析。a、b、c、d、e分别代表对照组、模型组、NAC-ATRA处理组、Salubrinal-ATRA处理组和NAC-Salubrinal-ATRA联合处理组;Sa=Salubrinal;与模型组相比,*P<0.05,***P<0.001
3 讨论
视黄酸对视觉的发育至关重要,包括ATRA和9-顺式视黄酸两种主要的活性形式。ATRA和其他自由形式的视网膜醛可以作为功能性视觉循环的中间产物存在,而不会造成视网膜的损害[9],但如果不能清除ATRA,则导致其在RPE中积聚,造成视网膜损害,从而严重影响视力[10]。本研究结果显示ATRA过度积累造成了RPE细胞的损伤。在ATRA暴露超过10.0 μmol·L-1后24 h,ARPE-19细胞中ROS的产生较对照组显著升高,并出现明显的RPE细胞死亡现象。作为视网膜内的内源性化合物,ATRA通常被消除,或形成一系列视网膜衍生的化合物,这些化合物主要被困在RPE溶酶体中[11-12],这解释了为什么RPE可以耐受低浓度的ATRA,光感受器和RPE细胞显示了清除游离ATRA的内在机制,但ATRA在RPE细胞内累积到临界浓度时,它可能最终影响RPE。本研究中,用ATRA处理培养的RPE细胞模拟了急性和强烈的光照或ATRA清除的破坏导致RPE中的视黄酸过度沉积的体内条件[13]。
有研究表明[8],ATRA可以通过抑制线粒体氧化和产生一定浓度的解偶联氧化磷酸化剂,直接作用于线粒体并引起其毒性效应。ATRA对线粒体膜的通透性可能引起重要酶的渗漏,从而导致线粒体功能紊乱。此外,ATRA诱导的胞质内ROS生成直接攻击细胞器,引起严重的细胞损伤。同样,细胞内ROS可直接诱导内质网损伤。
ERS是影响AMD发病机制的主要因素之一[14]。ERS和未折叠蛋白反应(UPR)可由AMD危险因素(如氧化、蛋白质毒性和代谢应激)和细胞因子的存在引起,已在视网膜变性的背景下进行了研究,特别是在RPE中错误折叠的蛋白质方面[15]。UPR的主要功能是维持正常的内质网功能和保护细胞免受环境损伤[16],其中大部分和ERS相关的途径是由BIP调节的[17-18]。这个重要的内质网伴侣防止错误折叠和未折叠蛋白的积累[19],其表达是由ERS和错误折叠蛋白触发的[20]。本研究中,BIP在ATRA处理的ARPE-19细胞中的表达水平升高。关于UPR的信号途径,ERS传感器引发的三种途径(PERK、IRE1α和ATF6)在细胞ERS反应方面最受关注[21]。CHOP是ERS时ATF4转录因子的主要靶点和细胞凋亡的执行者[22]。有研究表明CHOP在ERS期间介导了Ero1α表达的激活,从而加重了应激细胞内质网中ROS的积累[23]。本研究中,我们观察到ATRA处理后ARPE-19细胞中CHOP蛋白表达水平增加,但NAC预处理减弱了这种作用,表明NAC通过下调CHOP蛋白表达水平抑制了ERS激活的细胞凋亡。
本研究还观察到ATRA引起血管新生标志物VEGF-A蛋白的表达上调。视网膜中VEGF-A蛋白的过度表达影响脉络膜毛细血管中的细胞,并刺激视网膜下新生血管形成,这是AMD的特征[24]。VEGF的激活与ROS密切相关,ROS通过抗氧化反应元件(ARE)增强剂增强细胞保护基因的表达[25]。本研究中,Salubrinal降低了ATRA诱导的VEGF-A蛋白表达水平,这进一步表明ROS和ERS的作用不是完全独立的,而是相互作用的。
综上所述,ATRA的过度积累会导致ARPE-19细胞产生ROS和ERS,这是影响AMD发生发展的相关因素,因此,ATRA的减少可能是治疗AMD的另一个好方法。由于ATRA和氧化应激的协同细胞毒性作用,基于抑制视网膜代谢途径的AMD新治疗策略具有很大可能性。

