QL1101联合紫杉醇、卡铂一线治疗非鳞状非小细胞肺癌的有效性和安全性研究
黄成,倪秉强,李敏,林诚
(柳州人民医院,广西 柳州)
0 引言
恶性肿瘤是严重威胁中国人群健康的主要公共卫生问题之一。全国肿瘤登记中心数据显示,恶性肿瘤发病顺位前五位分别为肺癌、胃癌、结直肠癌、肝癌、乳腺癌,而肺癌占所有恶性肿瘤的20.5%[1]。肺癌患者的5年存活率仅为10%-15%,可引起严重的伤残、早死等,给社会带来严重负担[2]。肺癌根据组织学分类分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。绝大多数肺癌中NSCLC约占85%,其包括非鳞癌(腺癌、大细胞癌和其他)、鳞癌,而非鳞癌的预后不乐观,大部分患者一经诊断及为ⅢB 或Ⅳ期肺癌,失去手术指征[3]。因此,全身治疗是非鳞状NSCLC治疗体系的重要组成部分。
近年来,靶向药物在治疗晚期NSCLC显示出较好的疗效,并在临床上被广泛推广,其中包括靶向血管内皮生长因子(VEGF)的单克隆抗体类药物如贝伐珠单抗。贝伐珠单抗可通过竞争性抑制VEGF与其受体结合,抑制血管生成,从而抑制肿瘤细胞的生长[4,5]。然而,贝伐珠单抗由美国研发上市,进口价额昂贵,极大限制了该药应该和普及。为了满足国内临床需要及减轻肺癌患者的经济负担,齐鲁制药有限公司研发了贝伐珠单抗的生物类似药重组抗 VEGF人源化单克隆抗体注射液(QL1101)[6]。本研究通过对QL1101与贝伐珠单抗分别联合紫杉醇、卡铂一线治疗非鳞状NSCLC的有效性和安全性进行评价,为QL1101在临床上推广提供理论依据。
1 资料与方法
1.1 临床资料
柳州人民医院是齐鲁制药有限公司开展的QL1101Ⅲ期临床研究中心之一。选择该中心2017年08月18日至2018年4月16日入组的13例非鳞状NSCLC患者作为研究对象,经随机化与试验药物管理系统实现中央随机化分为贝伐珠单抗组(4例)和QL1101组(9例)。本研究已通过本院伦理委员会批准,临床试验批件号:2015L02215、2015L02242。受试者在试验前对本研究知情同意,并自愿签署知情同意书。
1.2 纳入标准
1)18周≤年龄≤75周;2)经组织学或细胞学证实的不能手术治疗的局部晚期、转移性(IV 期)或复发性非鳞状细胞非小细胞肺癌患者,至少有一次可测量病灶。3)ECOG评分为0-1分;4)未接受过局部晚期或转移性非鳞状NSCLC抗肿瘤治疗;5)预期寿命≥24 周;6)血液学参数满足:嗜中性粒细胞绝对值(ANC)≥1.5×109/L;白细胞≥3.0×109/L;血红蛋白≥90g/L;血小板≥100×109/L;7)肝功能满足以下条件:总胆红素≤1.5×ULN;谷草转氨酶≤2.5×ULN(无肝转移);谷丙转移酶≤2.5×ULN(无肝转移);谷草转氨酶≤5×ULN(有肝转移);谷丙转移酶≤5×ULN(有肝转移);8)肾功能满足:血清肌酐≤1.5×ULN;或肌酐清除率计算值≥50mL/min;且尿蛋白<2+;9)凝血功能满足以下条件:国际标准化比率(INR)≤1.5;且部分促凝血酶原时间(PTT 或aPTT)≤1.5×ULN;10)心功能满足以下条件:左心室射血分数(LVEF)≥50%(心脏彩超)。
1.3 排除标准
1) 中央型鳞状细胞癌、以鳞状细胞为主的混合性腺鳞癌;2) 已知ALK 融合基因阳性;3)筛选前6个月内有血栓性疾病;4) 影像学显示有肿瘤侵入大血管迹象的患者;5) 有症状的脑转移或脑膜转移,或有脊髓压迫史;6)治疗前2周内对胸部之外的骨病灶进行姑息放疗的患者;7) 筛选前28天内接受过较大的手术操作或治疗前 48h 之内进行过较小手术及近期有服用具有影响凝血功能的药物,具有出血倾向;8)具有心血管疾病;9)非治愈性伤口、处于活动期的消化性溃疡或骨折;10)筛选前 6 个月内有肠瘘、胃肠道穿孔,或腹腔内脓肿的病史;11)孕妇和哺乳期妇女;12)筛选前28天内受其它试验药物治疗;13)已知对治疗药物成分过敏;14)活动性感染迹象;经检查出现禁忌使用研究药物或使患者处于治疗有关并发症;15)在筛选前5年内患有 NSCLC 以外的恶性肿瘤;16)在筛选前3个月内有咯血史;17)HIV、 HCV、梅毒阳性者或乙肝表面抗原(HBsAg)阳性者。
1.4 研究用药
重组抗 VEGF 人源化单克隆抗体注射液(QL1101,规格:100mg:4mL/瓶,齐鲁制药)、贝伐珠单抗注射液(规格:100mg:4mL/瓶,Roche Pharma (Schweiz) Ltd)、紫 杉 醇 注 射液(规格:5mL:30mg,北京协和制药)、卡铂注射液(规格:100mg/支,齐鲁制药)。
1.5 方法
本研究为随机、双盲、阳性药对照研究。由一名非盲态的研究护士进行药物配制。当数据录入完毕,进行数据分析时揭盲。
治疗方法:QL1101组:QL1101,15mg/kg,静脉输注,静滴90min;贝伐珠单抗组:贝伐珠单抗注射液,15mg/kg,静脉输注,静滴90min。同时,两组均联合:1)紫杉醇,175mg/m2,静脉输注;2)卡铂,AUC=5.0mg/mL/分钟,静脉输注。以上所用药3周为一个治疗周期,每个周期的第一天给药,在没有出现PD、无法耐受的毒性反应、撤回知情同意书、失访或死亡的情况下,治疗6个周期。联合化疗治疗期完成后,经研究者评估,未进展的受试者继续接受 QL1101 15mg/kg,3 周一个治疗周期,直至者死亡、失访、不能耐受的毒性、研究结束、使用其他抗肿瘤处方药物、退出研究等。
1.6 血清肿瘤标志物的检测
患者入组前及因疾病进展出组或研究结束时进行血清肿瘤标志物检测。检测试剂盒购于罗氏公司,采用罗氏Cobas E601全自动电化学发光免疫分析仪检测,并按照试剂盒说明书严格操作。
1.7 研究评价
1.7.1 肿瘤评估及临床疗效评价
基线时需完成头部、胸部(至肾脏)CT检查,腹部和盆腔 B 超检查(如有病灶,则需进行 CT检查)。首次用药后,每 6 周±7 天进行一次CT检查,直至疾病进展、进行其他抗肿瘤药物治疗、研究终止、失访、死亡或研究结束。检查结果由处于盲态的临床研究者按 RECIST 1.1进行肿瘤评估,确认患者是否可以继续研究治疗。研究者同时对结果进行评价,获得PR(部分缓解:病灶大小较少50%以上,至少维持4周)、SD(病情稳定:病灶最大径之和缩小未到PR,或增大未达PD)、PD(疾病进展:病灶增大>25%,或出现新病灶)、ORR(总缓解率:经过治疗CR+PR病人总数占总病例数的比例)。
1.7.2 不良事件及严重不良事件
研究者每个周期记录患者生命体征,并对患者进行体格检查及临床实验室检查,获得不良事件及严重不良事件。不良事件:受试者入组后使用研究药物期间发生的不良医学事件或者研究开始前存在的医学情况或疾病,在研究开始后恶化。严重不良事件:使用任何剂量的研究药物后发生的任何不利的医学事件(不一定与研究药物有因果关系)并符合以下标准之一:1)致死亡;2)危及生命;3)需要住院治疗或者延长住院时间;4)导致永久或者严重残疾/能力丧失。
1.8 统计学分析
采用SPSS 23.0统计学软件处理数据。计数资料用Fisher确切概率法进行数据分析。计量资料不满足正态分布用中位数(四分位数)表示,采用秩和检验分析。生存分析log-rank检验进行两组间比较分析。检验水准α=0.05(双侧)。
2 结果
2.1 两组患者的临床疗效比较
两组患者部分缓解率(PR)、病情稳定率(SD)、疾病进展率(PD)和总缓解率(ORR)差异无统计学意义(见表1,P>0.05)。推测两种治疗非鳞状NSCLC 方案的临床疗效可能一致。
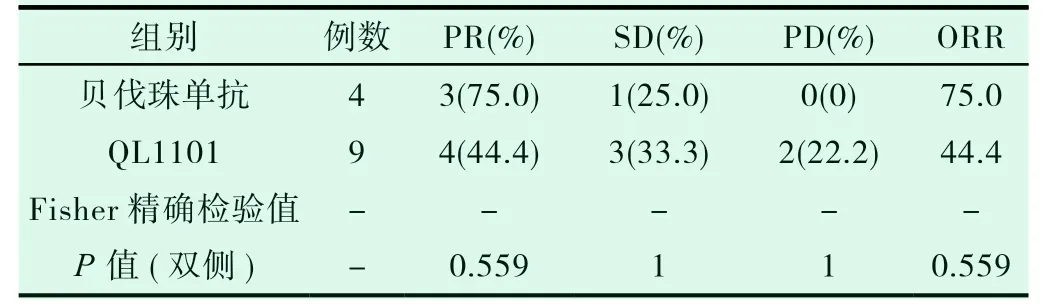
表1 两组患者的临床疗效比较(n/%)
2.2 两组患者肿瘤标志物比较
两组患者癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原199(CA199)和血清细胞角蛋白19 片段(Cyfra21-1)基线水平相似,差异无统计学意义(见表2,P>0.05)。治疗前后两组患者肿瘤标志物的改变水平未见明显差异(见表3,P>0.05),提示两种治疗非鳞状非小细胞肺癌的方案对肿瘤标志物的影响相近。
2.3 两组患者疾病进展生存分析
试验组(QL1101组)中位无进展生存期为31±12.45周,对照组(贝伐珠单抗组)中位无进展生存期27±4.58周,两组比较差异无统计学意义(见图1,P=0.65)。
2.4 两组患者不良事件发生率比较
两组患者不良事件发生率比较,差异无统计学意义(见表4,P>0.05)。两组患者严重不良事件率比较,差异无统计学意义(见表5,P>0.05)。提示两种治疗非鳞状非小细胞肺癌的方案引起不良反应的发生率相近。

表2 两组患者肿瘤标志物的基线水平比较
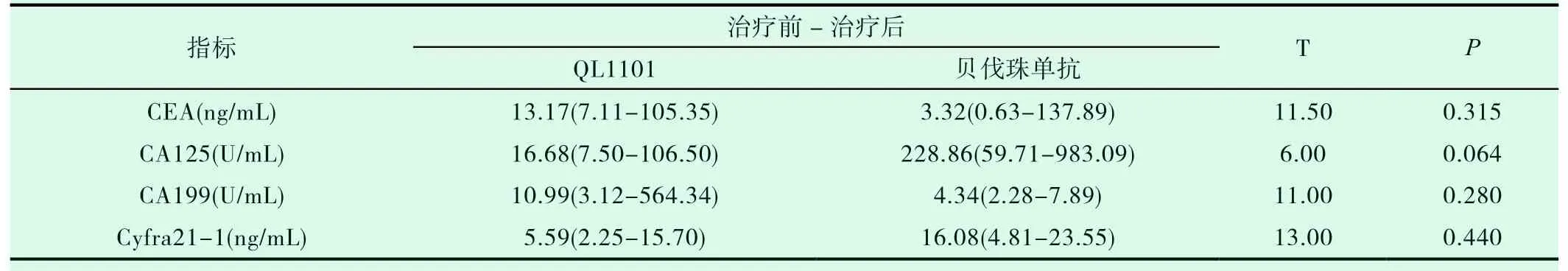
表3 治疗前后两组患者肿瘤标志物的改变情况比较

表4 两组患者不良事件发生率比较(%)
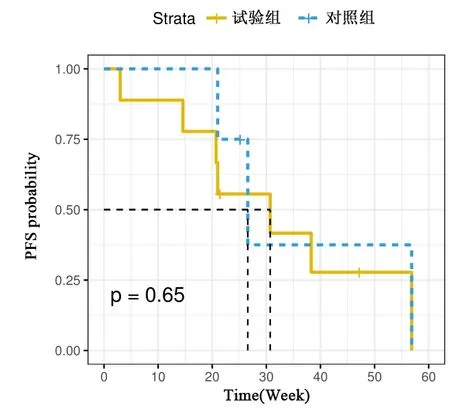
图1 两组患者无进展生存期的Kaplan-Meier曲线
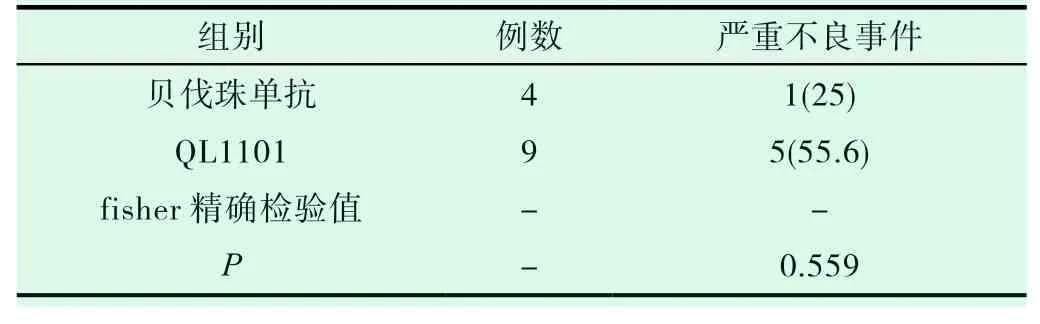
表5 两组患者严重不良事件的发生率比较(%)
3 讨论
恶性肿瘤严重危害全人类的健康。全球最新的癌症数据显示,2018年癌症新发病例约1808万例,死亡病例约956万例,而肺癌高居榜首[7]。在我国全国肿瘤登记中心最新数据显示,2014年因癌症导致的死亡数达229.6万例,癌症死亡率为168.0/10万[8]。而肺癌长期占据我国癌症发病和死亡第一位。2014年全国肺癌的新发病例数为78.1万,占所有癌症的20.5%[8]。因此,对肺癌的防控是恶性肿瘤防控的重中之重。然而,美国SEER数据库显示,57%肺癌患者在初诊时就发现有远处转移[9],失去手术指征。所以,晚期患者的治疗是肺癌防控的工作重心。
近年来,晚期肺癌患者的治疗获得较大进展。靶向药物的出现开创了晚期肺癌治疗的新时代,且多个药物已在晚期NSCLC 治疗中显示出了较好的疗效,如靶向血管内皮生长因子(VEGF)的单克隆抗体类药物如贝伐珠单抗等[4],靶向表皮生长因子受体的酪氨酸激酶抑制剂(TKI)[10]。VEGF是血管生成过程中一种重要的因子,与血管表皮细胞上的受体结合后,通过细胞间的信号转导系统,促进血管内皮细胞的扩增、迁移、微管形成和微血管通透,进而诱发血管生成[11]。在正常生理中,血管生成在胚胎发育过程起着重要作用,但在成人体内大多是静止的,只有在创伤愈合和女性生理周期中有短暂的激活[12]。然而,正在生长的实体瘤须要依赖血管形成来提供营养和氧气,并处理代谢废物。因此,通过抑制血管生成来抑制肿瘤的生长成为癌症治疗的一个新的研究靶点[5,12]。贝伐珠单抗是利用重组DNA技术制备的靶向VEGF的人源化单克隆抗体,能通过与 VEGF结合,抑制 VEGF 与其受体结合,阻断了血管生成的信号传导途径,抑制肿瘤细胞生长[5]。2006年东部合作肿瘤组织(ECOG)一项随机研究报道,NSCLC患者化疗(紫杉醇和卡铂)加贝伐珠单抗能显著提高NSCLC患者的生存期[13]。于此,贝伐珠单抗于2006年在美国获批用于治疗NSCLC,并于2007年获批为NSCLC的一线化疗药。国内大量的研究显示,贝伐珠单抗联合化疗治疗晚期非鳞状NSCLC疗效好,不良反应轻[14-16]。但由于生物单抗类药物价格昂贵且进口关税高等因素,严重限制贝伐珠单抗的在国内的临床使用。
为了满足国内临床需要及减轻肺癌患者的经济负担,齐鲁制药有限公司研发了重组抗 VEGF 人源化单克隆抗体注射液QL1101。QL1101是一种能特异性结合人 VEGF 的单克隆抗体,即贝伐珠单抗的生物类似药。据报道,QL1101在健康的受试者中药代动力学与贝伐珠单抗等效,且受试者静脉注射3mg/kg安全可耐受[6]。本研究发现贝伐珠单抗组和QL1101组部分缓解率、疾病稳定率和疾病进展率均未见显著差异,提示两种化疗药对治疗非鳞状NSCLC疗效一致。此外,肿瘤标志物水平在癌症诊断及评价肿瘤的治疗效果上有着重要的意义。有研究报道,癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原199(CA199)和血清细胞角蛋白19 片段(Cyfra21-1)联合检测可辅助诊断肺癌及评价肺癌治疗效果[17,18]。本研究发现QL1101联合紫杉醇和卡铂一线治疗非鳞状NSCLC患者对CEA、CA125、CA125和Cyfra21-1的影响与贝伐珠单抗相近。由此,推测QL1101治疗非鳞状NSCLC患者的疗效与贝伐珠单抗相似。此外,由于化疗开始后,患者常常因出现相关的不良反应甚至危及生命而可能导致化疗药物剂量调整或暂停甚至终止化疗。常见毒副作用如胃肠道副作用(恶心、呕吐等)、血液系统副作用(骨髓抑制、出血等)、肝肾功能异常及其他副作用(如关节肌肉痛、发热等)[19]。因此,为了减少不良反应的发生,需要选择毒副作用更少的临床化疗药。本研究以贝伐珠单抗作为对照,来评价QL1101治疗非鳞状NSCLC患者的安全性。研究发现,QL1101导致不良事件(白细胞减少、消化道症状、肝功能异常、电解质紊乱、发热等)的发生率与贝伐珠单抗相近。
综上,本研究发现QL1101联合紫杉醇、卡铂一线治疗非鳞状NSCLC的有效性与安全性与贝伐珠单抗相近,值得临床上推广。但是由于本研究中心纳入样本量小,仍需更大的样本量加以验证。

