国外患者倾听机制在医药产品生命周期中的应用及对我国的启示
谢烛光,周 茜
(中国药科大学国际医药商学院,江苏 南京 211198)
随着人均寿命及经济水平的提高,为满足人们日益增长的生活质量需求,倾听患者声音在医药产品全生命周期中受到了越来越多的重视。以往医药产品发展往往存在患者诉求盲点,某些疾病患者长期生活质量不高。目前,美国和欧盟监管机构或制药企业均已在全产品生命周期倾听患者声音,致力于在提升患者生活质量的同时,提升药品研发效率。中国人口基数大,创新医药产品势头强,信息产业发展蓬勃,开展患者声音倾听活动并将其运用至医药产品开发与审评工作中,是可行且必要的。2020年4月,国家药监局在新版《药品注册管理办法》中,强调我国药品审评审批应与国际接轨,体现“以人为本,以患者为中心”的人文价值观。目前,我国某些疾病患者组织及制药企业已开始收集患者声音,我国医药产品监管机构也在强调提升患者就医体验的以患者为中心的医疗服务提供。但目前患者体验提升仅在就医层面,包括减少患者候诊时间、为患者提供开放信息查询平台等。本文通过梳理美国、欧盟医疗监管机构倾听客户声音体系建设,针对性地为我国倾听患者声音活动提出相应建议。
1 患者声音的全产品生命周期贡献
信息时代,患者对于疾病特征以及治疗方案相较于以往有了更多的认识,也逐步从源头参与医药产品开发。患者声音可包括患者对疾病或治疗方案在生理与心理的体验、对治疗方案或医疗产品的想法、需求、偏好等。在医药产品开发的最初时点便聆听患者声音,可结合定性与定量方法,洞察患者未被满足的需求,发现患者潜在需求。
患者声音的运用可贯穿于医药产品全生命周期。从临床试验前的发现与开发阶段,到临床试验阶段,再到上市后监管阶段,患者声音信息向不同主体提供了分阶段差异信息。
临床试验前作用及影响主要包括4个方面:①识别疾病负担、现有治疗方案及用药方式体验、患者的未满足需求;②了解疾病诊断过程、疾病可治疗性等信息;③识别特定疾病的主要影响因素;④了解进行临床试验的潜在障碍。临床试验中的作用及影响主要包括8个方面:①开发目标产品档案(Target Product Profile,TPP),包括产品的预期用途、目标人群、安全性和有效性等信息;②帮助临床试验设计方案、受试者选择依据、保留策略的制定;③影响临床结果评估指标的选择、设计,以及评估的实施过程;④有利于识别治疗方案的亮点;⑤识别患者对治疗方案的偏好和满意度;⑥预测与测算患者对医药产品依从性;⑦患者舒适度;⑧影响监管机构与投资者协商。上市批准后的作用及影响主要有3个方面:①标准护理评估;②临床实践中患者报告的结果(PRO);③患者支持调查等。
在医药产品开发阶段,通过倾听患者声音,从患者自主诉说的诉求体验信息,分析患者疾病承受过程中未实现的需求,该需求包括治疗方案开发、优化等,可为新医药产品研发方向提供建议。在医药产品临床试验阶段,患者声音可帮助开发TPP、识别新治疗方式的亮点、选择与设计临床试验结果评价指标等,以提升临床终点指标与患者偏好的匹配度。在医药产品上市评估阶段,医药产品监管机构也会在考虑医药产品安全、有效的基础上,关心患者中心指标,以期提升患者舒适度及其生活质量。在医药产品上市后阶段,倾听患者声音可发现医药产品使用中出现的问题,追踪患者需求变化,进一步提升医药产品质量。
2 美国和欧盟患者声音收集
美国与欧盟正积极、广泛地开展患者声音收集活动,患者声音的收集主体包括监管机构、微观企业以及公私联盟组织(Public/Private Partnerships)。
2.1 美国患者声音收集
美国食品药品监督管理局(FDA)于2012年建立了以患者为中心的药品开发计划(PFDD),致力于更系统地了解患者对特定疾病与其现有治疗方案的看法[1,2]。自2012年以来,FDA通过举行PFDD会议的方式收集患者声音,目前共收集并公布了26种特定疾病的患者声音[3]。同时,FDA认为,仅通过召开PFDD会议并不能很好地收集患者声音,于是FDA正致力于构建患者声音倾听的方法学体系,该方法学指南已于2018年推出第一版草案[4]。
FDA不仅单独收集患者声音,也会和美国私人组织合作。如关键路径研究所(C-Path)和临床试验转化计划(CTTI),两者分别致力于药物开发过程的改善与临床试验质量和效率的提升。
2.2 欧盟患者声音收集
欧洲药品管理局(EMA)主要通过将患者纳入科学咨询工作组(SAWP)以倾听患者声音,2011-2016年,加入EMA的患者人数增加了82%[5]。EMA对药品的全流程监管中也将患者纳入监管机构中[6],包括孤儿药委员会(COMP)、先进疗法委员会(CAT)、人类用药委员会(CHMP)、科学咨询工作组(SAWP)、儿科委员会(PDCO)、科学咨询小组(SAG)、药物警戒风险评估委员会(PRAC)等。EMA中患者参与监管的分布见图1。
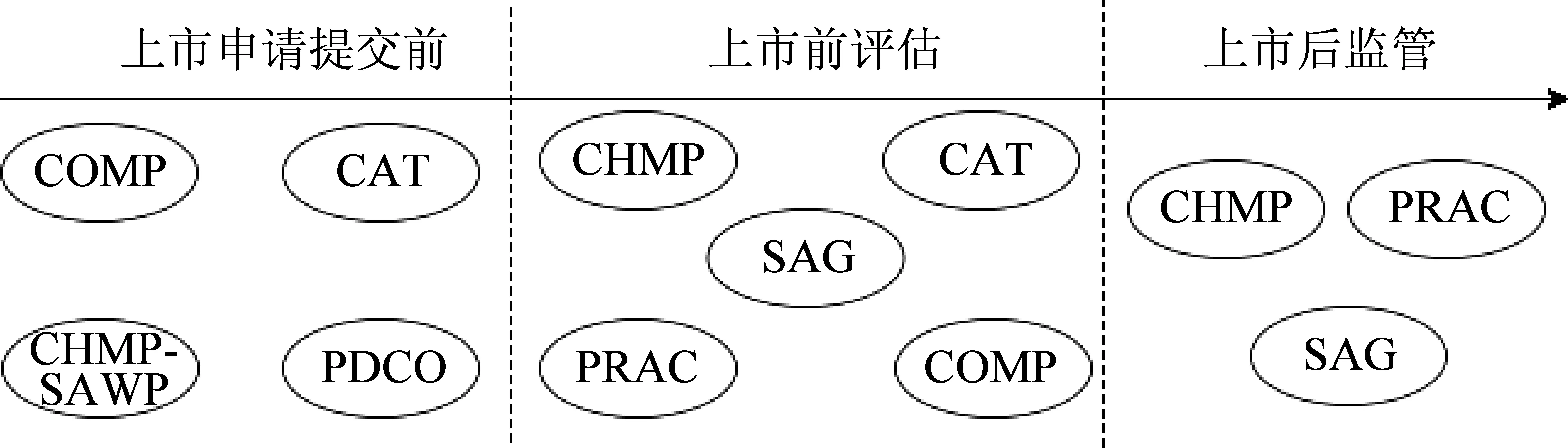
图1 EMA的患者参与监管分布图
由图1可知,EMA将患者声音信息更多地运用于孤儿药、儿科药、先进治疗医药产品,且患者声音的运用贯穿于整个医药产品生命周期。
同时,EMA也与私人组织合作,如旨在优化药物开发研究的创新药物计划(Innovative Medicines Initiative,IMI)。另外,EMA正致力于开发新途径收集患者声音,定位患者偏好,如联合MACBETH软件[7],对患者进行偏好调研等。
2.3 美国和欧盟患者声音共享机制
为了全面倾听患者声音,获取患者信息,FDA与EMA共同成立了患者声音的共享平台——患者参与工作组(Patient Engagement Cluster),以共享在生物类似药、癌症药、孤儿药、儿童药、药物警戒等主题的监管视阈患者声音[8]。该工作组主要关注如何让患者更好地表达诉求,如何将患者声音信息更好地运用到监管工作中,如何对患者进行培训使其能更高效地参与到医药产品监管中等。通过国际信息共享,识别更多患者声音,共同完善患者声音倾听机制。
3 监管机构对患者声音的倾听
3.1 美国FDA
上世纪80年代,由于艾滋病(HIV/AIDS)缺乏治疗方案,且存在研发资金不足、研发时间长等问题,艾滋病患者便自发向FDA发起了抗议活动。1988年,FDA成立了艾滋病患者小组,此后,患者声音逐步被纳入医药产品监管过程[9]。FDA的患者声音纳入如图2所示。
其中,患者与护理人员交流计划(P&CC)旨在为器械与放射卫生中心(CDRH)的工作人员提供获取患者与护理人员意见的正式流程;PEC指患者参与协作(Patient Engagement Collaborative)。
由图2可见,FDA自1991年便将患者声音考虑至监管过程,并结合私人组织与EMA共同收集与倾听患者声音,以便获取更多信息。
3.2 欧盟EMA
自1995年EMA成立以来,患者声音一直被EMA倾听[9]。EMA的患者声音纳入如图3所示。
同时,EMA的药品审评审批过程也充分倾听了患者声音,在EMA的7个药品评价委员会中,有4个委员会(包括孤儿药、儿科用药、先进疗法、药物警戒)中纳入了患者作为委员会正式成员[9]。EMA药品审评审批框架如图4所示。

图3 EMA患者声音倾听
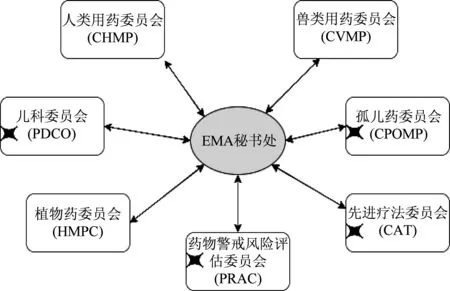
图4 EMA药品审评审批框架
3.3 美国、欧盟、日本和我国患者声音监管机构使用情况
目前欧美的患者声音倾听活动开展得较成熟,主要基于监管机构与微观企业与组织均积极开展与鼓励倾听患者声音,如美国《21世纪治愈法》中提到,自2017年6月起,新药审批申请需包含患者体验(Patients Experience)信息报告[10]。除美国与欧盟外,日本厚生劳动省在2017年公布的《促进癌症控制基本计划》中也提到了倾听患者声音的必要性,并指出如果政府与医药企业共同倾听患者声音,信息收集将更有效。可目前日本还没有发布与以患者为中心相关的活动指南,也没有把患者纳入药品管理机构中,但已逐渐开始倾听患者声音[11],见表1。

表1 美国、欧盟、日本和我国患者声音使用情况
4 总结与启示
4.1 美国和欧盟患者倾听活动经验
通过梳理欧美日地区患者倾听活动,发现有如下特征:
第一,患者声音的收集活动呈现逐步脱离医疗机构中介,而由微观企业与监管机构直接收集患者声音的趋势。在信息化时代,信息壁垒已被逐步打破,患者声音的收集活动不再需通过医疗机构为中介向药品生产端与监管端传递,现有患者声音倾听活动大多直接对接患者,扩充了患者声音的广度,确保了患者声音的真实、可靠。
第二,患者声音收集周期长、程度深。患者声音的倾听不仅在医药产品上市后阶段进行收集,且贯穿于医药产品全流程,从药品开发阶段至临床试验阶段、至上市阶段、至上市后阶段均密切关注患者声音。同时,患者声音倾听的维度广,收集的信息丰富,信息挖掘程度深。
第三,患者声音运用高效。患者声音收集后,将对其进行深度分析,并从多方面、多角度探讨其运用方式,包括纵向从医药产品全生命周期运用患者声音,也包括横向进行跨国间患者声音共享合作,以更好地洞察患者侧全方位医药信息。
4.2 我国患者倾听工作现状及启示
针对以上美国和欧盟患者倾听活动经验,分析我国现状并得到如下启示:
第一,我国应系统收集患者声音。我国微观医药企业已在逐步开展患者倾听活动,但医药产品监管过程尚未将患者声音纳入医药产品的审评审批中,监管机构尚未开展患者声音倾听与信息转换利用活动,医药产品监管结构还未落实患者声音倾听活动。我国应逐步收集特定疾病的患者声音,以便于临床试验受试者招募与新药开发工作。如监管机构联合制药企业、患者组织共同召开患者访谈会、进行患者满意度或需求调查等,实现信息共享。同时,鉴于我国地广、人多、方言多,患者声音收集过程可能存在自然壁垒,可通过引入现代技术手段,如人工智能语义分析、移动设备云端存储等方式收集并整理患者声音。其次,我国应建立一套完善的患者声音收集体系。在收集患者表面声音的同时,引导患者表达以深挖患者内在需求,这与声音收集形式、询问患者方式、特定疾病负担均有关系。因此,我国应构建一套完整的患者声音倾听方法学体系。
第二,我国应深度倾听患者声音。目前我国患者声音主要聚焦于就医体验方面,难以获得患者对于治疗方案、用药方式改善等方面的需求信息。“以患者为中心”的医疗服务提供理念逐步受到重视,主要为引进信息技术,促进患者就医信息交流以减少患者候诊时间等。对此,本文提出以下建议:首先,高效转化现有信息。通过有效倾听患者声音以将其转化为对新药研发、临床试验、药品监管等方面有用的信息,从需求侧为药品研发方向、临床试验终点指标选取、药品上市审评审批评价要素等方面提供思路。其次,全面深挖潜在信息。对患者声音的再倾听可定位患者潜在需求,识别患者对疾病治疗方案的看法与偏好,使医药产品的风险——收益评估更合理,且更具现实意义。同时,患者声音并不总是来源于患者本身,由于疾病或生理干预,某些患者可能难以表述需求,因此患者声音还可能来源于患者家属、照料者等“患者代言人”。因此,多主体深度倾听方法的制定与实施也有助于发现潜在信息。
第三,我国应合理运用患者声音。鉴于我国目前还未有全面的患者声音数据库,其声音应用也相对薄弱、单一,除特定疾病(如血友病等罕见病)患者组织外,我国并未将倾听患者声音全面运用至临床试验方案制定、新药研究开发、治疗方案开发与完善等活动。具体建议如下:药品监管机构可定位患者需求并通过宏观调控满足最紧迫需求;对患者进行监管培训,并将其纳入特定疾病的审评审批中;参与全球患者声音倾听活动,共享患者需求信息。医疗机构可探索与患者的有效交流方式;识别特定疾病异质人口学特征;收集疾病演变进展趋势等信息。制药企业可确定未来研发投入方向;通过满足患者需求实现更大市场份额;优化临床试验受试者与终点指标的选取效果。目前,我国某些制药企业已关注患者声音,并将其运用至药品开发与临床试验阶段,但医药产品监管机构尚未将患者声音运用于新药开发鼓励、医药产品监管审评审批过程,对于现有医药产品或治疗方案的后续追踪活动的开展也较少。因此,我国监管机构应逐步考虑患者声音以提升我国医疗水平与患者全方位体验。

