吉马烯A合酶的同源模建及分子对接
霍晋彦,曹洪玉,储晓慧,冯宝民,于宗霞
(大连大学生命科学与技术学院,辽宁大连116622)
β-榄香烯是一种广谱、高效、副作用少的抗肿瘤药物,对肺癌、胃癌和肝癌等浅表性肿瘤有明显的治疗作用,在临床上β-榄香烯乳制剂联合生物碱、高三尖杉酯碱、蒽环素等抗癌药物使用,可有效提高患者存活率,降低毒副作用[1].β-榄香烯目前主要从莪术(Curcuma zedoaria(Christm.)Rosc.)、广西莪术(Curcuma kwangsiensisS.G.Lee et C.F.Liang)、加拿大一枝黄花(Solidago canadensis)等[2]植物中提取获得,由于种质资源退化等原因,天然β-榄香烯的产量和质量均无法满足市场需求[3],因此β-榄香烯的人工合成具有重要应用价值.吉马烯A是一种在植物中分布比较广泛的倍半萜类化合物,有研究表明,吉马烯A在体外可经过高温转化为β-榄香烯[4],因此利用生物技术对β-榄香烯的合成前体吉马烯A的合酶基因[5]进行改造,提高其前体的产量是间接提高β-榄香烯产量的重要方法之一.
吉马烯A合酶(ScGAS)在GenBank中的序列号为AJ304452.1,具有底物专一性强[6]、副产物少(产物中98%是吉马烯A[5])、酶活性高等优点[4].法尼基焦磷酸(farnesyl pyrophosphate,FPP)是倍半萜合酶的最适底物,当FPP进入倍半萜合酶活性中心时,入口处的保守基序DDxxD及反面的NSE/DTE基序结合3个二价金属离子形成离子簇,与FPP的焦磷酸基团发生配位作用形成复合体,关闭活性中心.复合体与活性中心的氨基酸形成氢键,稳定催化反应构象.随后,FPP的焦磷酸基团离去,在关闭的活性中心直接(或异构化)发生多次分子内亲电加成级联反应,形成特定的环状倍半萜阳离子,最后阳离子发生去质子化或捕获水分子的终止反应,生成相应的倍半萜烯或醇[7].ScGAS活性位点内外具有可以改变酶产物特异性的氨基酸残基,即可塑性残基.深入解析萜烯合酶中可塑性残基的作用将有助于在产物特异性、热稳定性或催化效率等方面对合酶进行优化[8].
本研究基于已知的ScGAS一级结构,利用MODELLER 9.2构建其同源模型,以FPP为小分子配体,利用InsightⅡ的Lib Dock程序进行对接研究.针对影响ScGAS活性的关键氨基酸,利用Calculate Mutation Energy(stability)和 Calculate Mutation Energy(binding)模块构建虚拟突变,评估突变对蛋白的热稳定性以及与FPP亲和力的影响,并利用SNAP2构建非同义突变体,评估突变对蛋白功能的影响.最后利用BuildMutants构建虚拟突变体,与FPP进行对接分析,进而阐释可塑性氨基酸在调节ScGAS生物活性方面的功能.
1 实验方法
1.1 序列比对
从NCBI(National Center for Biotechnology Information)数据库获得ScGAS的一级序列,利用BLAST(basic local alignment search tool)比对获得同源性最高的蛋白晶体作为模板蛋白,借助Align sequence to templates(InsightⅡ software package,Accelrys)比对ScGAS的一级结构与模板蛋白的相似性和同源性,删除序列两端的差异氨基酸,提高两者的同源性[9].
1.2 同源模建与优化
选择MODELLER 9.2构建ScGAS的三维结构,建模数量为100,优化水平为High(高),其他参数缺省.综合考量PDF总能量(probability density functions total energy)和 DOPE 评分(discrete optimized potential energy score),两者得分越低,模型越可靠.一般选取PDF总能量最低的模型,若PDF总能量相近,则用DOPE评分进行衡量[9].
使用 InsightⅡ 软件中 Ramachandran Plot(拉氏图)、Verify 3D和ERRAT评估模型.拉氏图[10]是根据蛋白质或肽的立体结构中肽键内α碳原子和羰基碳原子间的键旋转度对α碳原子和氮原子拉链式带子间的键旋转度,来衡量允许和不允许的构象,不允许区氨基酸应小于总氨基酸的5%.Verify 3D[11]评估则依据氨基酸所处的位置是否合理来评估蛋白整体结构的合理性,至少80%的氨基酸残基Verify 3D评分应高于0.2.ERRAT评估分析不同原子类型之间的非键相互作用,要求Quality Factor高于80[12].对评估不合理的区域进行Loop Refinement与分子动力学优化.Loop优化模型数量为5,优化水平为高.分子动力学优化采用最陡下降法(steepest descent)和共轭梯度法(conjugate gradient)各200步进行能量优化[8],通过评估得到符合要求的模型.
为模型添加Mg2+后,选用InsightⅡ软件的Standard Dynamics Cascade模块优化Mg2+在模型内的位置,参数为缺省值,选择总能量最低的模型进行后续实验.
1.3 分子对接与位点虚拟筛选
计算ScGAS的潜在活性位点,运用Lib Dock(insightⅡ software package,Accelrys) 将 mol格式的 FPP配体与吉马烯A合酶的活性位点对接.构建方法选择最佳,热区数目设置为300.Lib Dock score是根据小分子的构象与受体相互作用热区匹配将配体小分子对接到受体蛋白中,其得分是对能量、几何形状、化学环境的综合评价[13].综合考量得分、FPP构象及其与镁离子的作用方式,选择最优构象.影响FPP与吉马烯A合酶对接结果的氨基酸即为可塑性氨基酸.
1.4 序列分析及饱和诱变
利用 predictprotein(https://www.predictprotein.org/)在线分析ScGAS的一级序列,利用ConSurf分析各个氨基酸的进化速率.首先在UniProt(https://www.uniprot.org/)中查找相关序列,然后使用贝叶斯或最大似然方法,基于蛋白质与其同系物之间的进化相关性来估算氨基酸的进化速率.每个位置的保守程度与进化速率呈反比,快速进化的位置是可变的,而缓慢进化的位置则是保守的[14].
使用SNAP 2进行饱和诱变,分析突变对蛋白功能的影响.突变体的选择标准为“效应”得分高于85,概率至少为91%.非中性(“效应”)突变体表现出蛋白质功能的改变,而中性突变体则没有.得分高于60分强烈表明特定残基的功能重要性[15-16].
突变对结合亲和性的能量效应(mutation energy,ΔΔGmut)为突变结构与野生型蛋白质之间结合自由能的差,即ΔΔGmut=ΔΔGbind(突变体)-ΔΔGbind(野生型).结合自由能变化小于-0.5 kcal/mol时亲和力增加,介于 -0.5~0.5 kcal/mol时为中性突变,大于0.5 kcal/mol时亲和力降低[16].蛋白热稳定性是对突变前后蛋白质折叠自由能的变化的评估.突变对蛋白质稳定性的能量效应(mutation energy,ΔΔGmut)为突变结构与野生型蛋白质折叠自由能的差,即ΔΔGmut=ΔΔGfold(突变型)-ΔΔGfold(野生型).
采用基于InsightⅡ软件的Calculate Mutation Energy(Stability)和 Calculate Mutation Energy(Binding)模块分别分析氨基酸突变后ScGAS的折叠自由能及其与FPP的结合自由能的变化,预测和评估突变对酶活力的影响[16].当酶与底物的亲和力及蛋白热稳定性增强时,酶的活力会提升[17].对能增强酶活的突变方向,利用InsightⅡ软件的Build Mutants模块构建突变体,分别与FPP进行对接,并且分析对接的Lib Dock评分及FPP的对接构象.
综合突变对蛋白质折叠自由能、与FPP结合自由能及SNAP2评分,构建虚拟突变体,分析突变前后蛋白的PDF总能量、DOPE评分、酶与底物作用力的变化,推测氨基酸变化对酶活性改变的影响.
2 结果与分析
2.1 序列比对分析
通过BLAST程序得到与ScGAS同源性最高的青蒿的没药醇合酶变体(PDB ID:4GAX)晶体,可将其作为模板蛋白[9],两者的序列同源性为53.0%,相似性为74.0%.扣除修饰后同源性提高至54.2%,相似性提高至75.6%,ScGAS与4GAX的序列比对结果如图1所示.

图1 吉马烯A合酶与4GAX的序列比对结果Fig.1 Alignment of germacrene A synthase sequence with 4GAX sequence
当序列同源性大于50%时,可以得到高精度的模建模型,主链原子误差约为0.1 nm,基本相当于中等分辨率的核磁共振(NMR)结构和低分辨率的X线衍射结构[18].这说明以4GAX为模板蛋白构建出来的蛋白模型可以代表ScGAS的三维结构参与后续研究.
2.2 同源模建与优化
在构建的5个最优模型(见表1)中选择PDF总能量最小的90号模型进行Loop Refinement与分子动力学优化,拉氏图评估结果如图2所示.
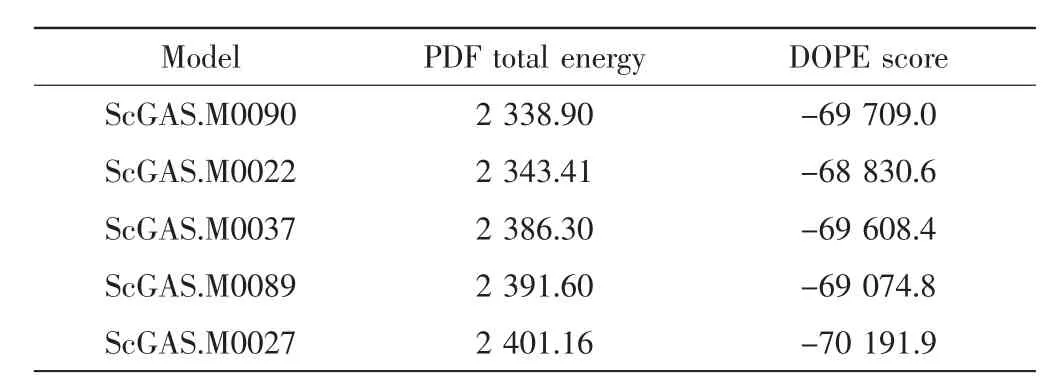
表1 同源模建结果Tab.1 Results of homology modeling
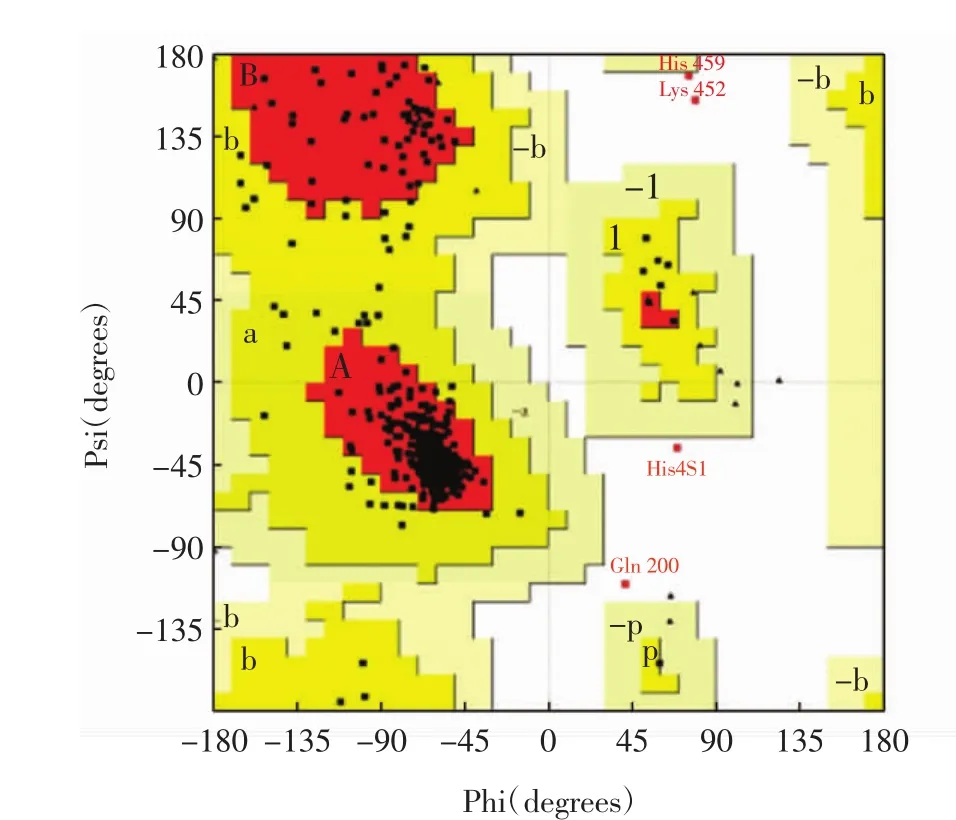
图2 拉氏图Fig.2 Ramachandran plot
图2中,氨基酸残基总数为537个,A、B、L为最适允许区,分布有 449个氨基酸残基,a、b、l、p为合理允许区,分布有 46 个氨基酸残基,-a、-b、-l、-p 为基本允许区,无氨基酸残基;其余区域为不允许区,分布有4个不合理氨基酸残基,分别为His459、Lys452、His451、Gln200,占氨基酸总数的 0.8%.ERRAT的Quality Factor高达97.916 7且87.9%的氨基酸残基Verify 3D评分高于0.2.此外,模型与模板蛋白4GAX的均方根偏差值(root mean square deviation,RSMD)为0.60 nm.综合3种评估方法,确认优化后的90号模型的结构非常合理.根据3个Mg2+在烟草的5-Epi-Aristolochene合酶晶体结构(PDB ID:3M01)中的重叠位置,将3个Mg2+定位到ScGAS模型并依赖InsightⅡ软件的Standard Dynamics Cascade模块优化,确定Mg2+在模型中的位置[8],如图3所示.
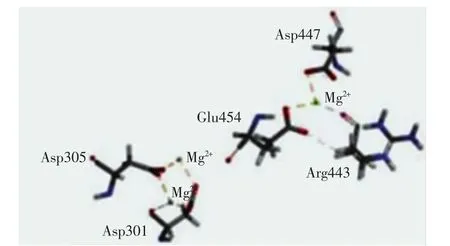
图3 镁离子与ScGAS的结合方式Fig.3 Joining mode of magnesium ions with ScGAS
2.3 分子对接与位点虚拟筛选
倍半萜合酶与底物FPP发生生化反应时,FPP与2个镁离子作用形成“U”形构象时更容易发生1,10-环化,生成吉马烯A[19].通过计算和理论分析ScGAS与FPP对接的活性位点,并使FPP以“U”形构象与ScGAS对接,得到Lib Dock评分为138.965,影响对接效果的氨基酸(如图4)可能是影响酶活性的关键氨基酸.
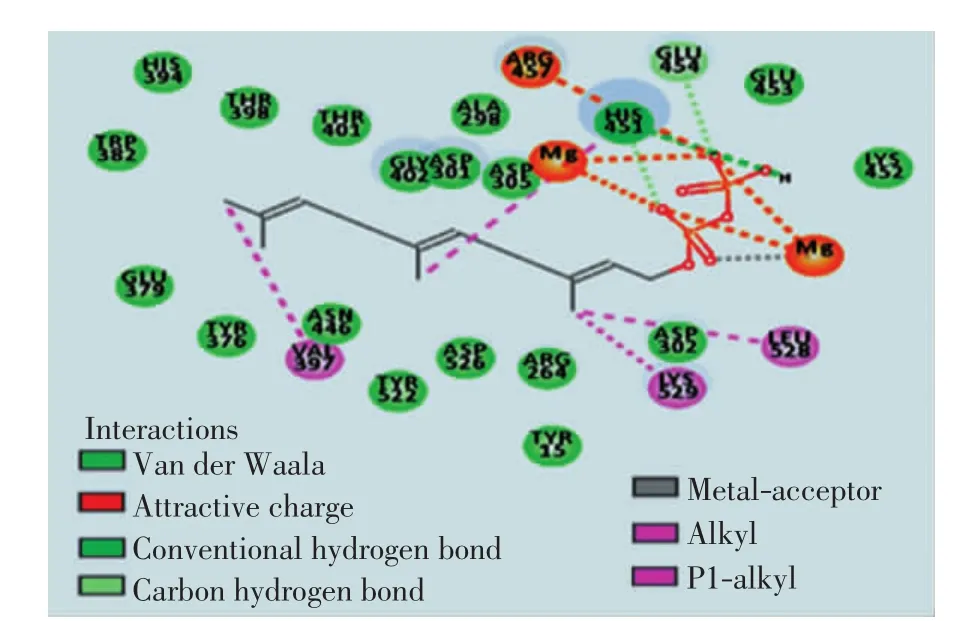
图4 影响ScGAS与FPP对接效果的氨基酸Fig.4 Amino acids affecting the docking effect of ScGAS and FPP
2.4 序列分析
用ConSurf分析ScGAS的一级结构,发现影响酶与FPP对接的24个氨基酸(如图5)中,仅Tyr15的保守性在5以下,而功能性氨基酸多为保守性氨基酸,推测其余23个氨基酸可能是影响ScGAS结构和功能的重要氨基酸.

图5 ConSurf结果图(黑色框内为筛选的关键氨基酸)Fig.5 ConSurf result chart(the key amino acids screened in the black box)
对23个潜在的关键氨基酸做437组饱和突变,分析突变前后蛋白热稳定性以及与底物FPP亲和力的变化,推测有16组突变(D301N、D302N、D302K、E379Q、E379L、G402M、E453I、E454Q、D526R、D526N、D526V、D526Q、D526C、D526T、D526L、D526Y)可提高蛋白的稳定性和亲和力.对比氨基酸突变前后蛋白与FPP的对接构象(如图4、图6),发现氨基酸突变后通过影响酶与底物作用的活性口袋的位置及大小、与底物的成键方式以及与辅助因子的作用力,间接影响酶的功能.结合SNAP2评分以及酶与FPP的对接构象,最后得到4组突变D301N、D302K、D526L及E379L(见表2).对倍半萜合酶催化机制及突变的研究表明[20],可塑性氨基酸的突变可通过影响酶的产物特异性提高产物的多样性,从而使酶的功能得到进化,有些突变亦可提高酶的催化效率.通过数据分析发现,D301N、D302K、D526L和E379L这4组突变不仅增强了蛋白的热稳定性、酶与底物的结合亲和力、使底物以“U”型构象与蛋白对接(如图6),而且对接的Lib Dock评分均比其他突变高30左右,表明该对接结果更容易发生,酶的表达产物中含有更多的吉马烯A.这些结果与体内实验是否一致,需要通过体外酶活实验进行验证.
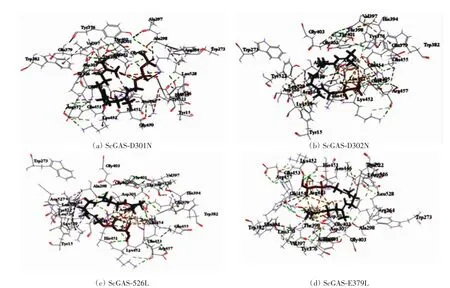
图6 氨基酸突变后ScGAS与FPP的对接Fig.6 Docking of ScGAS with FPP after amino acid mutation
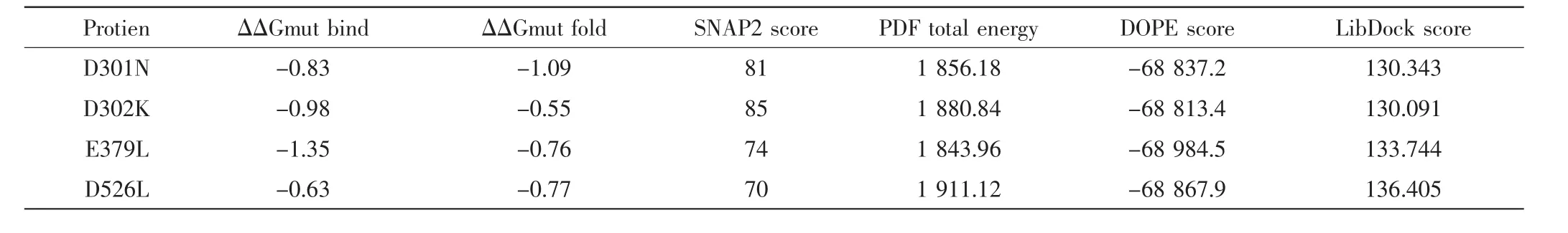
表2 虚拟突变结果Tab.2 Virtual mutation screening results
3 讨论
本研究结合计算机模拟与现代生物学技术,构建了ScGAS的同源模型,发现了影响ScGAS与法尼基焦磷酸(FPP)对接的可塑性残基,并结合ConSurf、SNAP2及虚拟突变研究,从构建的饱和诱变文库中发现了4个具有改进热稳定性和底物亲和力的突变体,为后续改造吉马烯A合酶提供了理论支持.经过一系列软件的分析,发现突变对蛋白的影响均为有益.因此可认为301D、302D、378E和526D均为影响ScGAS合酶功能的关键氨基酸,但是具体影响依然需要进一步的生物学研究.
在分子进化正向选择的基础上进行合理的蛋白质设计,为ScGAS结构的靶向分子操作提供了研究方向.计划进一步将进化生物学与实验分子生物学相结合,研究生物体内ScGAS的突变体如何改变其生化过程,为β-榄香烯的工业化生产提供新的思路.

