产电海洋脂肪酶生产菌的分离筛选鉴定及培养条件研究
黄阳天 陆育彪 黄益帖 孟繁龙 徐凯文 李鹏
(浙江海洋大学海洋科学与技术学院,舟山 316022)
脂肪酶(Lipase,3.1.1.3)是一类具有多种催化能力的酶,可以催化三酰甘油酯及其他一些不溶性酯类的水解、醇解、酯化、转酯化及酯类的逆向合成反应[1-2]。除此之外,还表现出其他一些酶的活性,如磷脂酶、溶血磷脂酶、胆固醇酯酶活性等[3],广泛存在于动物组织,植物种子和微生物中,尤其是微生物中脂肪酶种类最多。
脂肪酶的来源主要是通过微生物的发酵液提取,其主要原因是微生物脂肪酶反应条件温和,对温度和 pH 值的适宜范围较宽。微生物脂肪酶在食品加工[4-6]、洗涤剂[7-8]、生物柴油[9-10]、脱墨技术[11-12]、饲料[13-14]、生物制药[15-16]等现代工业生产领域中具有广阔的应用前景。与国外相比,国内脂肪酶的研究与开发相对较晚,应用在工业生产中的脂肪酶种类有限,具有新型酶学性质的脂肪酶种类稀少。
目前对于产脂肪酶微生物来源研究主要集中于极端环境中分离获得,如高渗、高压的海洋环境[17],低温环境[18],高盐碱性[19]及高温[20]等自然环境,甚至从鱼类消化道中也获得具有特殊酶学性质的脂肪酶[21],因此微生物脂肪酶的开发利用潜力非常巨大。研究发现,有 65 个属的微生物能产脂肪酶,其中 28 个属是细菌,而报道被用于商品化的细菌脂肪酶只有8种[22],随着在科研和工业领域中脂肪酶的应用越来越广泛,陆生常见的脂肪酶越来越不适应现代要求,对脂肪酶的要求也逐渐转变成在极端反应体系中的高催化、高活性与稳定性。海洋来源的脂肪酶往往具备在高压高渗透高盐环境下特殊的催化活性,因此也成为将来的研究热点。
本研究通过对潮间带海泥分离筛选产脂肪酶海洋细菌,并进行菌种鉴定及酶活影响因素分析,旨在为海洋脂肪酶的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品 准备无菌采集袋,采集舟山本岛附近海洋潮间带海泥,分别采样长峙岛、朱家尖、富翅岛潮间带海泥,带回实验室4℃冰箱暂时保存,一天内处理完样品。
1.1.2 培养基 LB-1%橄榄油乳化液固体培养基(分离筛选培养基):蛋白胨 2%、酵母膏 0.5%、氯化钠1%、橄榄油乳化液 1%、琼脂 2%;牛肉膏蛋白胨培养基:牛肉膏 3 g,蛋白胨 10 g,NaCl 5 g,琼脂 18 g,海水 1 L;LB 琼脂培养基:胰蛋白胨 10 g,酵母提取物 5 g,氯化钠 10 g,海水 1 L,琼脂 18 g;种子培养基:葡萄糖 10 g,蛋白胨 5 g,K2HPO4,MgSO40.5 g;海水1 L;发酵培养基:蛋白胨 5 g,尿素 0.25 g,甘油 5 g,NaHCO31 g,K2PO42 g,Tween80 15 mL,橄榄油 1.1%,海水1 L。上述培养基均121℃灭菌30 min,pH值均为7.2。
1.2 方法
1.2.1 分离筛选及纯化 称取泥样10 g,放入 90 mL无菌水的三角瓶中(加玻璃珠),摇床 230 r/min 振荡 30 min,即为稀释度为 10-1的土壤悬液。取灭菌试管5支,每支装 4.5 mL 无菌水,编号 10-2、10-3、10-4、10-5和 10-6。吸取 0.5 mL 稀释度 10-1的土壤液,加入 10-2的无菌水试管中,轻轻吹吸数次,使之充分混匀,即成 10-2梯度稀释液。依次制成 10-3、10-4、10-5和 10-6稀释液。10-4-10-6三个稀释度分别取 0.1 mL于分离培养基中,进行涂布,每个稀释度做9个平行,后于37℃倒置培养 1-2 d,观察菌落周围是否出现透明圈。待出现有透明圈菌株,挑取于分离筛选培养基划线,连续重复3次划线后,斜面保种备用。
1.2.2 脂肪酶酶活测定 将斜面培养物接种一环到种子培养基,200 r/min,培养至OD600=1.5,即到对数生长期,按照2%的接种量,接种至50 mL发酵培养基中,继续200 r/min,培养1-2 d后,以橄榄油乳化液为底物,采用 NaOH 滴定分析法。每毫升酶液,在一定的温度和条件下,每分钟水解底物,产生1 μmoL的可滴定游离脂肪酸,定义为一个脂肪酶活力单位(U),单位为U/mL,其计算公式如下:
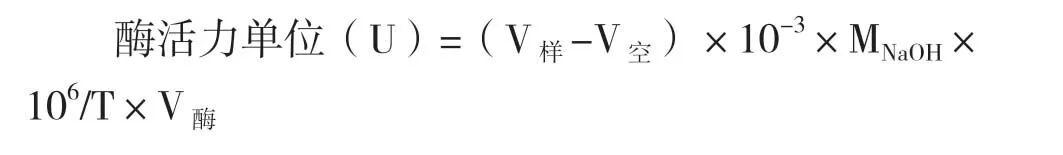
式中,V样为滴定至终点时样品瓶中消耗的NaOH的体积(mL);V空为滴定至终点时对照瓶中消耗的NaoH的体积(mL),MNaOH为NaOH的摩尔浓度;T为反应时间(min);V酶为加入到反应体系中的酶液的体积(mL)。
1.2.3 分子鉴定及电镜形态扫描 取较高脂肪酶活性的海洋细菌作为目标菌株,进行16S rRNA基因分析,利用试剂盒提取染色体DNA,利用PCR扩增16S rDNA片段,通用引物(F1:5'-AGAGTTTGATCCTGGCTCAG-3',F2:5'-GGTTACCTTGTTACGACTT-3'),PCR反应体系:Template 0.5 μL;10×Buffer 2.5 μL;dNTP1 μL;Taq酶0.2 μL;Primer1 0.5 μL;Primer 2 0.5 μL;ddH2O 19.8 μL,PCR产物用1%琼脂糖凝胶电泳进行检测,后利用SanPrep 柱式PCR 产物纯化试剂盒回收,对回收的DNA进行测序,生工生物工程(上海)股份有限公司。利用BLAST对获得的基因序列与GenBank中的序列进行比对,采用MEGA5.0的邻接方法构建系统发育树[23-25]。形态观察采用电镜SEM扫描。
1.2.4 发酵条件对酶活影响的研究 分别取培养时间12 h、24 h、36 h、48 h、60 h和72 h的发酵液,培养温度为30℃,进行酶活的测定;分别调整发酵液的初始pH值为6.5、7.0、7.5、8.0、8.5、9.0,培养48 h,培养温度为30℃以后测酶活;分别调整发酵培养基每升中的尿素含量为0.15 g、0.25 g、0.35 g、0.45 g、0.55 g和0.60 g,培养48 h,培养温度为30℃以后测酶活;培养温度分别在25、30、35、40、45和50℃,培养时间为48 h,测脂肪酶酶活。
1.2.5 产电性能的测试 先构建H型双室MFC燃料电池,阳极和阴极室中间由离子交换膜隔开,两极的碳布电极由铜导线连接,并外接1 000 Ω电阻,电池输出电压的采集由数据采集系统(上海U00249)连接计算机完成,阳极室添加60 mL的摇床培养2 d至对数生长期的菌液为阳极电极液;阴极室添加同体积的50 mm的铁氰化钾溶液,菌株活化后取1 mL菌悬液接种到60 mL阳极液,运行MFC测试电压的输出,30 min记录数据一次进行绘图。
2 结果
2.1 海洋脂肪酶细菌的筛选
本研究共筛选到10株产透明圈的脂肪酶生产菌,并挑取其中两株产较大透明圈且透明圈直径/菌落直径的值较大的细菌进行研究。其中菌株S11、S22的比值分别为3.01与2.85。
2.2 脂肪酶酶活的测定
采用NaOH滴定分析法,以酚酞试剂为指示剂,进行脂肪酶酶活的测定(表1)。重复3次取平均值,测酶活S11为15.2 U/mL,S22为20.8 U/mL。
2.3 分子鉴定结果及SEM扫描图
对PCR扩增产物进行序列测定,得到的两株菌株的序列分别为1 471 bp和1 484 bp。将序列已上传至NCBI 的GenBank进行比对(采用clustalx1.83软件),将比对结果利用MEGA 5.0的邻接(N-J)方法,基于16S rRNA序列构建了系统发育树(图1)。由图1可知,菌株S11属于假单胞属,在进化位置上与Pseudomonas putidaWAB1947最近,相似性达到99.8%,S22与芽孢杆菌属Bacillus substillsLSRB在进化位置上最近,相似性达到99.9%,分别命名为Pseudomonassp. S11和Bacillussp.S22。将获得的序列上传至NCBI的GenBank,获取登录号分别为MW015750和MW015751。图2为菌株S11和S22的电镜扫描形态图。将经过产电输出测试后的阳极碳布电极,经过戊二醛固定后,送测SEM,结果显示,在碳布电极表面,均有很好的菌株吸附现象,产生了膜状及丝状物质,该物质可能与菌株表现出的产电性能相关。
2.4 培养条件对脂肪酶酶活的影响
2.4.1 培养时间对脂肪酶酶活的影响 分别取培养时间12 h、24 h、36 h、48 h、60 h和72 h的发酵液,培养温度为30℃,摇床转速为200 r/min,初始pH值为7.0,尿素含量为0.25 g,进行酶活的测定,结果如图3所示。随着培养时间增加,酶活逐渐增加,至48 h达到最大酶活,S11为15.3 U/mL,S22为21.2 U/mL,继续培养,酶活逐渐下降。

图2 菌株S11和S22的SEM扫描图
2.4.2 初始pH值对脂肪酶酶活的影响 分别调整发酵液的初始pH值为6.5、7.0、7.5、8.0、8.5和9.0,培养48 h,培养温度为30℃摇床转速为200 r/min,测酶活。结果如图4所示,菌株S11和S22均在pH 7.0时达到最大酶活值,且随着pH增加,酶活降低,当pH值到9.0时S11酶活消失,在此pH值时菌株S11的生长受限,导致无代谢产物生成。
2.4.3 尿素含量对脂肪酶酶活的影响 分别调整发酵培养基每L中的尿素含量为0.15 g、0.25 g、0.35 g、0.45 g、0.55 g和0.60 g,培养48 h,摇床转速为200 r/min,初始pH值为7.0,培养温度为30℃以后测酶活,结果如图5所示,当每升培养基中含的尿素含量超过0.55 g时,酶活迅速下降,可见过量的尿素含量对脂肪酶的产生起抑制作用。

图3 培养时间对脂肪酶酶活的影响
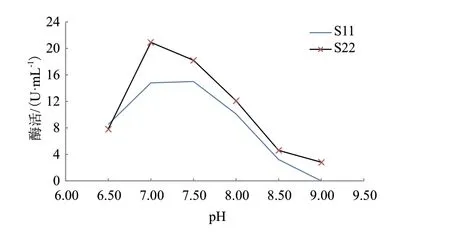
图4 初始pH值对脂肪酶酶活的影响
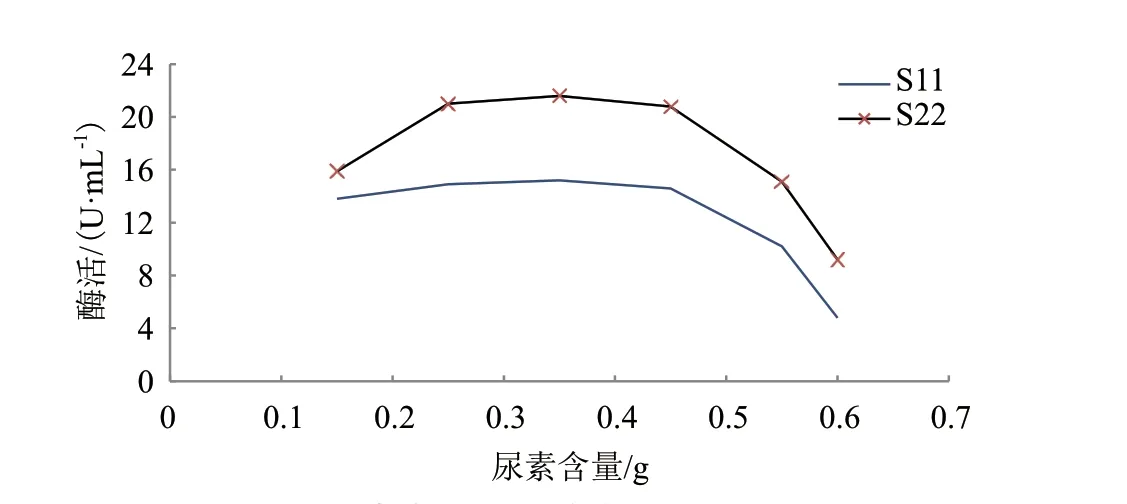
图5 尿素含量对脂肪酶酶活的影响
2.4.4 培养温度对脂肪酶酶活的影响 培养温度分别在25、30、35、40、45和50℃,尿素含量为0.25 g/L,培养时间为48 h,摇床转速为200 r/min,初始pH值为7.0测酶活。结果如图6所示。随着温度增加,两株菌株的趋势都是酶活先升高后降低,S11菌株在40℃时达到酶活最大值,S22菌株在35℃时到达最大值,在产酶条件中,菌株S11对温度的耐受性要好于菌株S22。

图6 培养温度对脂肪酶酶活的影响
2.4.5 橄榄油含量对脂肪酶酶活的影响 分别调整发酵培养基每L中的橄榄油含量为0.5%、1.0%、1.5%、2%和2.5%,培养48 h,摇床转速为200 r/min,初始pH值为7.0,培养温度为30℃以后测酶活,结果如图7所示,当每升培养基中橄榄油含量超过2%时,酶活均略下降,过高的橄榄油含量对脂肪酶酶活具有一定的抑制作用。

图7 橄榄油含量对脂肪酶酶活的影响
2.4.6 甘油含量对脂肪酶酶活的影响 分别调整发酵培养基每升中的甘油含量为2.5 g、5 g、7.5 g、10 g、12.5 g,培养48 h,摇床转速为200 r/min,初始pH值为7.0,培养温度为30℃以后测酶活,结果如图8所示,当每升培养基中含的甘油含量超过10 g/L时,酶活迅速下降,甘油浓度过高对酶活具有明显的抑制作用。
2.5 产电能力的初步研究
将构建好的H型MFC置于恒温环境下(30℃),2 d后,逐渐有微弱电流产生,7 d后输出电流较为稳定,其中S11的最大输出电压为0.055 V,S22的最大输出电压为0.031 V,S1在18 d后输出电压逐渐降低,S22在20 d后输出电压逐渐降低。产脂肪酶菌株的产电性能较低。具体产电图如图9所示。

图8 甘油含量对脂肪酶酶活的影响

图9 菌株输出电压采集图
3 讨论
从舟山海域潮间带中筛选到产脂肪的海洋细菌菌株S11和S22,基于16S rRNA序列构建了系统发育树,结果显示,菌株S11属于假单胞属,在进化地位上与Pseudomonas putidaWAB1947密切相关,S22芽孢杆菌属Bacillus substillsLSRB在进化地位上密切相关,并分别命名为Pseudomonassp. S11和Bacillussp.S22,SEM扫描电镜形态图显示S11菌株短杆状,S22菌株呈现明显的杆状和短杆状。利用NaOH滴定分析法进行脂肪酶酶活测定,结果显示,菌株S11和S22的酶活分别是15.2 U/mL、20.8 U/mL。单因素实验初步考查了培养时间、温度、培养基中尿素含量、以及初始pH值对两株菌株产酶的影响,结果显示,菌株S11分别在培养48 h、初始pH 7.0、尿素含量为0.35 g/L、培养温度为35℃时候对应的酶活值最大;菌株S22分别在培养48 h、初始pH 7.0、尿素含量为0.35 g/L、培养温度为40℃时候对应的酶活值最大。构建MFC分别进行产电性能测试,结果显示菌株S11和S22的最大输出电压分别为0.055 V和0.031 V。
目前,来源于极端环境的海洋产脂肪酶细菌的报道较少,伍朝亚等[26]从渤海沉积物中分离筛选产脂肪酶细菌,分析其物种多样性,结果显示,Pseudoalteromonas、Marinobacter和Sulfitobacter三个属的细菌属于产脂肪酶的优势菌群。郝文惠等[27]在10℃恒温培养条件下,从第29次南极科学考察获得的南极深海沉积物样品中分离筛选到产脂肪酶细菌3株,通过PCR扩增,获得了脂肪酶全长序列,对该序列进行系统发育分析发现,该脂肪酶基因处于较独立的分支。
利用产脂肪酶微生物可以分泌脂肪酶,水解油脂这一特性,将其应用到含油脂废水的处理上也是一种新的思路,在降解脂肪的同时,产生清洁能源-电能,更是一种十分具有前景的研究,Bacillus在作为微生物燃料电池(Microbial fuel cell,MFC)的阳极产电菌已有报道[28],而Pseudoalteromonas则较少见报道。本研究希望能为产脂肪酶海洋细菌在污水处理中的使用奠定一定的研究基础。
4 结论
从舟山海域潮间带中筛选到产脂肪酶的海洋细菌菌株S11和S22,16S rRNA序列鉴定结果显示两株菌分别属于假单胞属和芽孢杆菌属,酶活测定显示,两菌株酶活分别是15.2 U/mL和20.8 U/mL。单因素实验显示菌株S11在培养48 h、初始pH 7.0、尿素含量为0.35 g/L、培养温度为35℃时候对应的酶活值最大;菌株S22在培养48 h、初始pH 7.0、尿素含量为0.35 g/L、培养温度为40℃时候对应的酶活值最大。产电性能测试结果显示,菌株S11和S22的最大输出电压分别为0.055 V和0.031 V。

