外切菊粉酶的酶学研究进展
何丽梅, 张 蕊,2,3, 李 娜, 雷 曦, 周峻沛,2,3*
(1.云南师范大学 生命科学学院,云南 昆明 650500;2.生物能源持续开发利用教育部工程研究中心,云南 昆明 650500;3.云南省高校高原特色食品酶重点实验室,云南 昆明 650500)
菊粉又称菊糖,其来源较为广泛,在植物、海藻、真菌和细菌中都有分布,主要来源于植物[1]。目前已发现含有菊粉的植物大约有3.6万种,包括单子叶植物的禾本科、百合科、芭蕉科以及双子叶植物的龙胆科、菊科、桔梗科等11个科,表1中例举了部分常见植物中菊粉的含量,其中菊芋和菊苣的菊粉含量较高,占其块茎干重的50%以上,菊芋和菊苣的抗逆性、适应性强,在中国的许多地方都有种植,因此最适宜用来生产菊粉[2]。菊粉是果聚糖的一种,它由D-呋喃果糖经β-2, 1-糖苷键毗连而成,其还原端有一个葡萄糖残基经α-1, 2-糖苷键毗连[3]。菊粉的化学结构式为G-1, (2-F-1) n-1,2-F,简写GFn,G代表终端葡萄糖单元,F代表果糖单元,n代表果糖的单元数,大多数的菊粉属于此类结构(图1)。菊粉是果糖基可再生资源的优质来源,可被菊粉酶分解用于生产果糖、高果糖浆、燃料乙醇、菊粉寡糖等产品。菊粉酶(Inulinase)是一类能够水解β-2, 1-D果糖苷键的水解酶,称为β-2, 1-D果聚糖酶,也称作β-果糖苷酶、β-果聚糖水解酶,β-2, 1-D果聚糖水解酶(EC3.2.1)[4]。菊粉酶是糖苷水解酶32家族(Glycosyl hydrolases family 32)的一员。菊粉酶普遍存在于微生物和植物中,其中来源于植物的菊粉酶只催化菊粉,来源于微生物的大部分菊粉酶除能催化菊粉外还能催化含有β-2, 1-糖苷键的糖,如蔗糖和棉子糖等;只有少部分来源于微生物的菊粉酶仅对菊粉有催化作用。微生物菊粉酶在菊粉的应用中发挥着关键的作用,本文主要从微生物菊粉酶方面进行论述。
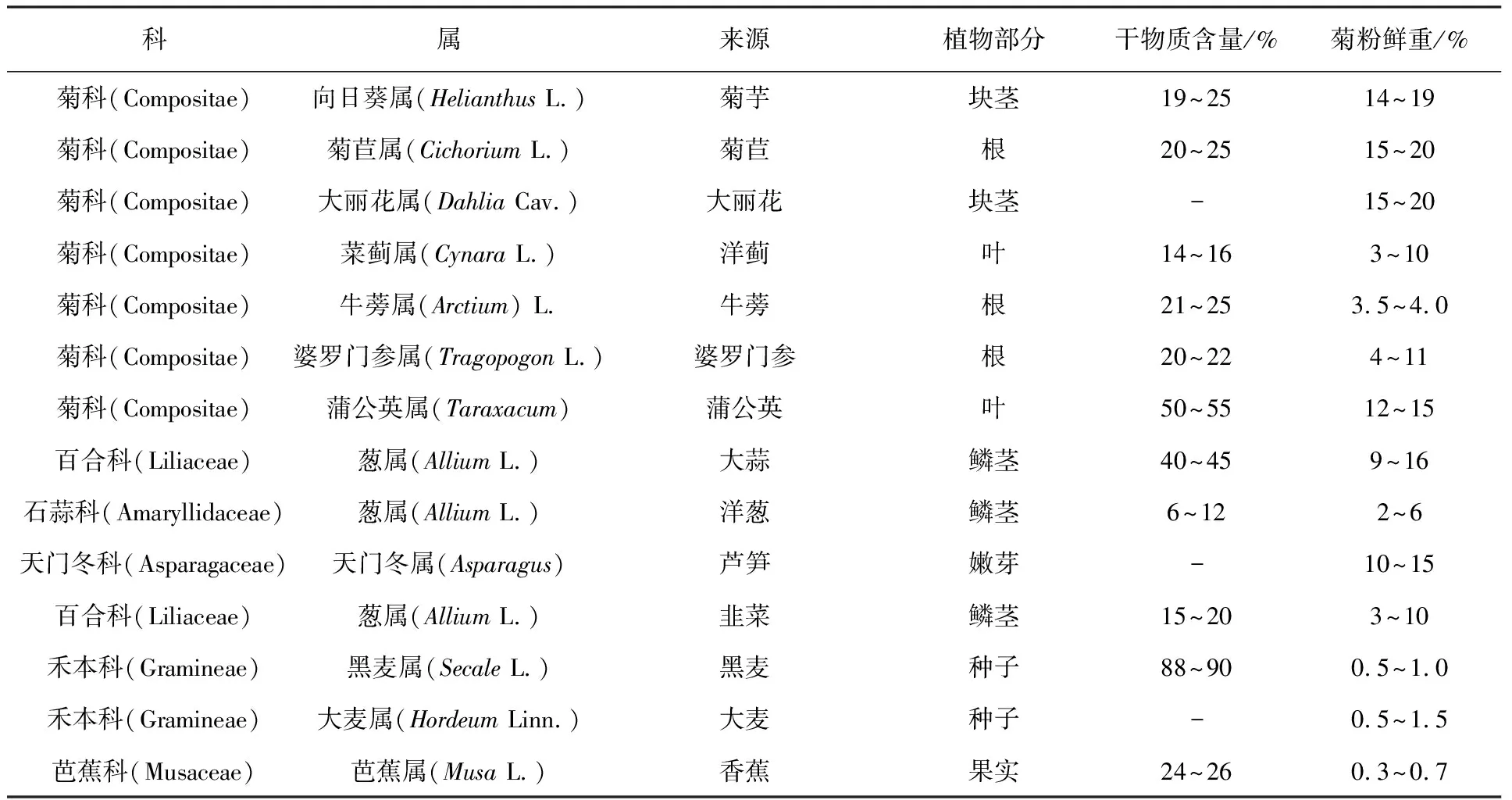
表1 常见植物的菊粉含量
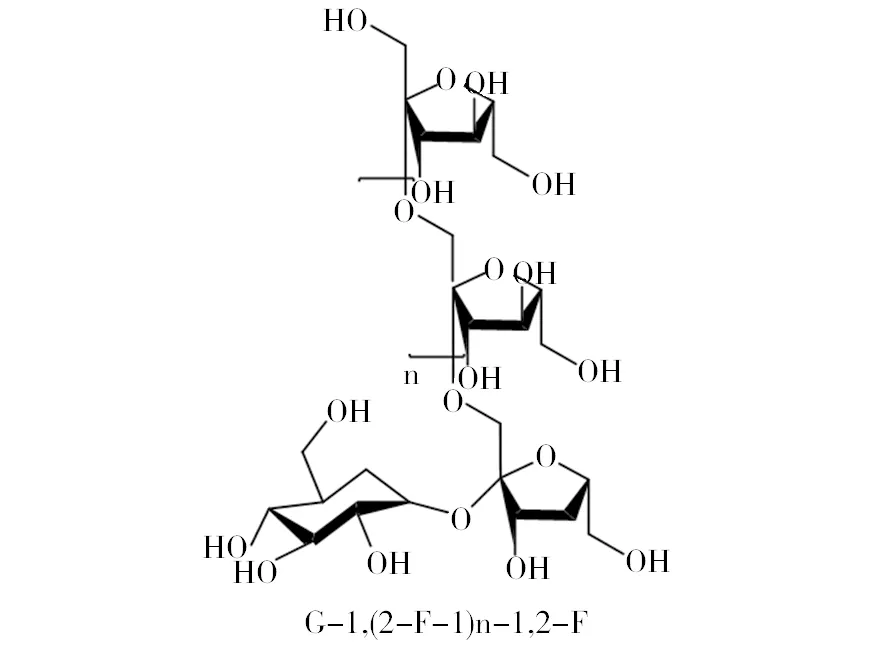
图1 菊粉的化学结构Fig.1 Chemical structure of inulin
1 菊粉酶的分类
根据来源不同,菊粉酶可分为微生物菊粉酶和植物菊粉酶,根据菊粉酶在果聚糖链上催化方法的差别,菊粉酶可被分为外切型菊粉酶(EC3.2.1.80)和内切型菊粉酶(EC3.2.1.7)[5]。外切型菊粉酶可逐一切断果聚糖链非还原性末端的β-2, 1-糖苷键,主要产物为果糖;果聚糖、菊粉、蔗糖等也可作其催化底物。菊粉果聚糖链内部的β-2, 1-糖苷键能随机地被内切型菊粉酶断开,低聚果糖(多为四糖或五糖)为主要产物,此外,内切型菊粉酶还缺乏蔗糖酶活性[6]。通常认为,I/S值是辨别转化酶和菊粉酶以及外切酶和内切酶的主要参数,I表示菊粉做催化底物时的酶活,S表示蔗糖做催化底物时的酶活[1]。按照菊粉酶在微生物体内存在位置的差别可将其分为三种:位于细胞外的胞外酶,位于细胞壁的胞壁连系酶和位于细胞内的胞内酶。这三种酶的比例主要受菌种、温度、pH、碳源的影响[7]。
2 菊粉酶的来源与性质
植物、泥土、水、动物消化道中的多种微生物都可以产生菊粉酶。据不完全统计,细菌的12个属、酵母菌的10个属和丝状真菌的17个属均可产生菊粉酶[8]。例如,丝状真菌中的青霉属(Penicillium)[9]、曲霉属(Aspergillus)[10],酵母菌中的克鲁维酵母菌属(Kluyveromyces)[11]、毕赤酵母属(Pichia)[12],细菌中的芽胞杆菌属(Bacillus)[13]、链霉菌属(Streptomyces)[14],其中又以曲霉属、青霉属及克鲁维酵母属的菊粉酶研究较多。大多数微生物菊粉酶均为外切型菊粉酶。外切型菊粉酶的主要酶学特性及菌株见表2。
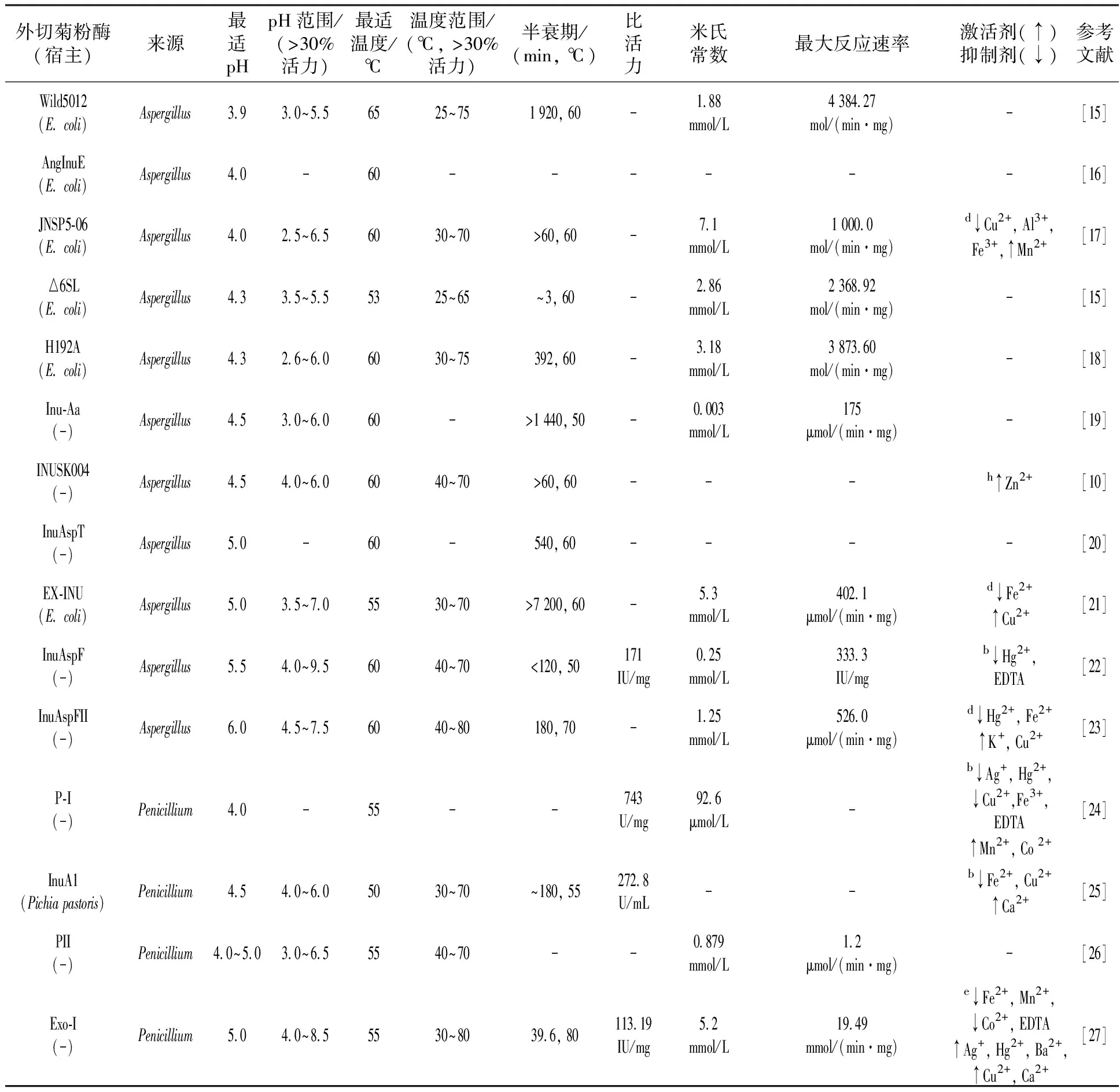
表2 外切菊粉酶酶学性质

续表2-1
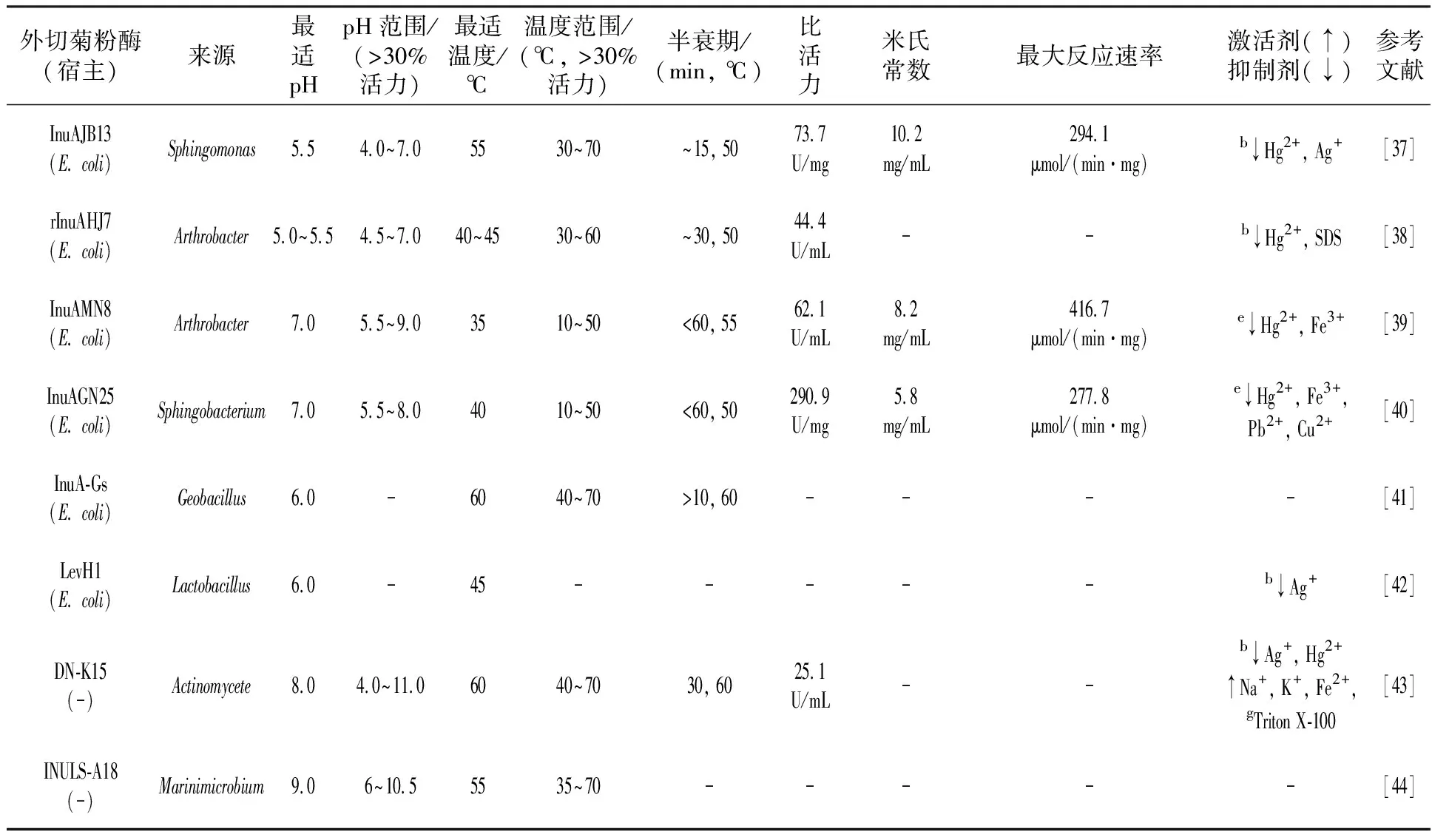
续表2-2
2.1 pH
绝大多数微生物产生的外切菊粉酶最适pH值为4.0~6.0,多数外切菊粉酶在最适pH附近可保持相对稳定。少数外切菊粉酶的最适pH值为中性(7.0),如Bacilluspolymyxa[13]和Bacillussp.[34]来源的外切菊粉酶的最适pH值均为7.0;Sphingobacterium[40]来源的外切菊粉酶rInuAGN25的最适pH值为7.0,在pH值6.0~8.0的缓冲液中较稳定,孵育1 h后,酶能保持50%以上的相对活性;Arthrobacter[39]来源的外切菊粉酶rInuAMN8的最适pH值为7.0,在pH值6.0~9.0的缓冲液中较稳定,孵育1 h后,酶能保持60%以上的相对活性。极少数的外切菊粉酶的最适pH值偏碱性,如Actinomycete[43]来源的外切菊粉酶的最适pH值为8.0,在pH值5.0~11.0的缓冲液中较稳定,孵育1 h后,酶能保持81%以上的相对活性。Marinimicrobium[44]来源的外切菊粉酶的最适pH值为9.0。
综上所述,大部分外切菊粉酶的最适pH为弱酸性,其活性在酸性至微碱性条件下保持稳定,而适应碱性条件的外切菊粉酶的相关特性还需要进一步研究。大部分外切菊粉酶适应酸性环境的机理还需要通过酶的突变、晶体结构解析等手段进一步揭示。
2.2 温度
曲霉属[16,19-20,22-23]来源的外切菊粉酶的最适温度一般在60 ℃,低于70 ℃时,酶较稳定,半衰期较长;青霉属[25-26,45]来源的外切菊粉酶最适温度一般为5~55 ℃,低于70 ℃时,酶较稳定,半衰期较长;其他大部分外切菊粉酶的最适温度均在50~60 ℃之间,而最适温度为低温或在低温下活性较高的外切菊粉酶报导较少,本实验室(生物能源持续开发利用教育部工程研究中心)发现的外切菊粉酶InuAGN25和InuAMN8就属于低温类型[39-40]。由于低温酶能在低温条件下进行摧氏反应,使其在应用上具有一定的优势:超过地球总面积的75%为低温环境,适合低温酶催化作用;在低温条件下处理的食品可防止食品营养损失和品质下降;将中温或者高温处理方式转为低温处理(终年低温和季节性低温地域的天然环境下的处理)方式可降低能耗[46]。例如,外切菊粉酶将菊粉水解为果糖,做为酿酒酵母的发酵底物,有些酿酒酵母可以在20 ℃以下发酵果糖生产酒和生物乙醇(一般酵母的发酵温度多在30 ℃左右),适合利用低温酶,同时降低了因原料高温加热及冷却造成的能耗损失。
低温酶也普遍存在一些问题,酶的生产、保存等需要酶具有较好的热稳定性,而低温酶热稳定性差,需要在保证活性的同时提高热稳定性;随着温度降低,酶的催化活性也随之降低,在低温条件下,低温酶较中高温酶的活性相对较高,但为了满足应用需求,仍然需要提高其低温活性。因此,本实验室通过理性设计方法增加低温外切菊粉酶InuAGN25的离子键,设计了8点突变的突变体酶Mut8S,Mut8S的最适pH值为6.5,比InuAGN25的pH值提高0.5,最适温度为40 ℃,相较于InuAGN25降低5 ℃,50 ℃处理60 min仍有100%的酶活,表明其热稳定性高于InuAGN25[47];本实验室还通过删除位于InuAGN25N端的3个氨基酸(Q23、T24和G25),得到了突变体酶MutQ23△3。突变体酶MutQ23△3的最适温度为45 ℃,与InuAGN25相同,但MutQ23△3经50 ℃处理60 min后,仍有100%的酶活,表明突变体酶MutQ23△3的热稳定性也高于InuAGN25[48]。Zhou等[3]通过融合IBM(inulin-binding module),得到外切菊粉酶突变酶rINUIBM,该突变酶的催化效率(kcat/Km(app))显著高于野生酶rINU,最适温度(60 ℃)比rINU高5 ℃,pH稳定性及热稳定性有所提高,其最适pH值(4.5)与rINU相同。Arjomand等[15]采用定点突变方法删除6个相邻的loop区片段,得到外切菊粉酶突变株△6SL,该突变株的热稳定性变差,表明该loop区片段对外切菊粉酶的热性质有一定的影响。Arjomand等[18]采用定点突变的方法突变催化域的1个组氨酸残基,得到H192A突变株,该突变酶的热稳定性及催化活性均降低,表明His192对外切菊粉酶的热性质有一定的影响。
2.3 比活力和动力学
不同来源的外切菊粉酶比活力和对菊粉的米氏常数差异均较大,即使是同一种属的外切菊粉酶对菊粉的米氏常数也如此(表2),如曲霉属中的Aspergillusawamori和AspergillustubingensisCR16来源的外切菊粉酶的米氏常数分别为0.003和1.25 mmol/L[16,19,22-23]。
2.4 抑制剂和激活剂
金属离子、有机试剂和表面活性剂对不同的外切菊粉酶均有不同的影响(表2)。Hg2+几乎对所有的外切菊粉酶均具有抑制作用;Ag+抑制了大部分外切菊粉酶的活性,却提高了Penicillium来源的2个外切菊粉酶活性[27];EDTA对曲霉属[22]、青霉属[45]、链霉菌属[35]、节杆菌属[38]和克鲁维酵母菌属[31]来源的外切菊粉酶均具有抑制作用。
2.5 菊粉酶的结构及催化机制
菊粉酶是糖苷水解酶32家族(GH32)的一员,此家族有共同的三级结构特征,含2个结构域,N端结构域为催化域,是由β-折叠形成的5叶片螺旋桨结构;C端为β-折叠形成的似三明治状结构(图2)[49]。推测C端结构对外切菊粉酶的多聚体形成、酶与底物结合等起作用。本实验室曾尝试将C端去除,发现得到的突变体不能正常表达,也检测不到外切菊粉酶酶活(结果未发表),表明C端对外切菊粉酶的结构和功能产生了重要的影响,其作用机理还需要进一步研究。
菊粉酶的催化机制为双替位机制。2个酸性氨基酸残基(Glu和Asp)在该机制中起主要的催化作用[49],在这个催化过程中,去质子化的氨基酸Asp41首先作为亲和试剂攻击底物糖基的异头碳,从而与糖基形成共价中间体,此时,氨基酸Glu241提供质子进行酸催化,从而促进底物离去基团发生解离,致使糖苷键断裂,接着Glu241发挥碱催化作用,激活水分子为受体分子,促使共价中间体的糖基与酶解离完成水解过程。
3 菊粉酶基因的异源表达
3.1 菊粉酶基因在大肠埃希菌表达系统中的表达
大肠埃希菌表达系统是最先用于表达外源基因的表达系统之一,该表达系统的机制也研究得较为成熟。大肠埃希菌遗传背景清晰,传代时间短,生长繁殖快,转化和转导效率高,营养要求简单,并能高效表达外源基因[50]。随着大肠埃希菌表达系统相关技术的成熟,在载体和菌株方面可有很多选择[51]。此外,大肠埃希菌外源基因产物的表达水平较高、操作方便,较其他基因表达系统有一定的优势[52]。因此,大肠埃希菌是目前基因工程中应用较广泛的蛋白质表达系统[53]。
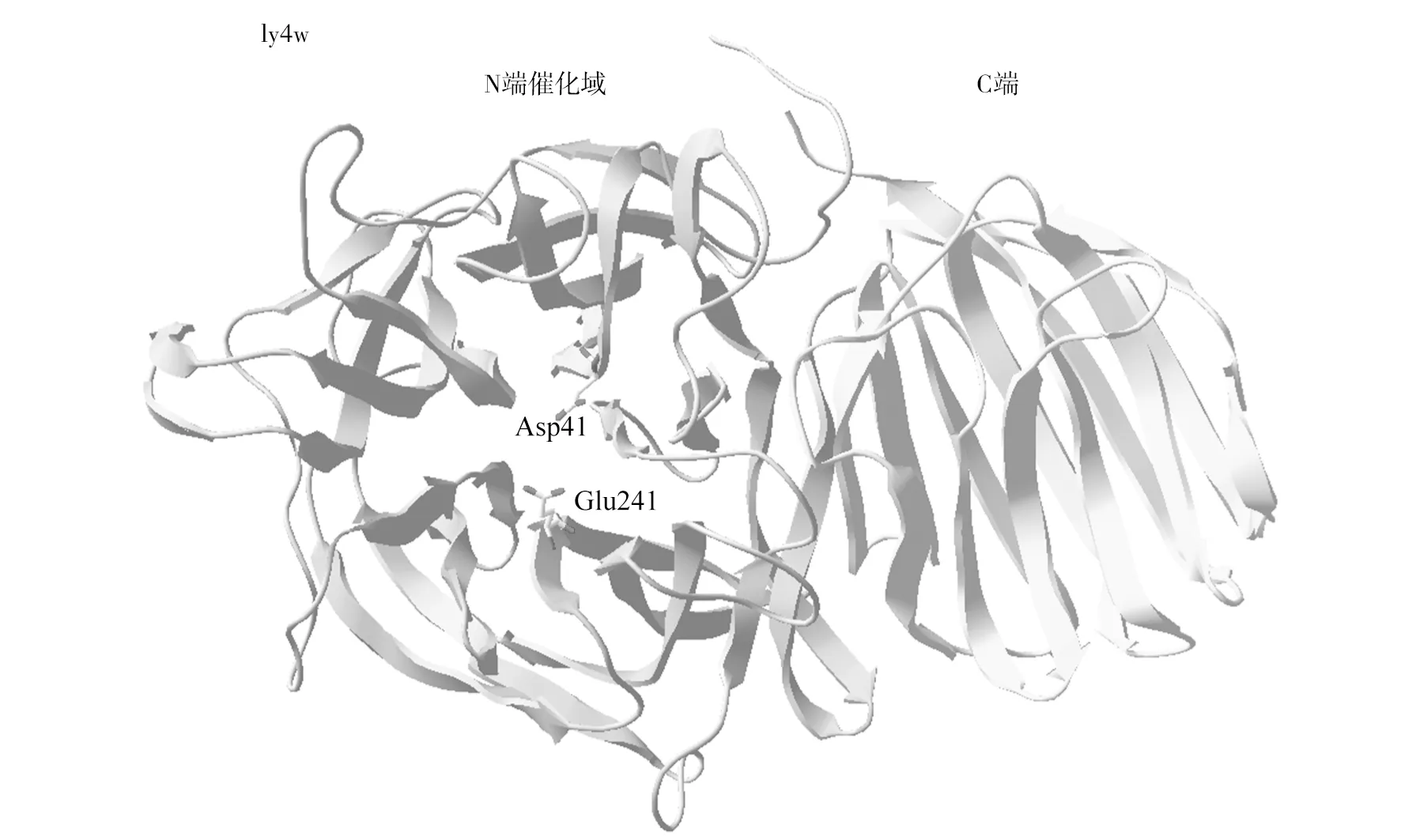
图2 菊粉酶的三级结构Fig.2 Three-dimensional structure of inulinase
来源于原核生物和真核生物的外切菊粉酶基因在大肠埃希菌中均得到成功表达。Kwon等[13]将来源于BacilluspolymyxaMGL21的外切菊粉酶基因inu在E.coli中表达,其理论蛋白分子量为55.5 kDa,Km和最大反应速率Vmax分别为0.7 mmol/L和2 500 μmol/(min·mg)。同年,Tsujimoto等[41]将来源于GeobacillusstearothermophilusKP12899(生长温度为41~69 ℃)的外切菊粉酶基因inuA在E.coliHB101中表达,其重组酶分子量为54 kDa,且该重组酶酶学性质与天然酶一致,首次获得了重组酶的晶体。次年,Kim等[34]将来源于Bacillussp. snu-7的外切菊粉酶基因连接pRESET B 载体并在E.coliBL21(DE3)PLysS中过表达,其重组酶蛋白分子量为60 kDa,Km和Kcat分别为2.3 mmol/L和358.0/min。来源于真核生物的外切菊粉酶基因也能在大肠埃希菌表达系统中表达,Chen等[17]将来源于AspergillusficuumJNSP5-06的外切菊粉酶基因的两个外显子单独扩增,通过overlap PCR结合在一起,并在E.coli表达,重组酶分子量为63 kDa,并在大肠埃希菌细胞上清液中测得最高酶活力达59.24 U/mg。Yedahall等[21]将来源于Aspergillusniger12的外切菊粉酶基因第一次在大肠埃希菌中进行异源表达,重组外切菊粉酶的蛋白分子量约为81 kDa,以菊粉作为底物,其动力学参数Km和最大反应速率Vmax分别是5.3 mmol/L和402 μmol/(min·mg)。Arjomand等[18]将黑曲霉外切菊粉酶基因及其突变体在大肠埃希菌中克隆表达,H192A突变体最大反应速率降低1.13倍,从野生酶的4 384.3 mol/(min·mg)降到了3 873.6 mol/(min·mg),Km值增加1.7倍,从1.9 mmol/L增加到3.2 mmol/L,除此之外,酶的催化效率降低了约2倍。
本实验室将黑颈鹤粪便分离菌Sphingobacteriumsp. GN25的外切菊粉酶基因在E.coliBL21 (DE3)中表达,酶活达290.9 U/mg[40];将来源于Sphingomonassp. JB13的外切菊粉酶基因在E.coliBL21 (DE3)中表达,其重组酶分子量为54 kDa,酶活达73.7 U/mg[37],该研究首次报道了一种耐洗涤剂、耐盐、耐蛋白酶的外切菊粉酶;将来源于Arthrobactersp. HJ7外切菊粉酶基因在E.coliBL21 (DE3)中表达,重组酶rInuAHJ7的分子量为95.1 kDa,酶活达44.4 U/mL[38],该研究首次报道了节杆菌来源的外切菊粉酶,该酶具有高分子量(95.1 kDa)并且在3.0%~20.0%NaCl浓度下还具有超过98%的酶活;将来源于Ar-throbactersp. MN8外切菊粉酶基因在E.coliBL21 (DE3)表达,重组酶rInuAMN8分子量为59 kDa,酶活达62.1 U/mL[39]。
3.2 菊粉酶基因在酵母表达系统中表达
单细胞真核生物酵母与原核生物大肠埃希菌相比,除了具有原核生物特点(易培养、繁殖快、遗传操作简单等)外,还具有真核生物在表达时对蛋白质进行正确的加工、修饰及合理的空间折叠等功能的特点,弥补了大肠埃希菌系统缺乏的蛋白质翻译后加工、修饰的不足[54]。
Zhang等[55]将来源于菊芋的基因Ht1-FEHI和Ht1-FEHII分别在PichiapastorisX-33中表达,并对其酶学性质进行了测定,外切菊粉酶Ht1-FEH I的Km和Vmax分别为0.68和0.001 29 mg/min;Ht1-FEH II的Km和Vmax分别为0.92和0.004 8 mg/min。将Ht1-FEHI和Ht1-FEHII分别在酿酒酵母6525中进行异源表达,酶活分别为2.44和2.98 U/mL。Wang等[25]通过RACE PCR方法从Penicilliumjanthinellumstrain B01中得到外切菊粉酶基因inuA1的全长cDNA,并将inuA1亚克隆到pPICZaC 表达载体,在P.pastorisX-33中成功过表达,纯化的重组酶分子量为100 kDa,在发酵液中的最高酶活达272.8 U/mL。Cao等[32]将来源于CryptococcusaureusHYA的外切菊粉酶基因亚克隆到pPICZaA表达载体并在P.pastorisX-33中表达,重组酶分子量为60 kDa,重组酶酶活为16.3 U/mL。Ma等[28]将来源于Kluyveromycescicerisporus的外切菊粉酶基因kcINU1在P.pastorisX-33中表达,重组酶分子量为90 kDa,重组酶酶活为45.2 U/mL。
王婧等[56]将来源于克鲁维酵母菌的基因inuB1连接pPIC9K表达载体,转化到P.pastorisGS115,获得GS115/inuB1菊粉酶基因工程菌。GS115/inuB1经甲醇诱导发酵表达菊粉酶,表观分子量为90 kDa,比酶活性为12.29 U/mg。Zhang等[29]将来源于克鲁维酵母KW02的外切菊粉酶基因在P.pastorisGS115中表达,重组酶酶活为52.0 U/mL,是野生酶的12倍,重组酶分子量为85 kDa,理论分子量为62 kDa。祝林等[57]将来源于克鲁维酵母菌ATCC12424的外切菊粉酶基因构建了外切菊粉酶毕赤酵母重组菌株GS115(pHBM1200)、GS115(pHBM1201),并进行发酵培养,表观分子量为90 kDa,将外切菊粉酶用去糖基化酶处理后,分子量为60 kDa,菌株GS115(pHBM1200)表达的外切菊粉酶酶活最高为89.43 U/mL,菌株GS115(pHBM1201)表达的外切菊粉酶酶活最高为14.828 U/mL。熊伍平等[31]将来源于KluyveromycesmarxianusDSM 5418的外切菊粉酶基因kcINU1在P.pastorisGS115中表达,重组酶分子量为90 kDa,理论分子量60 kDa,重组酶酶活为15.27 U/mL。
Zhang等[29]在Saccharomycessp. W0尿嘧啶突变株中异源表达来自季也蒙毕赤酵母中的基因INU1,在培养发酵72 h后,重组菌所产的外切菊粉酶活力达到34.2 U/mL。Wang等[59]将来源于P.guilliermondiistrain 1外切菊糖酶基因INU1转到Saccharomycessp.W0尿嘧啶突变体,获得菌株MguINU1-04,该菌株在72 h内可产生34.8 U/ml的外切菊粉酶活性,经过5次连续分批培养,该菌株能稳定地产生较高的菊粉酶活性。Zhang等[60]将来源于海洋酵母属的flavinogenieW14-3外切菊粉酶基因连接pMIRSC11载体并在Saccharomycessp.W0中重组表达,重组酵母菌W14-3-INU-112酶活为16.8 U/mL。Wang等[61]构建了S.cerevisiae重组菌株JZH-InuMKC,共表达基因InuC和InuMK1,该重组菌培养72 h,胞外菊粉酶活达到14.8 U/mL。
综上所述,酵母表达系统中酵母表达的外切菊粉酶基因来源于植物、酵母、霉菌,多为真核生物基因;表达宿主多为P.pastorisX-33、P.pastorisGS115和Saccharomycessp.W0尿嘧啶突变体。
4 外切菊粉酶的应用
虽然菊粉在饮料、乳制品、保健品等方面应用较为广泛,但菊粉甜度低、水溶性较差[1]等问题仍然对产品品质造成影响,利用外切菊粉酶能水解菊粉生成90%~95%[36]的果糖这一特性,将果糖广泛应用于医药工业、食品工业和能源工业(图3),对菊粉进行更深层次、高附加值的生物产品开发将成为充分利用丰富的菊粉资源的新方向。
4.1 外切菊粉酶在高果糖浆生产中的应用
高果糖浆(High-fructose syrup)被广泛用于食品和医药工业。1970年以来,各国最初是以淀粉和菊粉为原料,利用酶水解法和酸法制备果糖。酸法生产果糖产量虽高,但色素重、附属产物多,不容易分离炼制。以淀粉为原料,利用酶法生产果糖,至少通过α-淀粉酶的液化、糖化酶的糖化和葡萄糖异构酶的异构化三步反应才能从玉米淀粉中得到42%的高果糖浆[62],利用外切菊粉酶水解菊粉生产果糖糖浆,只需1步酶解,果糖含量高达90%~95%,因此该方法具有转化过程简单,产物单一且纯度高、低污染的优点,是目前生产超高浓度果糖糖浆的优良方法[62]。王建华等[63]在酶法制备高果糖的优化时发现,15.0%的菊糖添加22 U/g的酶量,50 ℃反应6~36 h,底物水解率约95%,其中果糖含量占水解生成物的95%以上,葡萄糖含量小于5%,不含其他糖。Singh等[64]用离子交换树脂将来源于KluyveromycesmarxianusYS-1的外切菊粉酶进行固定化处理,并用25 IU的固定化外切菊粉酶55 ℃条件下分别发酵Asparagusracemosus来源的菊粉和纯菊粉,4 h内分别产生了39.2和40.2 g/L的果糖,即分别产生了85.5%和92.6%的总还原糖。Singh等[27]利用来源于P.oxalicumBGPUP-4的外切菊粉酶,在4 h、125 r/min条件下,菊粉水解率可达91.1%,总还原糖释放量达45.55 g/L,其中含有42.99 g/L的果糖和2.56 g/L的葡萄糖。
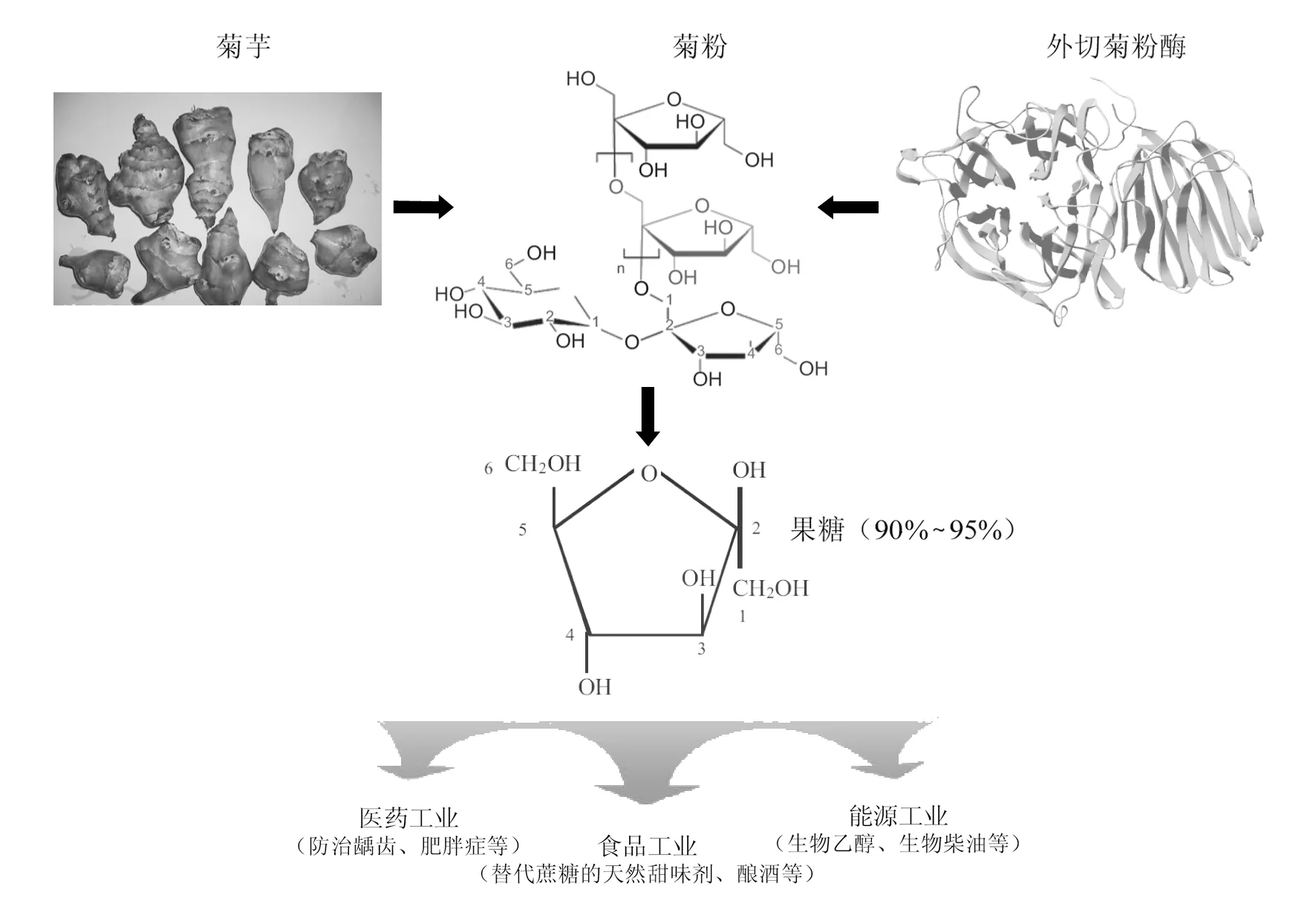
图3 外切菊粉酶及其应用Fig.3 Exo-inulinases and their industrial applications
4.2 外切菊粉酶在酒精生产中的应用
利用外切菊粉酶发酵生产酒精,为酒精的生产提供了一条新途径。产菊粉酶微生物与酿酒酵母同步糖化菊粉或菊芋粗提液发酵生产酒精,菊芋粗提液几乎能被完全利用,且不需要再添加其他营养成分,酒精得率达96%[65]。同步糖化法比先酸解或酶解菊粉,再发酵果糖生产乙醇的两步法具有更多优势,省去了菊粉酸解或酶解的步骤,流程简化,成本降低,同步糖化发酵法还可以减少或去除菊粉水解产物的积累,进而降低产物对菊粉酶的抑制作用,有利于保持较高的生产强度,从而具备优良的工业化生产特点[66]。Zhang等[58]在Saccharomycessp. W0尿嘧啶突变株中异源表达来自季也蒙毕赤酵母的基因INU1,在培养72 h后,可直接将菊粉水解发酵生产酒精,发酵液与酒精的体积分数为100∶13.7,果糖的转化率高达99.1%。吕跃钢等[67]将酿酒酵母与菊粉酶共同固定化,以菊芋为原料,在催化温度30 ℃、pH值5.5、糖浓度20%、转速为13.5 mE/min条件下,酒精发酵速率最快,发酵24 h,酒精转化率高达98.5%,酒精含量在发酵醪中达11.98%(体积分数)。Wang等[59]将外切菊糖酶基因INU1转到Saccharomycessp. W0尿嘧啶突变体中,获得菌株MguINU1-04并能利用30.0%菊粉进行发酵,获得14.7%(体积分数)的乙醇,乙醇产率高于0.386 g/g菊粉。Wang等[61]构建的二倍体菌株JZD-InuMKCP,其乙醇产量达到了理论最大值,用该菌株发酵200 g/L菊粉时,乙醇产量达到2.44 g/(L·h),发酵250 g/L的耶路撒冷朝鲜蓟块茎粉时,乙醇产量达3.13 g/(L·h)。Zhang等[60]将重组酵母菌W14-3-INU-112以250 g/L的菊粉作为底物,发酵168 h,能产生12.5%(体积分数)的乙醇。Yuan等[24]将来源于Candidakutaonensis的外切菊粉酶基因在S.cerevisiaeJZ1C、JZ1C-inuKM和JZ1C-inuCK中进行表达,并在48 h内发酵200 g/L的菊粉,分别产生0.34、0.34和0.38 g/g的乙醇。
4.3 外切菊粉酶的其他应用
外切菊粉酶还可应用到生物柴油、医药等行业。Shi等[6]将外切菊粉酶和内切菊粉酶基因在Yarrowialipolytica中共表达,得到转化株X+N8,该转化株发酵72 h,菊粉酶酶活达到124.33 U/mL,发酵菊粉78 h,可得到41.87%(质量分数)的单细胞油,细胞干重达13.63 g/L,产物中超过95.01%的脂肪酸为C16~C18,可以做为生物柴油的原料。Jiang等[68]通过Clostridiumtyrobutyricum异源表达外切菊粉酶基因,利用菊芋产氢。Petrova等[2]利用LactobacillusparacaseiDSM 23505产生外切菊粉酶,将136 g/L的菊苣粉(89.3%菊粉和10.7%的蔗糖、果糖和葡萄糖混合物)完全转化为123.7 g/L的乳酸。
5 展 望
为了更好地满足应用需求,需要从新的环境中进一步发掘新的外切菊粉酶及菌种,或将现有外切菊粉酶进行理性设计或定向进化改良,得到高酶活、耐产物抑制、具低温活性、热稳定性好、在低pH条件下具有最优的活性和稳定性、耐受乙醇及耐受蛋白酶的外切菊粉酶,同时得到能高效表达外切菊粉酶的菌种。需要对具有某种酶学特性(例如低温活性)的外切菊粉酶进行晶体结构解析,找到影响该酶学特性的氨基酸和结构,通过突变进一步明确这些氨基酸和结构的功能,进而揭示这些酶学特性的机理,这将有利于指导外切菊粉酶的改良,为外切菊粉酶应用于生产提供参考。

