CCCG-WT-2016方案治疗43例Wilms肿瘤临床分析
田小毛 马 伟 石秦林 陆 鹏 刘 星 林 涛 何大维 魏光辉
重庆医科大学附属儿童医院泌尿外科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室(重庆 400010)
Wilms瘤(Wilms tumor,WT)又称肾母细胞瘤,约占儿童癌症发生率5.5%,也是儿童期最好发的肾脏恶性肿瘤;中位发病年龄约3.2岁,无性别倾向[1]。由于肾母细胞瘤肿瘤组织对放化疗敏感,采用手术切除联合放化疗治疗大部分患儿预后良好,国外报道5年生存率达85%~90%[2]。国际上以美国儿童肿瘤协作组(Children's Oncology Group,COG)和欧洲儿童肿瘤协会(International Society of Pediatric Oncology,SIOP)制定的放化疗方案为主,国内通常采用COG的治疗方案,尽量早期切除肿瘤。2017年中国小儿肿瘤专业委员会(Chinese Children Cancer Group,CCCG)在COG方案的基础上结合目前国内治疗现状及国际研究进展提出符合国情的CCCG-WT-2016方案[3]。本文回顾分析采用CCCG-WT-2016方案治疗的肾母细胞瘤患儿的临床资料。
1 对象与方法
1.1 研究对象
收集2017年3月—2019年3月于重庆医科大学附属儿童医院初诊并随访的肾母细胞瘤患儿的临床资料。纳入标准:①年龄≤18岁;②术后病理活检证实为肾母细胞瘤;③根据术中情况、CT检查及病理报告准确分期;④采用CCCG-WT-2016方案行放化疗;⑤术后正规综合治疗;⑥拥有完整的病历和随访资料。排除标准:①术后分期和病理类型不能明确;②治疗中断或失访。
1.2 方法
1.2.1 临床资料收集 通过调取住院病历收集患儿的基线资料,包括性别、发病年龄、发病侧别、就诊主诉、术前化疗情况;根据手术记录收集患儿术中包膜破溃情况、初始临床分期;根据CT检查、手术记录和术后病理结果获得肿瘤病理类型、术后分期、化疗方案等。
1.2.2 化疗方案 入组患儿均采用CCCG-WT-2016方案治疗,见表1;放疗指征:除I~II期FH型外均需放疗,剂量10.8Gy。
1.2.3 术后分期与病理分型 术后分期参照CCCGWT-2016最新标准[3]:Ⅰ期,肿瘤局限于肾脏并完整切除;Ⅱ期,肿瘤完整切除伴肾包膜、肾窦或肾血管局部浸润;Ⅲ期,局限于腹部的非血性转移(腹腔内淋巴结转移、腹膜浸润或种植、肿瘤破溃、切除不完整或切缘阳性)或接受术前化疗者;Ⅳ期,血源性转移(肺、肝、骨、脑)或腹、盆腔外淋巴结转移;Ⅴ期,双侧WT。病理分型沿用COG病理分型系统[4],根据肿瘤组织间变细胞的比例分为预后良好型(favorable histology,FH)、预后不良型(unfavorable histology,uFH);其中uFH型包括局灶间变(focal anaplastic histology,FA)和弥漫间变型(diffuse anaplastic histology,DA)。部分患儿一期完整切除困难考虑术前化疗,术前化疗后无法明确间变细胞的患儿,参考SIOP病理组织学标准[5],分为上皮为主型、间叶为主型、胚芽为主型、混合型、退化型(包括完全坏死型)。
1.2.4 随访 所有患儿门诊随访至2020年4月1日,常规随访血常规、生化、腹部彩超、胸片,血源性转移病灶增加CT扫描,采用电话、微信等方式补充随访资料。主要随访结果为治疗情况和生存状态,治疗情况包括术后化疗周期、是否复发(包括瘤床复发以及血源性转移)、复发部位以及复发后治疗情况(完全缓解/部分缓解/进展);采用K-M方法绘制总生存曲线和无复发生存曲线描述患儿的生存状态,并估计2年总生存率(overall survival,OS)、2年无复发生存率(relapse-free survival,RFS),其中总生存率中的生存时间指术后至随访终点或死亡的时间间期,无复发生存率中的生存时间指术后至随访终点、死亡或出现复发的时间间期。次要随访结果为治疗相关不良反应,包括脓毒症、骨髓抑制、呼吸道感染和药物性肝损害,其中脓毒症参考中国脓毒症/脓毒症休克急诊治疗指南[6]临床诊断;骨髓抑制程度参考WHO抗癌药急性及亚急性毒性反应分度标准分级[7],以最严重一次为准,并进一步分析在各项指标(白细胞、粒细胞、血红蛋白、血小板)中的骨髓抑制分布;呼吸道感染定义为呼吸道症状合并阳性影像学或体征;药物性肝损害定义为放化疗期间AST/ALT升高1倍及以上。

表1 CCCG-WT-2016标准
1.3 统计学分析
采用GraphPad Prism 8以及SPSS13.0统计软件进行数据处理。非正态分布计量资料以中位数(四分位数间距)表示;采用K-M方法绘制生存曲线,并估计2年OS和2年RFS。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
共43例患儿纳入研究,男23例、女20例。初诊时左侧发病23例、右侧19例,双侧发病1例;其中1例术前以左侧无痛性包块就诊,术后确诊为双侧WT。就诊时以无痛性腹部包块为主诉27例、肉眼血尿8例、腹痛4例、常规体检发现3例、呕吐1例。33例前期行肾脏肿瘤切除术,9例术中出现破溃;10例患儿经术前评估后使用术前辅助化疗,术中破溃1例;两组术中破溃率差异无统计学意义(27.3%对10.0%,χ2=0.25,P=0.618)。2例术前化疗后肿瘤组织无法分辨间变类型(SIOP分型诊断为坏死为主型、间叶为主型),根据SIOP危险程度分别归类为COG系统FH型、uFH型。见表2。

表2 43例肾母细胞瘤患儿临床特征 [n(%)]
2.2 治疗情况
除1例双肺复发患儿需继续接受强化化疗方案外,其他患儿均已结束治疗。4例患儿在随访期内死亡,4例出现复发。2例双侧WT接受术前化疗后行NSS术(保留肾单位手术),术后采用WT-2016(6)方案化疗,随访期间未复发及死亡。4例死亡患儿中2例死于复发、1例死于肿瘤进展、1例死于脓毒症休 克。
所有复发患儿均接受强化化疗方案[OPEC/OPAC方案,(长春新碱+环磷酰胺+卡铂+表阿霉素)/(长春新碱+环磷酰胺+顺铂+足也乙甙),每隔4周交替)],接受强化治疗中位时间16.68月(8.10~26.37月)。1例患儿获得完全缓解,1例部分缓解,2例出现进展;截止随访终点,2例存活,2例死亡。4例复发患儿中,肺部转移3例(其中1例肿瘤原位复发合并肺部转移)、纵膈转移1例;分期:Ⅱ期1例、Ⅲ期2例、Ⅳ期1例;分型:FH型4例。
2.3 生存分析
所有患儿随访中位时间24.1月(7.8~37.8月);死亡4例,复发4例,中位复发间期5.4月(3.5~11.4月),所有患儿复发截点位于术后2年内。估计2年OS为(93.02±3.89)%,估计2年RFS为(90.58±4.49)%。见图1。
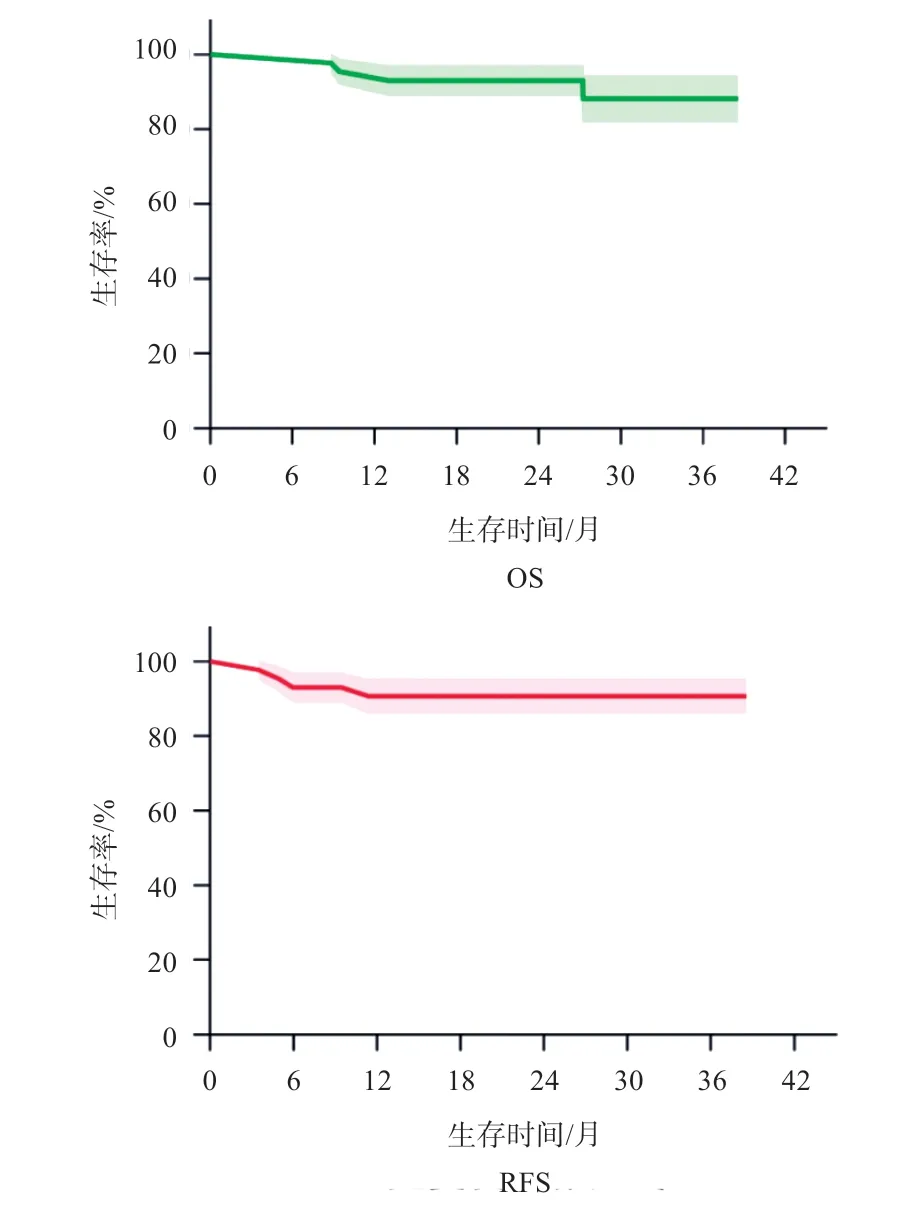
图1 43例肾母细胞瘤患儿OS和RFS生存曲线
2.4 不良反应
43例患儿中发生脓毒症6例(14.0%)、呼吸道感染8例(18.6%)、药物性肝损害3例(7.0%)、Ⅳ级骨髓抑制17例(39.5%);21例Ⅲ期患儿均出现不同程度骨髓抑制(100.0%),其他各期患儿(22例)中发生不同程度的骨髓抑制15例(68.2%),差异无统计学意义(χ2=0.71,P=0.400)。
复发组经过强化化疗方案治疗的患儿中1例发生脓毒症、2例发生呼吸道感染、2例发生药物性肝损害、4例发生Ⅳ级骨髓抑制。将所有复发前的患儿作为未复发组(43例),与复发组(4例)相比,未复发组患儿Ⅳ级骨髓抑制发生率较低(100.0%对39.5%,P=0.034)。见表3。
进一步细化骨髓抑制发生类型及程度,Ⅳ级骨髓抑制各种不良反应的发生率分别为:白细胞降低比例32.6%,中性粒细胞绝对值降低比例34.9%,血红蛋白降低比例9.3%、血小板降低比例23.3%。
3 讨论
当前,儿童肾母细胞瘤的初始治疗有两种不同的方法:SIOP倡导术前化疗,该方案可以减少手术期间肿瘤破溃从而降低术后分期;COG主张前期行肾切除术,然后开始化疗,其优点在于可以获得准确完整的病理组织学和分期信息。无论采用何种治疗策略,患儿总体生存率相似,均接近90%[8]。然而,初始治疗后复发以及提示不良预后病理类型、生物标志物的患儿生存率远低于90%,此外,一部分患儿出现与治疗相关的严重早期或晚期不良反应。因此,目前治疗方案优化的趋势在于改善生存率的同时将治疗不良反应最小化。
目前,国内儿童医学中心大多采用COG的治疗策略。CCCG的多中心大宗病例回顾表明,采用COGNWTS-5方案治疗的国内患儿预后较发达国家仍有差距(5年EFS仅80%,其中预后不良病理类型亚组仅71%),因此提出更高治疗强度的WT-2016方案,以改善国内WT患儿的预后情况。本研究表明,采用CCCG-WT-2016方案治疗儿童肾母细胞瘤总体生存率良好。相比目前国内广泛采用的NWTS-5化疗方案,该方案升级了化疗强度,2年总生存率和无复发生存率超过90%。另外,约9.30%的患儿出现复发,复发时间均在初始治疗的前2年内,与既往文献报道一致[9-12],且大约只有0.5%的患儿会发生远期复发[13]。因此,预计本研究患儿具有较优异的中远期预后。基于丰富的血流交换,肺部是最好发的血源性转移部位,本研究4例复发患儿中,3例(75.0%)为肺部转移,与既往研究结论一致。当前,广泛大剂量化疗仍然是复发患儿的主要治疗措施。本研究队列中一半的复发患儿死亡,幸存患儿需要经历严重的骨髓抑制。因此根据初始治疗、分期及病理分型评估复发后风险将是今后的治疗趋势。Irtan等[14]研究表明预后不良病理类型是肿瘤复发的独立预测指标。本研究中75.0%的复发发生在Ⅰ~Ⅲ期患儿中,病理分型均为预后良好型。考虑到许多复发病例没有特定的复发诱因,因此需要新的方法识别复发风险。COG最近的研究报告,染色体1 p和16 q的杂合性丢失及染色体1q增益与直接肾切除术中FH型WT患儿不良预后相关[15-16]。该生物标志物已被COG纳入最新的治疗方案作为个体化治疗的依据。SIOP-WT-2001试验也报告染色体1q增益可作为接受术前化疗FH型WT患儿的不良预测指标[17]。目前国内多中心的治疗计划由肿瘤分期和病理类型确定,随着检测技术及检测成本的改善,依靠相关生物标志物识别非间变型、低分期患儿的潜在复发风险,可以进一步改进国内WT患儿的治疗策略。
本研究中48.8%的患儿归为Ⅲ期,根据COG的分期系统,归为Ⅲ期WT患儿的分类原则包括淋巴结阳性、腹膜种植转移、肿瘤残留和肿瘤破裂。最新的WT-2016方案将术前化疗亚组归类为Ⅲ期(即对该亚组患儿升级治疗以减少复发风险),进一步增加了Ⅲ期患儿比例。国内广泛采用COG治疗策略,尽量前期切除肾脏肿瘤。本研究中,相比术前化疗的亚组,前期肾切除亚组术中破溃率有增高的趋势(27.27%对10.00%),既往研究同样表明前期肾切除 极大增加了术中肿瘤破裂的风险和Ⅲ期患儿的比例[18]。因此,对于术前评估术中有高破溃风险的患儿,可参考SIOP的治疗策略发挥术前化疗的优势,改善肿瘤术后分期分布,并且还可个体化评估肿瘤反应,鉴别化疗耐药、高风险的胚胎型肿瘤。

表3 肾母细胞瘤患儿放化疗后不良反应发生率 [n(%)]
研究发现,在Ⅲ期WT患儿中,合并淋巴结转移或肿瘤残留的患儿预后较差[11,19-20]。本研究队列中一半的复发患儿归类为Ⅲ期,鉴于Ⅲ期患儿较高的比例,在未来的临床试验中,具有不同Ⅲ期标准的患儿可能会接受不同强度的治疗。另外,相关研究表明,Ⅲ期最常见的定义标准是局部淋巴结阳性(约38%)[18],而淋巴结取样个数与淋巴结阳性率呈正相关[21]。CCCG的回顾性分析发现Ⅱ期与Ⅲ期患儿5年EFS无显著差别,可能与分期不明确有关。由于Ⅱ/Ⅲ期患儿根据淋巴结转移状态调整分期,术中应规范收集淋巴结,准确分期,避免治疗方案降级。
近年来,除了探索新的治疗策略,越来越多的学者关注放化疗带来的近远期不良反应。回顾本研究近期不良反应的发生情况,79.1%患儿发生不同类型的不良事件,39.53%患儿合并严重骨髓抑制;13.95%合并脓毒症,其中1例死于脓毒症休克。对严重骨髓抑制的进一步细化,最常见的血液不良反应是严重白细胞/粒细胞缺乏,其次为极重度贫血或血小板减少。严重的不良反应不仅危及患儿生命,同时增加了患儿医疗成本和心理负担,需要进一步干预(如完善指标检测、提高免疫功能、改善营养状况、应用粒细胞集落刺激因子等措施)避免治疗相关死亡同时减少不良反应发生。晚期后遗症可能包括与腹部放疗有关的原发恶性肿瘤[22]、女性妊娠并发症[23-24],与肺部放疗有关的远期肺纤维化、心脏病[25],以及与WT治疗相关的肾脏损害和继发性高血压等[26-27]。一项中位随访21年的大规模回顾性研究显示,减少治疗强度有助于降低儿童癌症远期死亡率[28]。因此,目前的研究趋势旨在保持WT患儿良好生存率的同时,减少急性和远期治疗毒性。在现有治疗策略中减少具有明显远期不良影响的药物是一项巨大挑战,需要更多的分子生物学、临床预后指标提供科学的依据。
总之,WT-2016方案治疗儿童肾母细胞瘤具有优异的预后,依靠生物标志物及其他临床预后因素可以进一步改善WT患儿治疗策略,同时需要有效干预措施降低治疗毒性。

