再次肾脏移植临床管理及疗效分析
——附17例分析
闫晓冬 石炳毅 徐俊楠 刘志佳 陈昌庆 洪欣 王强
再次肾移植是指在首次移植手术失败或移植物失功后,再进行的第2次、第3次或更多次的肾移植术[1]。与首次肾移植相比,再次肾移植在失功的移植肾脏处理、透析时机、免疫脱敏、免疫诱导及手术难度都存在明显不同。解放军总医院第八医学中心和北大国际医院泌尿外科依据中心经验结合国内外报道的经验制定再次肾脏移植管理策略[2-4],并对17例再次肾移植病人进行规范管理。17例病人均行公民逝世后器官捐献(donation after citizen death,DCD)供肾再次肾脏移植,取得了较好的临床效果。现报道如下。

图1 再次肾移植临床管理策略
对象与方法
一、对象
2017年6月~2019年6月在解放军总医院第八医学中心和北大国际医院泌尿外科行DCD供肾移植再次肾移植受者17例,其中解放军总医院第八医学中心15例,北大国际医院2例。再次肾脏移植均选择DCD供肾移植。移植标准:淋巴细胞毒实验<10%;抗体阳性病人DSA检测阴性,如确实不能完全躲避供者特异性抗体(donor-specific antibody, DSA),则DSA荧光强度必须<3000。
二、方法
1.再次肾脏移植管理策略见图1。第一步,失功移植肾脏是否切除:建议1年或1年以内失功的移植肾脏给予切除,包括外科严重并发症,感染性因素、部分复发性肾病,BK病毒感染以及免疫性因素(如超急性排斥反应)导致的移植肾脏失功;同时1年以上失功的移植肾脏病人也要结合病人的临床症状,血尿,疼痛,全身慢性感染和肿瘤发生等因素综合考虑,此外建议保留移植肾。第二步,对于保留失功移植肾脏的病人恢复透析的时机:建议透析指征为eGFR 6~9 ml/min或低于该值,当然是否恢复透析还要更多的参考临床症状和实验室参数,不能一味以数值为标准。第三步,脱敏治疗:对于预存抗体阳性病人采用美罗华+静注人免疫球蛋白(intravenous Immunoglobulin, IVIG)+血浆置换进行脱敏治疗。具体方案:术前3个月常规美罗华100 mg静脉滴注;血浆置换隔日1次,连续5次。脱敏治疗超过3个月,术前常规美罗华100 mg静脉滴注;如果首次脱敏治疗超过6个月仍没有完成肾脏移植,需要重新按首次脱敏治疗方案再实施一次脱敏治疗。第四步,髂血管的评估:再次肾移植前行髂血管动静脉CT三维成像,特别是第三次肾脏移植的病人,了解动脉、静脉走行及其原肾移植血管吻合情况。第五步,再次肾移植病人免疫诱导的选择:推荐选用ATG进行免疫诱导;对于高危病人在预脱敏治疗的基础上,建议美罗华100 mg+ATG+IVIG(预防剂量1 g/kg)免疫诱导;对于术前预存抗体阴性且存在感染风险的病人也可以使用注射用巴利息单抗免疫诱导。
2.免疫诱导:抗体阴性均采用抗胸腺细胞球蛋白(polyclonal anti-T-lymphocyte globulin, ATG)免疫诱导, ATG在移植肾血流开放前静脉滴注25 mg,开放后静脉滴注25 mg;术后第1日静脉滴注50 mg,第2,3,4日依据骨髓抑制情况决定每日静脉滴注25或50 mg,总剂量175~250 mg。抗体阳性采用ATG(同前)+美罗华(100 mg)+IVIG(1.5 g/kg) 进行免疫诱导。
3.维持免疫抑制药物:病人术后采用三联免疫抑制方案:他克莫司/环孢素+吗替麦考酚酯/麦考酚钠肠溶片+泼尼松。他克莫司血药浓度谷值:术后6个月内8~10 ng/ml,术后6~24个月6~8 ng/ml;24~36个月4~6 ng/ml。环孢素血药浓度:术后6个月内谷值150~200 g/ml,峰值800~1 000 ng/ml;术后6~24个月谷值100~150 ng/ml;24~36个月谷值80~120 ng/ml。对于高致敏病人,他克莫司/环孢素浓度一般选择不同时期目标浓度的上限为调整目标。泼尼松于停用ATG后第2天开始口服,起始剂量30 mg/d,每周递减5 mg,直至10 mg/d,维持12个月,12个月后根据肌酐、全身状态和尿常规改变调整为5 mg/d维持治疗。
4.观察指标:(1)术后急性排斥反应(acute rejection,AR):依据移植肾脏病理穿刺活检诊断。(2)移植肾功能延迟恢复(delayed graft function,DGF):定义为肾移植术后1周内至少需要进行1次透析治疗。(3)肺部感染和骨髓抑制。(4)受者和移植物1年存活率。
三、统计学处理
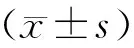
结果
1.一般情况:17例病人一般资料见表1。17例病人男性13例,女性4例;平均年龄47.2岁(28~71岁);二次移植14例(82.4%),三次移植3例(17.6%);移植肾切除5例(29.4%),移植肾保留12例(70.6%);预存抗体阳性脱敏5例(29.4%),抗体阴性非脱敏12例(70.6%)。HLA错配数3.2±0.9;血肌酐恢复水平:99.8 μmol/L(50~230 μmol/L)。
2.术后并发症:(1)AR:共4例(23.5%)。移植肾切除AR 20%(1/5);移植肾保留AR 25%(3/12)。脱敏(预存抗体阳性组)AR 20%(1/5);非脱敏(预存抗体阴性组)AR 25%(3/12)。见表1、表2。4例AR详细信息见表3。4例病人均行移植肾穿刺活检病理证实:3例为抗体介导与细胞性混合性AR,1例为细胞性AR;AR发生时间术后1个月内2例,术后40天1例,术后240天1例;3例AR纠正,1例在AR治疗过程中重度感染死亡。(2)DGF1例(5.9%),经透析治疗,术后7天脱离透析。(3)肺部感染:共6例(35.3%)。移植肾切除组肺部感染率20%(1/5例);移植肾保留组肺部感染率41.7%(5/12例),移植肾保留组肺部感染是移植肾切除组的2.1倍,但由于观察临床例数少,χ2=0.726,P=0.600,差异无统计学意义。脱敏组(预存抗体阳性组)肺部感染率40%(2/5例);非脱敏组(预存抗体阴性组)肺部感染率33.3%(4/12例)。见表1、表2。1例单纯细菌性感染,2例巨细胞病毒性肺炎,2例为卡氏肺孢子虫肺炎,1例混合性重度肺部感染(病人死亡)。(4)骨髓抑制4例,发生率23.5%,经对症治疗及停用ATG后治愈。(5)ATG过敏反应:无一例发生。
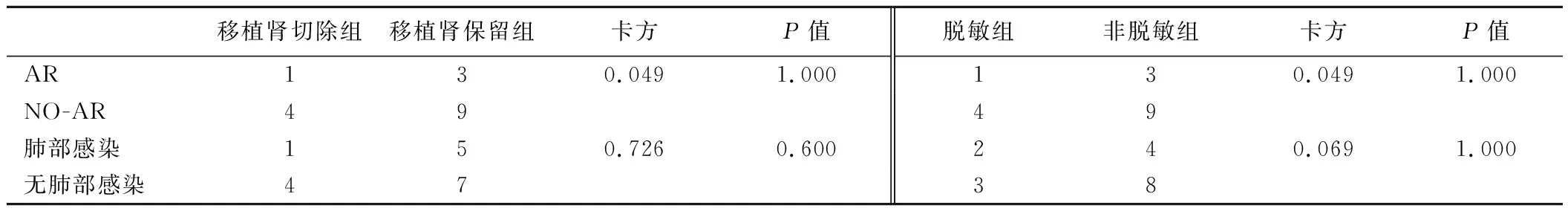
表2 再次肾移植术后AR和肺部感染

表3 4例病人移植术后排斥反应
3.随访:中位随访时间14.5个月(6~36个月),1年人肾存活率94.1%(16/17),1例(5.9%)死亡。死亡原因为肾移植术后AR治疗过程中重度感染。
讨论
随着移植外科技术发展吗,免疫抑制药物的更新以及免疫抑制方案的优化和规范,肾脏移植长期预后得到了明显改善[5]。然而,移植物失功率在第一年仍可高达10%左右,随后每年保持在3%~5%[6]。不同国家、不同中心肾脏移植移植物10年的存活率不尽相同,西班牙和美国移植物10年生存率分别为75.6%和76.0%[7],墨西哥移植肾10年生存率为72.78%[8],中国单中心大样本报道首次移植肾10年存活率为80%[9],即移植物10年的存活率波动在75%~80%,意味着移植10年后至少有约20%~25%的病人再度恢复透析。再次肾脏移植临床不避免,且会日益增多。本研究在2个移植中心2年内收集再次肾脏移植病人完成DCD供肾肾脏移植共17例,其中二次肾脏移植14例,第1次移植肾存活6天~20年;三次肾脏移植3例,第2次移植肾存活时间分别为1年、6年和12年。
移植前失功的移植肾脏是否需要切除,一直是临床争论的话题。Ayus等[10-11]分析1994~2004年之间美国肾脏数据系统中返回长期透析的10 951例肾移植受者中3 451例接受移植肾切除术的资料,移植肾切除可使全因死亡的风险降低32%(HR 0.68,95%CI:0.63~0.74),并发现移植物导致的慢性炎症是这类病人预后独立的危险因素,建议切除失功的移植肾。Johnston等[12]分析1995~2003年之间美国的19107例移植失败病人中采用移植肾切除术资料。在3 707例早期移植失败(移植存活时间<12个月)的病人中,56%病人选择移植肾切除,移植肾切除增加了死亡风险(HR 1.13,95%CI:1.01~1.26)。相比之下,在15 400例晚期移植失败(移植物存活≥12个月)病人中,27%的病人选择移植肾切除,移植肾切除反而降低了死亡风险(HR 0.89,95%CI:0.83~0.95);但同时还发现在早期移植失败病人中,移植肾切除可以使再次移植失败的风险降低(HR 0.72,95%CI:0.56~0.94),而在晚期移植失败病人中,移植肾切除可以使再次移植失败的风险增加(HR 1.20,95%CI:1.02~1.41)。Johnston认为,移植肾切除是否可使病人临床获益还不能确定。Lin等[13]采用Meta方法分析了13项研究(20项试验,纳入1 923例病人),结果显示,移植肾保留组与移植肾切除组相比较3年、5年移植物存活率显着更高,分别为OR=0.48(95%CI:0.34~0.69)和OR=0.65(95%CI:0.44~0.97)。但移植肾切除组5年人生存率更高,同时移植肾切除组PRA阳性率,AR和DGF发生率也相对高于移植肾保留组。移植肾切除组和移植肾保留组1年和10年移植物存活率,再移植后1年的血清肌酐水平结果并没有差别。本研究团队以移植物存活时间1年为界,1年以上采用移植肾保留,1年以下采用移植肾切除。在本研究中移植肾切除组5例(29.4%),移植肾保留组12例(70.6%);两组AR和肺部感染发生率分别为20%∶25%和20%∶41.7%,两组在AR发生率上没有差异,但移植肾保留组感染率明显高于移植肾切除组。
移植肾失功病人是否应尽早恢复透析研究较少。Cooper等[14]报道了一项大样本前瞻性研究,比较早期透析和晚期透析的临床差异,涉及32个中心纳入828例病人,早期透析组(eGFR 10~14 ml/min)和晚期透析组(eGFR 5~7 ml/min),平均随访3.59年,两组死亡率分别为37.6%(152/404例)和36.6%(155/424例),早期透析危险比为1.04(95%CI:0.83~1.30,P=0.75);两组心血管事件、感染或透析并发症比较无显着差异。早期透析病人生存率并没有得到改善。Gill等[15]回顾性分析USRDS登记系统中4 741例透析病人的生存状况,中位数随访时间为(15±11)个月,结果:死亡者透析开始时的eGFR明显高于存活者[(9.7±4.8) vs (8.0±3.7)ml/min/1.73 m2]。透析重新开始时eGFR每增加1 ml/min/m2死亡率增加4%(P<0.01)。Molnar等[16]采用倾向值评分方法分析747例移植肾失功的病人(< 0~14 ml/min)早期恢复透析的临床预后,发现病人较早返回透析往往与透析存活率下降相关,尤其是在健康、年轻和女性病人中。Pham等[2]分析移植肾失功恢复透析的优劣,建议将透析指征为eGFR 6~9 ml/min或低于该值。本研究中再次肾移植病人恢复透析就是将这个值作为参考,但还要更多的考虑病人的临床症状和实验室参数,做到个体化治疗。
再次肾移植与首次肾移植相比具有更高的免疫学风险。有研究表明,再次肾移植病人早期出现AR可高达33%~69%,其中约2/3为抗体介导的排斥反应[17-19],移植物丢失的风险增加了58.1%[20]。本研究致敏病人预存抗体阳性脱敏组5例,抗体阴性非脱敏组12例,预存抗体为阳性的病人常规术前进行脱敏治疗,再次移植均采用ATG免疫诱导,AR共4例,发生率23.5%,病理证实抗体介导的AR 3例(75%),仅1例(25%)为细胞性AR。
综上所述,再次肾脏移植病人逐年增加,合理有效的临床管理可以明显提高再次肾脏移植的人肾存活率。本研究涉及的临床病例少,随访观察时间尚短,再次肾脏移植管理策略还需要更大的临床数据,更前瞻性的研究来指导。

