移植肾继发和新发肾小球疾病诊治新进展
伍倩倩 倪雪峰 文吉秋
肾移植术后各类继发性肾小球疾病和新发肾小球疾病均会影响移植肾预后,常见的复发型继发性肾小球病变包括狼疮性肾炎(LN)、肾淀粉样变性、anti-肾小球基底膜(GBM)肾炎及抗中性粒细胞胞浆抗体(ANCA)相关性血管炎肾损害等;常见的肾移植后新发的肾小球疾病包括新发局灶节段性肾小球硬化、新发膜性肾病等,本文主要从各继发性肾小球病变肾移植术后复发和新发肾小球炎的危险因素、治疗、预后等方面介绍其诊治新进展。
一、继发性肾小球病变肾移植术后复发
肾移植后继发性肾小球病变指的是由于系统性疾病,如系统性红斑狼疮(SLE)、肾淀粉样变性、ANCA相关性血管炎、anti-GBM疾病相关的肾损害在肾移植后复发,并增加移植肾丢失的风险。
1. 肾移植后继发LN:肾移植后LN组织学复发率大约在25%~44%,但其临床复发率约0~5%[1-2]。复发性LN可发生在移植后第1周至16年,多数发生在最初10年[3]。肌酐升高、不同程度新发或恶化的蛋白尿及新发血尿是肾移植后复发性LN受者的主要临床表现,但其很少出现全身症状。有研究显示,移植前透析时间和移植前狼疮活动性与移植物失功无关,且移植前透析时间越长,发生急性排斥反应越多,预后更差[4],但也有观点认为,移植前透析时间越短,其依从性越差,发生移植物失功概率越大[5]。移植前血清学指标(包括补体和抗双链DNA抗体水平)并不能作为移植后移植物复发和疾病活动性的有效预测因子。复发性LN的一般治疗包括细胞毒性药物(如环磷酰胺)、糖皮质激素、神经钙蛋白抑制剂、嘌呤合成抑制剂(吗替麦考酚酯、硫唑嘌呤、咪唑立宾)等药物(表1),SLE病人应筛查抗磷脂抗体,若阳性,应在移植前积极治疗[1]。研究显示,SLE和其他导致终末期肾脏疾病(ESRD)的原因相比,病人的存活率、移植物排斥反应的累积发生率和移植肾存活率没有差异[6-7],且肾移植可通过减少心血管和感染相关死亡率从而提高狼疮病人的生存率[8]。因此,肾移植可作为狼疮病人可靠的治疗措施。研究表明,LN病人肾移植的肾结果与非LN病人相似[9]。

表1 各种继发性肾小球疾病在肾移植后复发的临床特点和治疗措施
2.肾移植后继发肾淀粉样变性:淀粉样变性是一种系统性疾病,肾脏是常见受累的器官,淀粉样变性导致的ESRD病人可以接受肾移植,特别是对于血液学反应达到非常好的部分反应(VGPR)、完全反应(CR)且没有严重心脏受累的病人。有报道,肾淀粉样变性病人肾移植术后的复发率为21.7%(13/60)。Heybeli等[10]根据移植前血液反应进行分组,发现与部分反应(PR)、不反应(NR)相比,达到VGPR、CR的轻链型(AL)淀粉样变病人(免疫球蛋白轻链型淀粉样变病人)可能获得良好的结果和较长的生存时间,CR似乎更优于VGPR,CR复发的时间明显长于PR(中位181个月 vs 81个月)。Angel-Korman等[11]提出,肾脏移植期间能够达到CR或VGPR的病人具有较好的预后。有报道显示,活体供者或死亡供者、供者的年龄和性别、诱导免疫抑制疗法与淀粉样蛋白复发风险之间无相关性[10],且在疾病进程的任意时段接受HDM/SCT或化学疗法的总体生存率和移植物生存率,Lambda和Kappa克隆之间无统计学差异[11]。有研究发现,有5%AL肾脏受累病人在确诊时就已经在进行透析治疗,这说明了诊断延迟[12],对此类病人,国际上通用的经验是通过常规活检来及早发现复发,尽早治疗。目前,已知的中位总生存率为123个月,移植物1年和5年生存率分别为98.3%和95.8%[10]。仔细处理潜在疾病预防复发,使用新的治疗方案(来那度胺[13]、硼替佐米、地塞米松)来治疗复发(表1),未来还需进一步研究来确定有无肾外病变的病人肾移植前最低的血液学反应程度以及合并肾淀粉样变的肾移植病人早期诊断策略。
3.肾移植后继发抗肾小球基底膜肾炎:抗肾小球基底膜疾病(抗-GBM)是由针对IV型胶原α3链非胶原结构域的自身抗体引起快速进行性疾病。由于免疫抑制剂的使用,患有抗-GBM疾病病人肾移植后复发率<5%(表1),且移植物失功也极为罕见[14]。Blosser等[1]提出,若移植前6~12个月血清中未检测到抗GBM抗体滴度,其复发的风险较低(表1)。抗GBM阳性病人为移植禁忌证,术前应当评估血清抗GBM抗体滴度(表2)。对于肾移植后继发抗肾小球基底膜肾炎复发的治疗与原发疾病治疗相似,如用血浆置换和环磷酰胺。
4.肾移植后继发ANCA相关性血管炎肾损害:抗中性粒细胞胞浆自身抗体(ANCA)相关性血管炎,包括肉芽肿伴多血管炎(GPA),显微镜下多血管炎(MPA)和嗜酸性肉芽肿伴多血管炎(EGPA)。Göceroglu等[15]研究发现其复发率为11.5%(13/113),移植物失功可能性也非常低。研究表明,移植时能否检测到ANCA滴度与复发率之间无显著差异[16],且不能预测复发[1]。报道显示,GPA相对于MPA病人的复发率更高,PR3-ANCA相对于MPO-ANCA阳性病人的肾外侵犯率更高[17](表2),复发风险更高[18-19]。当病人在移植前达到临床缓解时,移植可安全进行[1],移植物1年生存率为95%,5年生存率为83%,病人5年生存率为95%(表1)[16]。有研究提出,基于利妥昔单抗和环磷酰胺的复发治疗均有效诱导缓解,且利妥昔单抗似乎更具有优势。Gera等[20]研究发现,使用抗体诱导,MMF和他克莫司的治疗,均显示出较高的生存率和较低的复发风险。Geetha等[21]提出,病人和移植物的存活率与其他原因引起的ESRD病人相当。
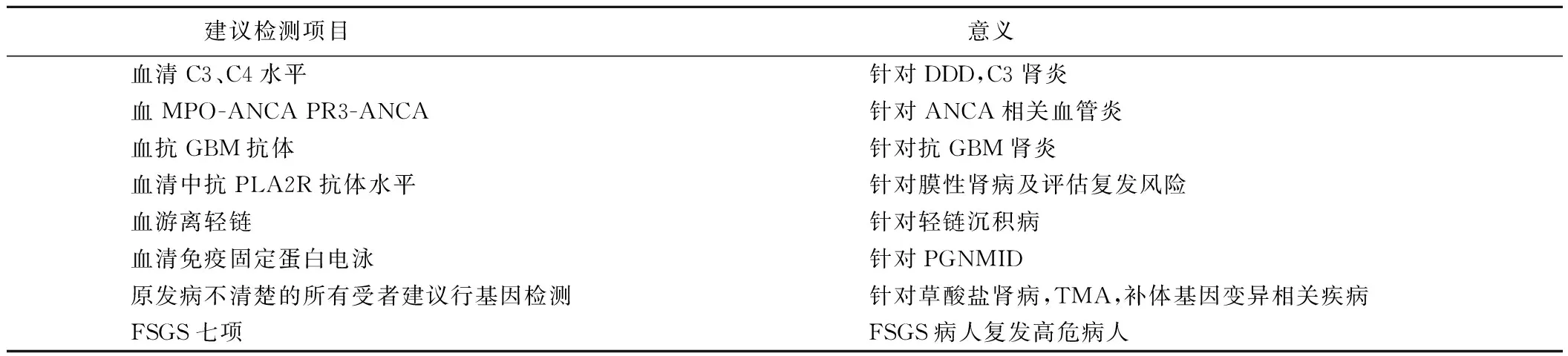
表2 针对肾移植术后原发病复发术前评估建议增加的内容
5.肾移植后继发糖尿病肾病:糖尿病肾病移植后复发率很难估计,因为20%肾移植病人可以出现移植后新发糖尿病。研究表明,大约40%的糖尿病病人在移植后6.7年的时间内出现了组织学复发[22]。1型糖尿病接受胰肾联合移植的病人同样也有糖尿病肾病复发的报道[23]。Vendrame等[24]报道糖尿病复发与自身抗体和CD4 T淋巴细胞介导的胰岛B细胞破坏有关。临床上,早期表现为微量白蛋白尿,而在晚期表现为肾病综合征范围的蛋白尿,最后导致移植肾失功。糖尿病相关的移植肾损害相对较轻,研究显示,75%的糖尿病肾病病人在肾移植后10年内不会复发[25]。研究显示[26]糖尿病病人和非糖尿病肾病病人相比,肾移植后病人的生存率和移植肾存活率没有差别,且移植使糖尿病肾病病人死亡风险降低了73%[27]。临床资料显示,对于移植前1型糖尿病病人,胰肾联合移植在病人生存率、移植物存活率、糖尿病并发症、生活质量等方面预后较好,而对于2型糖尿病病人的适用性和效果存在争议[23]。因此,胰肾联合移植被认为是1型糖尿病的ESRD病人的首选治疗(表1)。
目前认为糖尿病肾病不是肾移植禁忌证。糖尿病肾病的最大问题是心血管疾病和外周血管疾病,这些并发症可以影响移植肾存活率和病人的生活质量。因此肾移植术后的管理,包括血糖管理、血压管理和使用ACEI等药物至关重要,进行肾脏移植后,持续的血糖控制有助于改善同种异体移植的效果并提高病人的生存率。
6.肾移植后继发轻链沉积病(LCDD):轻链沉积病是一种副球蛋白相关肾脏病,肾脏是常见的受累器官。病人在肾移植后可以出现单克隆链或者轻链在移植肾沉积,肾移植术后移植肾轻链沉积病非常少见,且肾移植术后轻链沉积病容易复发。目前轻链沉积病病人为肾移植术相对禁忌。LCDD多发于中年男性,临床表现高血压、蛋白尿、肾功能不全、贫血[28]。LCDD病人复发后预后较差,有研究报道,5例复发病人有4例死亡,1例进入血液透析,另有个案报道1例死于多发性骨髓瘤,而1例在移植后13年还在存活(表1)[29]。
尽管LCDD受者易复发且易导致死亡,但对化疗敏感并可使轻链清除的病人仍可以考虑接受肾移植手术,对于血清中轻链没有减少至阴性的病人,不主张接受肾移植手术。目前,针对LCDD的治疗无统一标准。有资料显示,使用蛋白酶抑制剂硼替佐米和利妥昔单克隆抗体可以延迟LCDD复发,提高LCDD病人移植肾存活率[29-30]。有个案报道,2例肾移植术后复发LCDD的病例,均给与硼替佐米合并地塞米松治疗,1例血肌酐下降,血尿游离轻链比值正常,肾功能较前好转;1例治疗后合并感染和脓毒症,目前肾透析维持治疗,预后不佳[31]。因此,硼替佐米对肾移植术后LCDD复发的治疗效果有待验证(表1)。
二、新发肾小球肾炎(De novo GN)
1.新发膜性肾病(De novo MN):新发的膜性肾病通常在肾移植术后两年出现(1个月到10年之间)。临床表现为肾病范围的蛋白尿。De novo MN伴随体液性排斥反应,常伴随一定程度的血管排斥反应和CsA诱发的血管病变,新发膜性肾病伴随C4d染色阳性,DSA阳性以及肾小球内皮细胞伴随HLA的IgG沉积。由于肾移植后De novo GN的发病机制与肾移植后肝炎(丙肝和乙肝感染)有关。因此,即使没有发现明显的临床或实验室改变,也建议对HCV阳性受者进行肾活检。Ponticelli等[32]认为,De novo MN发病过程为肾脏损害导致内部免疫炎症的激活和隐藏抗原的暴露,树突状细胞成熟以及抗原向免疫活性细胞递呈从而产生特异性抗体,引起上皮下免疫复合物形成、补体激活、活性氧产生和炎症反应。光镜检查下,De novo MN与IMN无差别,一般无明显异常,少数上皮侧见嗜复红物,有时伴肾小球系膜增生,确诊依靠荧光染色和电镜检查。无法精确区分复发和新发膜性肾病,但磷脂酶A2受体(PLA2R)染色可用于确定新发和复发性膜性肾小球病变,PLA2R对复发性MN的敏感性为83%,特异性为92%[33],Wen等[34]发现dn MN足细胞HLA-DR表达阳性,而 IMN足细胞HLA-DR表达阴性,对于鉴别复发和新发的MN有一定的价值。对移植后新发性膜性肾病的一般治疗包括雷公藤多苷片、ACEI/ARB、血浆置换、抗CD20单克隆抗体和硼替佐米等,De novo MN 的发病机制可能与同种异体免疫反应相关,治疗上还需要进一步探索。
2.新发局灶节段性肾小球硬化(De novo FSGS):De novo FSGS复发的累积概率为6.7%,是新发肾小球肾炎的常见类型[35]。De novo FSGS一般发现较晚,通常在肾移植12个月后发现,临床表现为不同程度的蛋白尿、高血压和同种异体肾功能逐渐恶化[36]。新发FSGS的发病机制有:钙调神经磷酸酶抑制剂或其他因素引起的适应性血液动力学改变和组织纤维化,移植肾中肾单位丢失或肾单位较少引起的残余肾单位中的肾小球代偿性超滤,高血压,糖尿病,体液性排斥反应,BK病毒肾病或细小病毒B19感染、西罗莫司对足细胞损害等。De novo FSGS的治疗包括去除可能致病因素的持续作用以及降蛋白尿治疗。由CNI或mTOR抑制剂毒性引起的de novo FSGS病人可再次接受肾移植,但应尽量减少同类药物的剂量。如果FSGS与抗体介导的排斥相关,则复发的风险会增加,移植前应去除循环抗体[36]。
三、总结
继发性肾小球疾病导致的ESRD在肾移植术后仍有一定程度复发概率,影响移植肾近期和远期预后,掌握这类疾病的肾移植术前的评估、术后复发的临床特点、高危因素以及预后非常重要。肾移植术后新发的肾小球疾病尽管很少见,但其发生机制与复发的肾小球疾病不同,其准确的诊断和治疗对延长移植物存活有重要价值。

