利用杆状病毒实现外源基因在哺乳动物细胞内表达
邹桂莲,罗青平,邵华斌,温国元,杨 烨,商 雨
(1.湖北省农业科学院畜牧兽医研究所/农业农村部畜禽细菌病防治制剂创制重点实验室/畜禽病原微生物学湖北重点实验室,武汉 430064;2. 长江大学动物科学学院,湖北 荆州 434025)
杆状病毒是一类专职感染无脊椎动物的病毒,病毒呈杆状,具有囊膜。在其生活周期中共产生两种形态不一的病毒粒子,出芽型病毒粒子和包埋型病毒粒子,分别负责病毒的口服感染和系统感染两个环节[1]。杆状病毒的基因组为双链环状DNA,大小为80~180 kb,编码150 多个病毒蛋白。杆状病毒分为4 个病毒属:甲型、乙型、丙型和丁型[2]。
杆状病毒是目前应用最广泛的病毒之一。作为安全、高效的生物杀虫剂被广泛应用于农林业病虫害的防治[3,4];作为表达载体实现外源基因在真核细胞内大量表达[5,6];作为潜在的基因治疗载体将药物基因带入到靶标细胞内并实现表达[7,8]。早期,由于杆状病毒的基因组较大且不易操作,构建重组杆状病毒是将杆状病毒的基因组和外源基因片段一起转入到受体细胞内,通过同源重组的方法将外源基因替换到病毒基因组上,从而获得重组杆状病毒[9]。随后,为了提高重组杆状病毒的构建效率,将杆状病毒的基因组线性化后,再与外源基因片段一起转入受体细胞,很大程度提高重组效率。Luckow 等[10]将细菌的复制子插入到杆状病毒基因组里,构建成能在细菌里复制的杆状病毒基因组—— 杆粒(bacmid);且在细菌里还可以通过转座的方法将外源基因定点插入到bacmid 上,获得重组杆状病毒基因组。以该方法开发成的Bac-to-Bac 重组杆状病毒快速构建系统被迅速推广和应用,成千上万的蛋白被该系统表达。
杆状病毒作为表达系统有很多显著的优势:①基因组的容量大,可以携带较大的外源基因或多个外源基因[11];②在昆虫细胞内或昆虫体内表达蛋白,比原核表达系统有更好的翻译后修饰系统,表达的蛋白更接近天然结构[12];③杆状病毒部分基因的启动子属于强启动子,可以实现外源基因在细胞内大量表达;④系统操作简便,重组杆状病毒构建效率高。但是杆状病毒表达系统也存在一些不足之处:①杆状病毒的基因组较大,编码的病毒蛋白较多,对细胞的毒性较大;②杆状病毒的强启动子都属于晚期启动子,基因表达滞后,细胞内病毒蛋白的积累导致外源蛋白的正确折叠受到影响[13];③昆虫细胞的翻译后修饰,尤其是糖基化修饰,与哺乳动物等高等生物细胞有差异,不利于特殊蛋白(如糖蛋白)的表达[14]。
本研究旨在对杆状病毒进行改造,使之能在哺乳动物或其他高等生物细胞内表达外源基因,从而克服杆状病毒表达系统的不足之处,更大程度地提高表达蛋白的翻译后修饰。另外,也可以将杆状病毒作为转导载体,开发新型、高效的基因治疗药物。
1 材料与方法
1.1 材料
1.1.1 主要试剂 PCR 酶2×Phanta Max Master Mix(Dye PLus)和T4 DNA 连接酶购自Vazyme 公司;胶回收试剂盒和质粒提取试剂盒购自美国Omega 公司;限制性内切酶XhoI、EcoR I、Xba I 和Sph I 均购自TaKaRa 公司;无内毒素质粒提取试剂盒QIAGENPlasmid Mini Kits 购 自QIAGEN 公 司;Insect Cell Culture Medium(贴壁)购自NovaStar 公司;Aus-GeneX 澳洲特级胎牛血清购自北京智杰方远科技有限公司;Cellfectin 转染试剂购自Gibco 公司;硫酸庆大霉素(Gentamycin sulfate,Gen)、氨苄青霉素(Ampicillin,Amp)、卡那霉素(Kanamycin,Kan)、链霉素(Streptomycin,Str)、四环素(Tet)、IPTG 溶液和Xgal 溶液均购自Solarbio 公司。
1.1.2 病毒基因、载体和细胞 pcDNA3.1、pcDNAmCherry、pFastBac-Dual 质粒、pTS09-C-egfp 和Sf9昆虫细胞均由本实验室保存。哺乳动物DNA 从BHK-21 细胞中提取。DH5α 感受态购自大连TaKa-Ra 公司。含有杆状病毒基因组(AcBac-Δcc)和helper 质粒的BW25113 大肠杆菌菌株由本试验制备。
1.2 方法
1.2.1 CMV 启动子(PCMV)和EF1 启动子(PEF1)的克隆 根据PCMV序列和PEF1序列设计引物(表1),引物由生工生物工程(上海)股份有限公司合成。以pcDNA3.1 为模板,用引物对PCMV-F 和PCMV-R 扩增PCMV;以哺乳动物DNA 为模板,用引物对PEF1-F 和PEF1-R 扩增PEF1。通过1% 的琼脂糖凝胶电泳回收PCMV和PEF1扩增产物。PCMV和PEF1片段通过Overlapping PCR 融合形成PCMV-PEF1片段,通过1% 的琼脂糖凝胶电泳回收扩增产物。
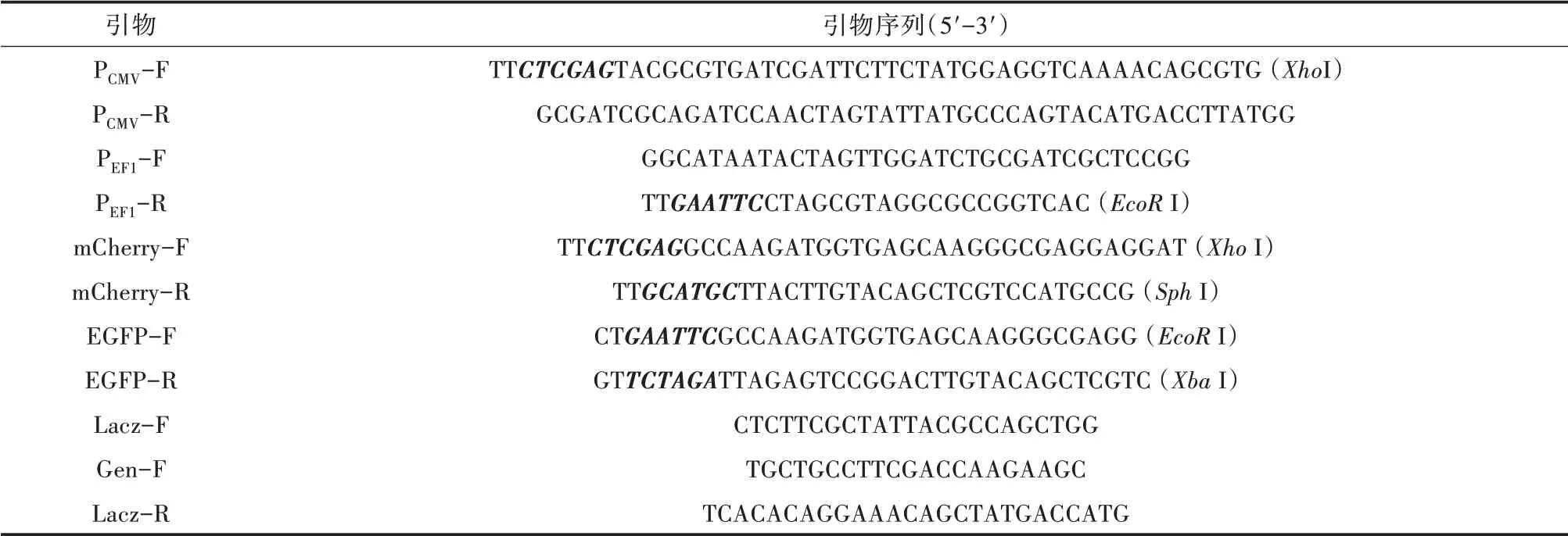
表1 试验所用引物
1.2.2 重组表达载体pFastBac-2EP 的构建 分别用XhoI 和EcoR I 双酶切PCMV-PEF1和pFastBac-Dual,经琼脂糖凝胶电泳后,切下目的条带,用凝胶回收试剂盒回收目的片段。10 μL T4 DNA 连接酶体系中,按摩尔比(3~10)∶1 加入回收后的目的片段和载体,在4 ℃连接过夜。取5 μL 连接产物转入100 μL DH5α 感受态细胞中,取100 μL 菌液涂布于含Amp(10 μg/mL)和Gen(10 μg/mL)的LB 营养琼脂固体培养基平板上,37 ℃培养过夜。挑取单菌落进行菌液培养,利用引物PCMV-F 和PEF1-R 对菌液进行PCR 检测,提取阳性菌液的质粒,命名为pFastBac-2EP,送生工生物工程(上海)股份有限公司测序。
1.2.3 质粒pFastBac-2EP-mCherry-egfp 的构建根据mCherry 和egfp 基因序列分析,设计引物对(EGFP-F、EGFP-R)和引物对(mCherry-F、mCherry-R)(表1),以pcDNA-mCherry 和PTS09-C-egfp为模板,扩增mCherry 和egfp 基因序列。通过酶切和连接的方法,先后将egfp 和mCherry 基因插入到pFastBac-2EP 质粒PEF1下游的EcoR I 和Xba I 限制性内切酶位点之间和PCMV下游的Xho I 和Sph I 限制性内切酶位点之间。构建质粒转化进入DH5α 感受态细胞,涂布平板,培养至长出单菌落后挑取单菌落进行菌液培养。经PCR 鉴定和酶切鉴定后,挑选构建正确的质粒进行测序分析,将测序正确的质粒命名为pFastBac-2EP-mCherry-egfp(图1)。
1.2.4 重组质粒pAc-2EP-mCherry-egfp 的构建取50 ng 质粒pFastBac-2EP-mCherry-egfp 转化进入大肠杆菌BW25113 株感受态细胞(含AcBac-Δcc bacmid 和helper 质粒),菌液涂布于LB 平板(含Kan 50 μg/mL;Tet 50 μg/mL;Gen 10 μg/mL;IPTG 48 μg/mL 和X-gal 80 μg/mL),37 ℃培养48 h。挑取白色单菌落进行菌液培养,通过PCR 鉴定外源基因是否插入到杆状病毒基因组上。使用引物对Gen-F 和LacZ-R 以及引物对LacZ-F 和PEF1-R 来进行检测(表1),其中引物LacZ-F 和LacZ-R 位于杆状病毒基因组转座位点两侧,引物Gen-F 和PEF1-R 位于pFastBac-2EP-mCherry-egfp 质粒上。检测阳性的重组杆状病毒基因组命名为pAc-2EPmCherry-egfp。用QIAGENPlasmid Mini Kits 试剂盒提取重组杆状病毒基因组。
1.2.5 重组病毒rAc-2EP-mCherry-egfp 的拯救六孔板中Sf9 细胞生长至70%~80% 时,根据Cellfectin 转染试剂说明书,将5 μg pAc-2EP-mCherryegfp 重组杆状病毒基因组DNA 转染到Sf9 细胞,置于27 ℃培养箱孵育4~5 d,每天观察细胞病变。收取培养上清,5 000 r/min 离心5 min,去除细胞碎片。收获的细胞培养上清液继续感染Sf9 细胞,获得高滴度的重组杆状病毒命名为rAc-2EP-mCherryegfp。
1.2.6 重组杆状病毒感染Sf9 细胞和转导BHK-21细胞 六孔板中每孔铺入106Sf9 细胞。待细胞贴壁后,重组杆状病毒rAc-2EP-mCherry-egfp 以1 MOI的感染剂量感染Sf9 细胞。27 ℃培养箱培养4 d,每天观察细胞内红色荧光和绿色荧光的产生情况。
六孔板中每孔铺入2×105BHK-21 细胞。待细胞贴壁后,重组杆状病毒rAc-2EP-mCherry-egfp 以10 MOI 的感染剂量感染BHK-21 细胞。37 ℃培养箱培养5 d,每天观察细胞内红色荧光和绿色荧光的产生情况。

图1 Donor 质粒构建流程
2 结果与分析
2.1 donor质粒pFastBac-2EP 的构建
根据所设计的引物,扩增出来的片段PCMV和PEF1大小分别位于250~500 bp 和500~750 bp,与片段预期的大小(分别为375 和574 bp)相符。再通过Overlapping PCR 将PCMV和PEF1融合在一起获得大小为750~1 000 bp 的片段PCMV-PEF1(图2A),大小与预期大小(946 bp)相符。将PCMV-PEF1插入到pFast-Bac-Dual 质粒的XhoI 和EcoR I 酶切位点后,获得改造的donor 质粒pFastBac-2EP,质粒PCR 鉴定和酶切鉴定结果(图2B 和图2C)均表明质粒构建正确。进一步将质粒交由生工生物工程(上海)股份有限公司进行测序,结果表明插入片段没有发生点突变。因此该donor 质粒可用于下游试验。
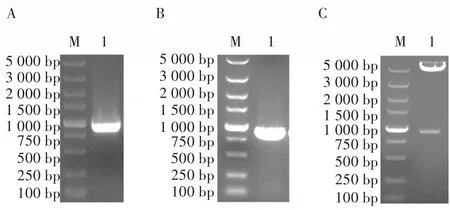
图2 启动子扩增结果和pFastBac-2EP 构建的鉴定结果
2.2 质粒pFastBac-2EP-mCherry-egfp 的构建
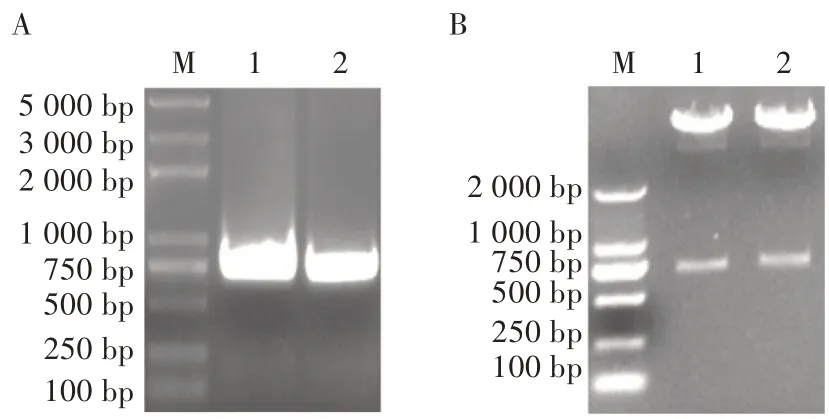
图3 质粒pFastBac-2EP-mCherry-egfp 构建过程中的电泳
根据所设计引物扩增mCherry 和egfp 基因,经琼脂糖凝胶电泳得到711 和729 bp 的两条条带(图3A),条带大小与预期相符。将目的片段mCherry 和egfp 片段通过酶切连接的方法分别插入PCMV和PEF1下游,构建重组质粒。用限制性内切酶Xho I 和Sph I 以及EcoR I 和Xba I 分别对重组质粒进行酶切,酶切产物经琼脂糖凝胶电泳分析,表明酶切样品均能产生2 条条带(图3B),大小与预期结果相符合。将鉴定正确的质粒交由生工生物工程(上海)股份有限公司进行测序,结果显示插入序列没有发生突变,表明pFastBac-2EP-mCherry-egfp 构建成功。
2.3 重组质粒pAc-2EP-mCherry-egfp 的构建
将pAc-2EP-mCherry-egfp 质粒转化进入大肠杆菌BW25113 株感受态细胞(含AcBac-Δcc bacmid 和helper 质粒)中,经Blue-Gal 蓝白斑筛选,挑取白色单菌落进行菌液培养。 用引物Gen-F 和LacZ-R 以及LacZ-F 和PEF1-R 两组引物进行菌液PCR 鉴定,两组引物扩增的片段大小分别为750 和1 200 bp 左右(图4),扩增结果与预期结果一致,表明重组杆状病毒基因组构建正确。
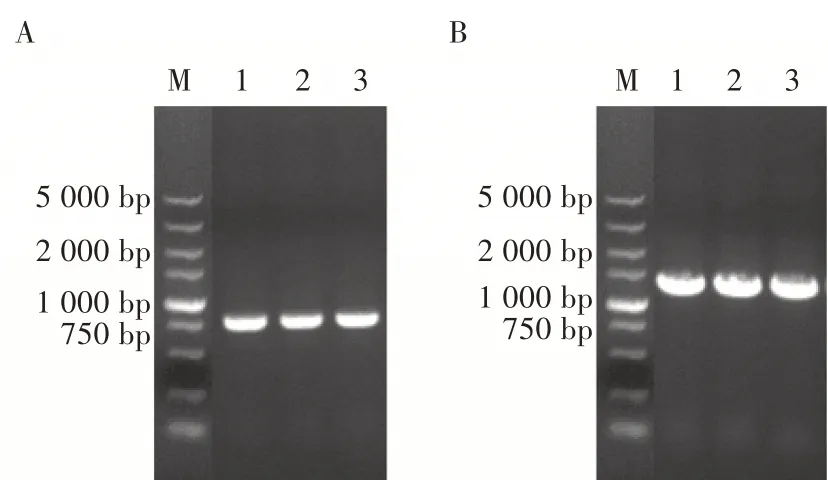
图4 重组杆状病毒基因组鉴定结果
2.4 重组病毒的拯救
将重组杆状病毒基因组pAc-2EP-mCherryegfp 转染Sf9 细胞。72 h 后观察到细胞开始出现病变,主要表现为细胞肿胀以及细胞核膨胀,96 h 后大部分细胞出现病变,120 h 后收集细胞培养上清。将收集的细胞培养上清液感染Sf9 细胞,每天观察细胞的病变。结果表明,感染后48 h 细胞开始出现病变,96 h 后大部分细胞出现典型的杆状病毒病变(图5)。收集病毒进行病毒滴度测定,病毒滴度达到1.8×108TCID50/mL。

图5 重组杆状病毒感染Sf9 细胞的病变观察
2.5 重组杆状病毒感染Sf9 细胞和BHK-21 细胞
用1 MOI 重组病毒rAc-2EP-mCherry-egfp 感染Sf9 细胞,观察荧光变化情况。病毒在感染24 h后出现红色荧光和绿色荧光,但荧光较暗,随后荧光慢慢增强;96 h 后,红色荧光和绿色荧光强度非常高(图6A 和图6B)。用10 MOI 重组病毒rAc-2EPmCherry-egfp 转导BHK-21 细胞,观察发现,48 h 开始出现微弱的绿色和红色荧光,随后荧光逐渐增强;120 h 后,荧光强度也增强的非常高(图6C 和图6D),表明杆状病毒可以进入BHK-21 细胞,且PCMV和PEF1可作为杆状病毒表达载体的启动子在Sf9 细胞和BHK-21 细胞中持续表达蛋白。
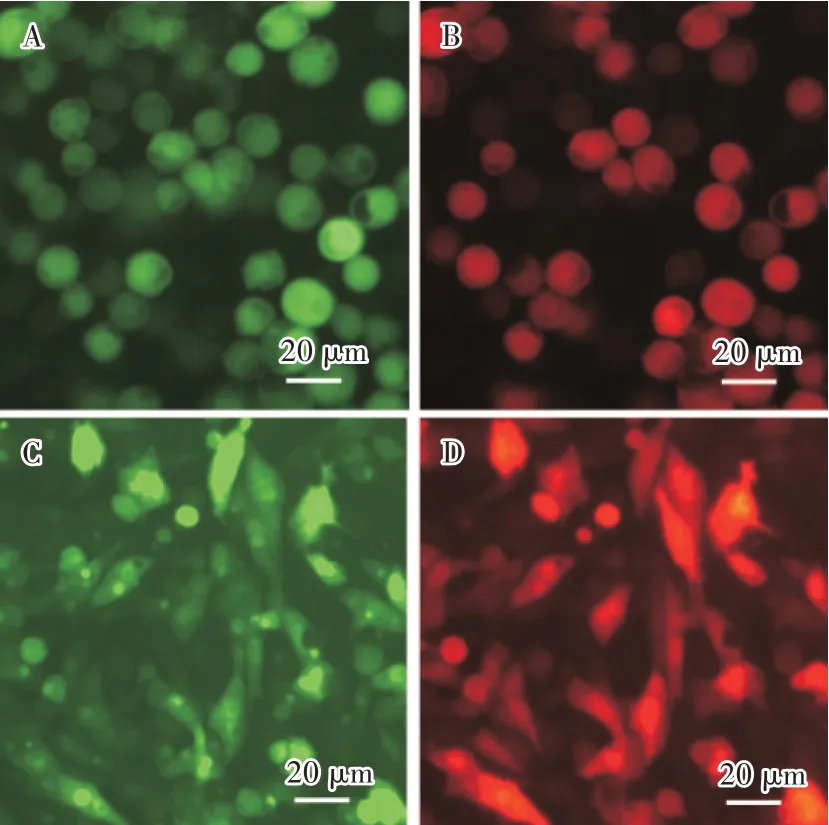
图6 rAc-2EP-mCherry-egfp 感染Sf9 细胞和BHK-21 细胞的荧光
3 小结与讨论
杆状病毒作为一种安全、高效的表达载体,应用越来越广泛,但是由于杆状病毒感染宿主细胞会大量合成病毒蛋白和组装杆状病毒,导致细胞快速凋亡,以及糖基化修饰方式与其他的高等生物细胞不一致,极大影响了蛋白表达产量、结构和功能,提高了纯化难度[15]。为了解决这些问题,研究者们也采取了系列措施,如精简杆状病毒基因组[16]、携带抑制细胞凋亡的基因[17]和引入其他高等生物细胞的糖基化修饰系统[18],对改良杆状病毒的应用起到一定作用。本研究旨在构建一个能在哺乳动物细胞内高效表达外源蛋白的重组杆状病毒,可以禁止杆状病毒蛋白在细胞内的表达,不会引起细胞病变的产生,还可以利用哺乳动物细胞的蛋白翻译后修饰系统。
因为杆状病毒具有强大的膜融合蛋白(GP64),能介导杆状病毒与多物种的细胞发生膜融合,将杆状病毒的核衣壳转导进入细胞内,但转导效率在不同细胞上的差异较大[19]。杆状病毒的启动子一般不会被其他物种细胞的转录系统识别,因此首先替换了杆状病毒表达系统中表达外源基因的启动子,将表达载体中的p10 和PH 启动子替换成CMV 和EF1 基因的启动子。这两种启动子均被广泛应用于各种真核表达载体的构建。为了验证改造后的启动子能否发挥作用,分别将红色荧光蛋白mCherry 基因和绿色荧光蛋白egfp 基因插入到CMV 和EF1 启动子下游,然后经过转座构建重组杆状病毒基因组,再经转染试验,获得重组杆状病毒。重组杆状病毒在感染Sf9 昆虫细胞时,可以产生红色和绿色荧光,表明CMV 和EF1 启动子可以在昆虫细胞内工作;当重组杆状病毒孵育BHK-21 细胞时,细胞在48 h后才开始产生荧光,随后荧光强度才逐渐变强,杆状病毒可以将外源基因转导进入BHK-21 细胞,且CMV 和EF1 启动子可以在BHK-21 细胞内持续工作。后期将在此基础上,对哺乳动物细胞系和家禽细胞系进行筛选,选择适合的转导细胞系;另外还将从提高转导效率和入核效率等方面对杆状病毒载体进行优化,进一步提高杆状病毒载体的应用性能。

