外排泵抑制剂CCCP对不同耐药机制介导的沙门菌黏菌素耐药性的逆转作用
崔小蝶,易开放,杨影影,贺丹丹,吴 华,苑 丽,胡功政
(河南农业大学 动物医学院,河南 郑州 450046)
沙门菌是一种人畜共患病原菌,给我国养殖业造成了巨大威胁。黏菌素(Colistin,COL)是治疗动物革兰氏阴性杆菌感染包括沙门菌病的常用有效药物。但随着其广泛使用,沙门菌对其耐药性也日益严重,给临床治疗带来了巨大的挑战。目前,已阐明的细菌对黏菌素耐药的机制主要有2种[1-2]:一是染色体介导的2个双组分信号转导系统(TCS)PhoPQ和PmrAB(包括2个调控元件MgrB和PmrD)。PmrAB和PhoPQ中的基因发生突变,可使其下游的pmrC、pmrH等脂多糖(LPS)修饰相关基因的表达量上升,进而使细菌的类脂A发生4-氨基-4-脱氧-L-阿拉伯糖(Ara4N)或磷酸乙醇胺(pENT)修饰,使细菌表面的负电荷减少,降低了细菌对阳离子多肽黏菌素的吸附而产生耐药[3]。mgrB基因的缺失、变异、插入或截断失活,可引起PhoPQ系统的上调,进而导致下游pmrHFIJKLM基因表达的上调,最后导致对黏菌素耐药[4-5]。二是质粒介导的黏菌素耐药基因mcr。2015年,我国首次在动物源大肠埃希菌中发现了质粒介导的黏菌素耐药基因mcr-1[6]。随后,7个新的质粒介导的黏菌素耐药基因mcr2—mcr8也陆续在中国或欧洲国家被发现[7]。
细菌外排泵对药物的外排作用是细菌对多种抗生素耐药的重要机制之一。许多外排泵可以降低细菌对抗菌药物的敏感性,如MexXY-OprM和AcrAB-TolC[8-9]。外排泵抑制剂(Efflux pump inhibitors,EPIs)可通过不同的机制失活或抑制AcrAB-TolC等外排泵的功能。已发现的EPIs有多种,氰氯苯腙(CCCP)是一种抑制质子转运的解偶联剂,可以阻断主动外排系统能量来源,使药物在细菌体内的蓄积量增加,恢复细菌对药物的敏感性[10]。已证明CCCP对氟喹诺酮类、四环素类等抗菌药物的抗菌作用有增强作用[11]。近年的研究表明,CCCP能逆转肺炎克雷伯菌、大肠杆菌等对黏菌素的耐药性[12-14],但对动物源沙门菌黏菌素耐药性的影响尚未见报道。为此,观察CCCP对不同耐药机制的沙门菌分离菌株黏菌素耐药性的逆转作用,为寻找控制耐黏菌素沙门菌感染的联合用药措施提供理论依据。
1 材料和方法
1.1 材料
1.1.1 菌株 供试菌株:2018—2019年从河南省部分养殖场的疑似沙门菌病的病死鸡肝脏样品分离到58株沙门菌,从中随机选择8株黏菌素耐药沙门菌为受试菌株。全基因组测序对照菌鼠伤寒沙门菌标准株(CVCC®541)购自中国兽药监察所;质控菌株为大肠埃希菌ATCC®25922,购自中国普通微生物菌种保存中心。
1.1.2 主要试剂和药品 主要培养基LB肉汤、LB琼脂、SS琼脂、MHB肉汤培养基等均购于青岛海博生物技术有限公司。琼脂糖(Takara公司,Japan)、2×EsTaqMasterMix(北京康为世纪生物技术有限公司)、50×TAE(北京索莱宝生物科技有限公司)、荧光染料溴化乙锭(上海生工生物技术服务有限公司)。细菌基因组DNA提取试剂盒(DP302)购于天根生化科技(北京)有限公司。CCCP(含量≥97%)购于美国Sigma公司。黏菌素(效价23 988 u/mg)购于河北圣雪大成唐山制药有限责任公司。
1.2 试验方法
1.2.1 供试菌株分离 将221份病料分别均匀涂布于SS培养基上,37 ℃培养16~18 h,挑取单个菌落接种于LB肉汤,放于水浴恒温振荡器12 h,再次接种于SS培养基,如此反复直至SS培养基上均为纯黑色的单个菌落。挑取单个的黑色菌落接种于5 mL的LB肉汤中,放置于37 ℃摇床中180 r/min振荡培养,16~18 h后取出备用。
1.2.2 供试菌株鉴定 将分离到的菌株采用裂解法提取基因组DNA。参考文献[15-16]的引物及反应条件,分别进行沙门氏菌侵袭基因invA和16S rRNA的PCR扩增鉴定。取PCR反应产物1%琼脂糖凝胶电泳,溴化乙锭染色,凝胶系统下观察结果。PCR产物送上海生工生物技术服务有限公司进行测序分析。PCR阳性菌株同时进行基质辅助激光解吸电离飞行时间质谱(MALDI-TOF/MS)鉴定。引物由上海生工生物技术服务有限公司合成。
1.2.3 供试药液的配制及保存 用分析天平称取黏菌素,用漩涡振荡仪进行振荡混匀制备质量浓度为5 120 mg/L抗菌药物原液。用二甲基亚砜(DMSO)制备5 000 mg/L质量浓度的CCCP原液。采用0.22 μm的滤膜进行过滤除菌,储存于4 ℃以备后续使用。
1.2.4 CCCP对沙门菌黏菌素耐药性的逆转作用 用微量肉汤稀释法[17]测定黏菌素及其添加外排泵抑制剂CCCP(终质量浓度为5 mg/L)对随机选择的8株黏菌素耐药沙门分离株的最小抑菌浓度(MIC)。以MHB肉汤、MHB肉汤+菌株、MHB肉汤+菌株+5 mg/LCCCP为对照。质控菌株为大肠埃希菌ATCC25922。重复操作3次,药敏结果判断依据CLSI标准[17]:黏菌素MIC≥4 mg/L为耐药,黏菌素MIC 2~4 mg/L为中介,黏菌素MIC<2 mg/L为敏感。
1.2.5 黏菌素的耐药机制
1.2.5.1 质粒介导的黏菌素耐药基因mcr的检测 以随机选择的8株黏菌素耐药沙门菌基因组DNA为模板,参考文献[7,18]的引物及反应条件进行PCR反应和测序分析,检测质粒介导的黏菌素耐药基因mcr1—mcr8。同时进行8株沙门菌的全基因组测序:用基因组DNA提取试剂盒提取8株细菌的基因组DNA,操作步骤按照天根生化科技(北京)有限公司的提取试剂盒说明书方法进行。提取的基因组DNA送安诺优达基因科技(北京)有限公司进行测序,采用二代测序平台Illumina Hiseq X Ten进行全基因组测序分析。使用FastQC进行测序质控,SPAdes进行序列的拼接组装,RAST(http://rast.nmpdr.org)进行基因预测及功能注释。对上述2种测序结果中的mcr序列与NCBI数据库中的mcr序列进行比对与分析。
1.2.5.2 染色体介导的耐药机制分析 据上述测序结果,基于基因组学序列分析的方法,先将NCBI数据库中收录的鼠伤寒沙门菌标准株(CVCC®541)完整测序序列下载,并构建本地数据库。再将双组份信号转导系统PhoPQ和PmrAB相关基因序列作为咨询序列,与上述构建好的本地数据库进行比对分析。同时参照NCBI数据库中已提交的基因序列合成引物,PCR扩增phoP、phoQ、pmrA、pmrB、mgrB、pmrD和pmrC全基因序列,引物序列见表1。PCR产物送上海生工生物技术服务有限公司进行测序分析。

表1 PhoPQ和PmrAB双组份相关基因的引物序列
2 结果与分析
2.1 菌株的分离与鉴定
221份病死鸡肝脏样品中有58份在SS培养基上长出半透明或不透明以及黑色的圆形菌落;58份样品的侵袭基因invA(图1)和16S rRNA中,有32份可以扩增出与阳性对照片段大小一样的特异性条带。PCR产物测序结果利用DNA Star软件与NCBI数据库中的序列进行比对,确定为沙门菌invA和16S rRNA基因序列。MALDI-TOF-MS鉴定结果经软件分析后,与数据库中的沙门菌同源性达到98%以上。由以上结果可以判断,58份疑似样品分离的菌株中有32株为沙门菌。
M:DNA Marker 2 000;1—8:菌株样品;9:阳性对照;10:阴性对照
2.2 CCCP对分离沙门菌菌株黏菌素耐药性的逆转作用
药敏结果表明,32株沙门菌中共有19株对黏菌素耐药,随机挑选8株耐药菌进一步观察了CCCP与黏菌素联用的MIC(表2)。8株沙门分离株的编号为SH01—08。从表2可以看出,黏菌素对质控菌 ATCC®25922的MIC在CLSI规定的范围内。加入外排泵抑制剂CCCP后,9株细菌对黏菌素的敏感性明显增强,CCCP增强了黏菌素的抗菌活性,降低了黏菌素对不同耐药机制菌株(mcr-1阳性、PhoPQ和PmrAB相关基因的突变)的MIC。4株mcr-1阳性菌株的MIC平均降低了1/832,4株mcr-1阴性菌株的MIC平均降低了1/1 920。CCCP能逆转所有菌株对黏菌素的耐药性,黏菌素耐药率由100%降低到了0。对照试验表明,CCCP在5 mg/L质量浓度下对细菌没有抑制作用。
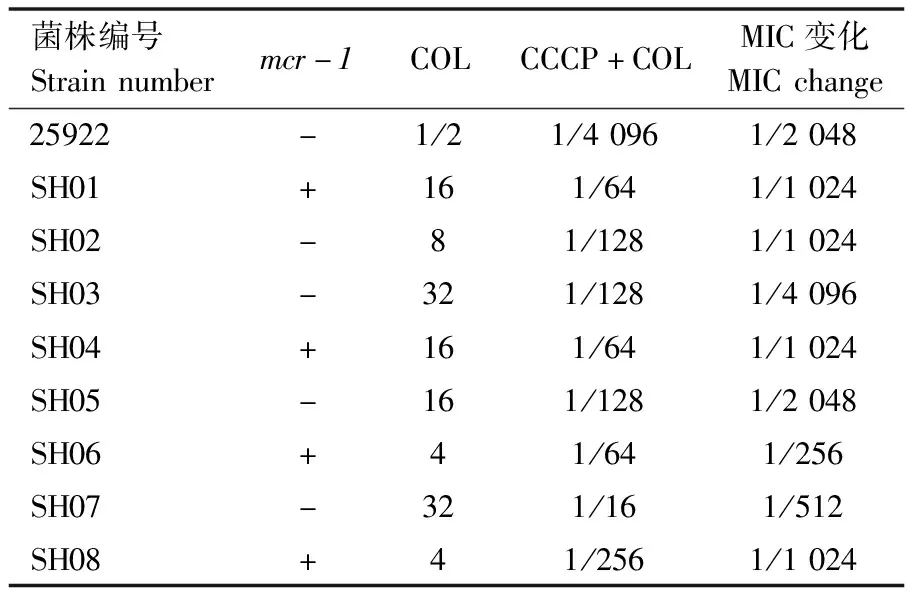
表2 分离沙门菌菌株加入CCCP前后的黏菌素MIC
2.3 黏菌素的耐药机制
在8株随机选择的黏菌素耐药沙门菌中,如图2所示,有4株沙门菌可见与mcr-1阳性对照一致的309 bp的扩增片段,未扩增到其他亚型的黏菌素耐药基因mcr2—mcr8。全基因组二代测序检测mcr1—mcr8结果与PCR扩增结果一致。对测序结果序列进行比对和分析,结果显示,所检测的mcr-1序列与NCBI数据库中的沙门菌mcr-1序列(GenBank:MN873698)同源性达到99%以上,确定为mcr-1阳性菌株。
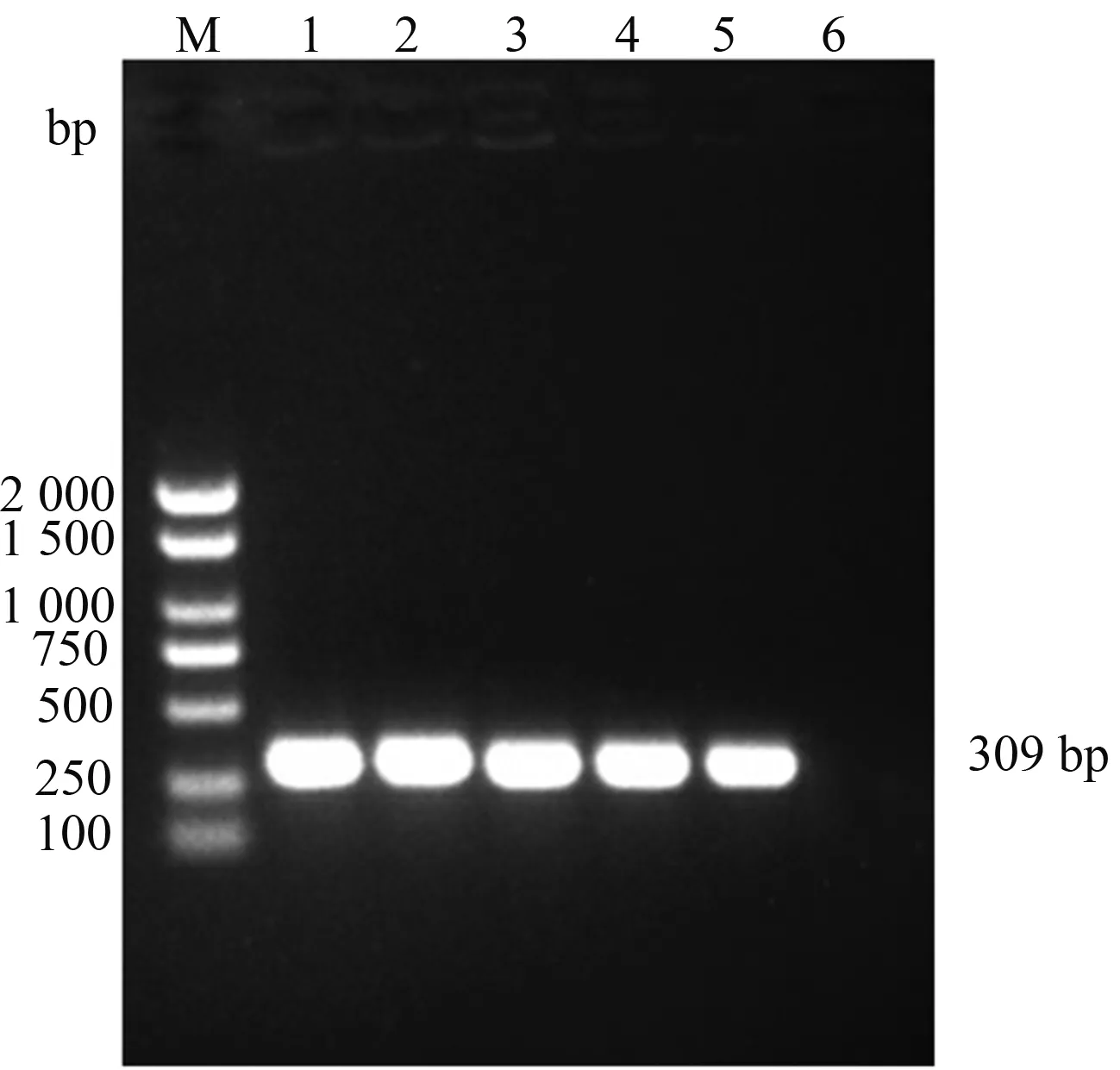
M:DNA Marker 2 000;1—4:菌株样品;5:阳性对照;6:阴性对照
8株沙门菌全基因组二代测序检测mcr-1与双组份信号转导系统PhoPQ和PmrAB相关基因编码的氨基酸突变见表3。mcr-1阳性菌株SH04,同时存在mgrB基因编码的氨基酸Y31D突变。与鼠伤寒沙门菌标准株(CVCC®541)比较,4株mcr-1阴性菌株中,菌株SH02的pmrB蛋白有2处氨基酸突变,分别是R248P和E292K;mgrB蛋白提前1个色氨酸(W)终止翻译。菌株SH03的pmrC蛋白有4处氨基酸突变:L77P、A159V、G232S、E415Q。菌株SH05的mgrB蛋白提前1个色氨酸(W)终止翻译;同时pmrC蛋白的突变与菌株SH02相同。菌株SH07的mgrB蛋白有2处氨基酸突变:F44L、I58F。未发现phoP、phoQ、pmrA和pmrD中的氨基酸变异。PCR测序结果与全基因组二代测序结果一致。

表3 分离菌株全基因组测序中部分耐药基因编码的氨基酸突变结果
3 结论与讨论
本研究表明,黏菌素对8株耐黏菌素的沙门菌分离菌株的MIC介于4~32 mg/L,黏菌素联合CCCP后,与单药相比MIC明显下降(下降了1/4 096~1/256)。CCCP增强了耐药菌对黏菌素的敏感性,逆转了所有沙门菌的黏菌素耐药性。黏菌素的耐药机制结果显示,8株耐黏菌素分离菌有4株为mcr-1阳性,其中,菌株SH04同时存在双组份信号转导系统PhoPQ和PmrAB相关基因突变(mgrB变异);其余4株均为PhoPQ和PmrAB相关基因突变菌株。药敏试验结果表明,CCCP对不同耐药机制的沙门菌的黏菌素MIC的影响并无差异,对8株沙门菌黏菌素耐药性均有逆转作用。CCCP作为外排泵抑制剂时的质量浓度一般在10~20 mg/L[11-13],而本研究中10~20 mg/L的CCCP质量浓度对于沙门菌有抑制作用,故本试验选用质量浓度为5 mg/L,发现该质量浓度下CCCP本身对沙门菌没有抑制作用。可见,CCCP对黏菌素抗菌增强作用并不是由于其本身的抗菌活性,而是由于其抑制外排泵而发挥逆转耐药性的作用。
细菌的主动外排系统是细菌产生多重耐药的重要机制。外排泵系统已经被报道在黏菌素耐药中能够发挥作用,如大肠杆菌中的AcrAB-TolC[19]和铜绿假单胞菌中的MexXY-OprM[8]。EPIs已经用于评估外排泵系统的上调对黏菌素抗性的作用。EPI对粘菌素抗性的影响因EPI类型而异。PABN和1-(1-萘甲基)-哌嗪(NMP)是被认为与AcrB作用位点中的药物竞争起作用的EPI[20],但是未能恢复对黏菌素耐药的革兰氏阴性菌的黏菌素敏感性[14,21]。然而,非特异性的EPIs CCCP和2,4-二硝基苯酚(DNP)在恢复黏菌素敏感性方面表现出良好的活性[14,21]。有研究表明,外排泵抑制剂CCCP能显著降低黏菌素对多种革兰氏阴性菌的MIC[13]。由于CCCP作用于外排泵的能量源-质子动力,并能调节膜内其他蛋白质的活性,因此很难确定CCCP发挥降低黏菌素抗性的机制。黏菌素是通过破坏阴性菌带负电荷的外膜而降低细胞膜稳定性,使细胞内重要物质外流产生杀菌作用[22]。因此,CCCP增强黏菌素抗菌活性并不是通过常规的降低细胞内药物外排、增加细胞内浓度达到的,而是通过其他间接的机制来增加细菌对黏菌素敏感性。NI等[14]报道,CCCP对黏菌素活性的影响可能是由于细胞膜上负电荷的再生引起。PARK等[21]发现,CCCP引起的ATP生成减少可能是这些细胞中黏菌素活性增加的原因。为了更好地解释这一机制的复杂作用原理,需要进一步研究外排泵抑制黏菌素抗性的机制,特别是通过描述外排泵基因及其在不同耐药机制的耐药菌株中的表达。
本研究结果表明,CCCP对不同耐药机制的耐黏菌素沙门菌的黏菌素MIC的影响并无差异,说明CCCP是一种增强黏菌素活性的广谱增效剂。将抗生素与增强其活性的增效剂结合,是解决抗生素耐药和耐药菌感染的重要策略。合理联合用药对于增强疗效、扩大抗菌谱、减少用量、降低或避免不良反应、减少或延缓耐药菌株的产生都具有重要意义。本研究发现,CCCP能广谱逆转分离菌黏菌素的耐药性,但CCCP由于安全性问题,尚不能临床应用。由于抑制外排泵能有效逆转黏菌素耐药性,故选用外排泵抑制剂与黏菌素联合,是增强后者抗菌活性的有效措施,寻找新的有效且更安全的外排泵抑制剂,对克服黏菌素的耐药性以及研制复方制剂、开发新型抗菌剂具有重要意义。

