桃酒酵母选育及发酵特性研究
赵娟娟,吴荣荣,王 岩,苑园园,胡朋飞
桃酒酵母选育及发酵特性研究
赵娟娟,吴荣荣,王 岩,苑园园,胡朋飞
(衡水学院 生命科学学院,河北 衡水 053000)
从油桃和早九宝中各获得一株酵母菌株,编号分别为Y-1和Z-1。通过对细胞形态、生理生化特性研究,对两株菌株进行鉴定,并测定其发酵特性。结果表明:菌株Y-1和Z-1均为酵母属的酿酒酵母。Y-1和Z-1的最适生长温度分别为25℃和30℃;最适生长pH分别为5.5和5.0;最适发酵温度分别为26℃和28℃;CO2失重分别是8.8 g和8.1 g;菌株Z-1的酒精耐受性高于菌株Y-1;菌株Z-1的耐糖性高于菌株Y-1。综上,菌株Z-1更适合桃酒的生产。
酵母;分离鉴定;发酵特性;桃酒
我国是产桃大国,但鲜桃不易储存和长时间的运输,因此利用桃发展果酒业有着很好的前景。桃肉含蛋白质、膳食纤维、有机酸(主要是苹果酸和柠檬酸)、碳水化合物(主要是葡萄糖、果糖、蔗糖、木糖)以及钙、磷、铁、胡萝卜素、维生素B1等。营养丰富的桃可以作为原料酿造成饮料酒[1]。
目前桃酒酿造的适用酵母较少,在生产过程中多数是以葡萄酒酵母替代。但桃汁和葡萄汁的成分差异很大,所以采用葡萄酒的酵母生产出桃酒口味不佳,不能突显桃特有的香气[2]。本研究选育适合桃酿造的优秀菌株,不仅提高了桃酒的品质,增加桃的价值,也进一步开发利用了丰富的微生物资源[3-7]。
成品桃酒含有多种营养成分,酒精体积分数低,温和爽口,清香甘醇。开展桃酒产业,不但可以满足人们的消费需求,还可以提高桃产区人民的收入,创造更多的附加值。
1 材料与方法
1.1 实验材料
油桃、早九宝的外表皮与鲜果肉(衡水市吉美超市出售)。
1.2 培养基
麦芽粉培养基、同化碳源基础培养基、同化氮源基础培养基。生化鉴定糖类(均为分析纯)。
1.3 仪器与设备
超净工作台、生化恒温培养箱、紫外分光光度计、旋转黏度计、pH计、高压蒸汽灭菌锅、移液枪等。
1.4 实验方法
1.4.1 酵母菌增殖培养
按1∶9比例将25 g样品添加到桃汁中,25℃下培养2 d。培养液备用。
1.4.2 酵母菌的分离
用无菌生理盐水将酵母菌的培养液配制成10-5和10-6的菌悬液,取0.2 mL均匀涂布在麦芽粉固体培养基上,在25℃下倒置培养48 h。选典型特征的单菌落划线分离,镜检确定其为纯培养物后,转移到麦芽粉固体斜面上低温保存[8]。
1.4.3 酵母菌的鉴定
酵母菌鉴定按照《The Yeast: a taxonomic study》(第三版)(Kreger-Van,1984)的方法进行[9]。
1.4.3.1 细胞形态
将两株酵母菌接种到麦芽粉固体培养基上,28℃培养2 d后镜检,观察。
1.4.3.2 菌株同化氮源测定
将两株酵母菌接种到加入不同氮源的培养基中,测定其同化氮源能力。
1.4.3.3 菌株同化碳源测定
将两株酵母菌接种到加入不同碳源的培养基中,测定其同化碳源能力。
1.4.3.4 菌株发酵糖类测定
将两株酵母菌接种到含不同糖类的培养基中,测定其对糖的发酵能力。
1.4.4 酵母生理特性测定
1.4.4.1 最适生长温度的确定
将3%的酵母液接种到培养基中,不同温度下培养12 h,在560 nm测定OD值,确定最适生长温度[10]。
1.4.4.2 最适生长pH的确定
将3%的酵母液接种到不同pH值的麦芽粉液体培养基中12 h,测定OD值,确定最适生长pH。
1.4.4.3 最适发酵温度确定
将3%的酵母液接种到杀菌后桃汁中,不同温度培养72 h,测CO2的失重,确定最适发酵温度。
1.4.4.4 耐酒精特性检测
3%的酵母液接种到培养基中,12 h后加入无水乙醇使最终酒精体积分数分别为5%、8%、11%、14%和17%,继续培养12 h测定OD值,测定酵母耐酒精能力。
1.4.4.5 耐糖特性测定
将待测酵母按3%接种量接入不同含糖量的麦芽粉液体培养基中培养24 h,测定OD值,分析比较待测酵母耐糖能力。
2 结果与讨论
2.1 酵母菌的分离、鉴定
2.1.1 酵母菌形态特征
酵母菌Y-1,Z-1的菌体形态特征分别如图1和图2所示。
图1 Y-1 菌体形态

图2 Z-1 菌体形态
从图1及图2上可以看出,酵母菌株Y-1呈卵形,且外表光滑,周边整齐;菌株Z-1呈椭圆形,且外表光滑,周边整齐,其大小略小于Y-1菌株,且Y-1菌株菌落颜色较明亮,比较容易辨别。
2.1.2 酵母菌代谢特性结果
2.1.2.1 菌株同化氮源能力
酵母菌Y-1和Z-1氮源同化能力结果见表1。

表1 酵母菌的氮源同化能力
注:“+”表示同化,反应阳性;“-”表示不同化,反应阴性。
2.1.2.2 菌株同化碳源能力
酵母菌Y-1和Z-1氮源同化能力结果见表2。
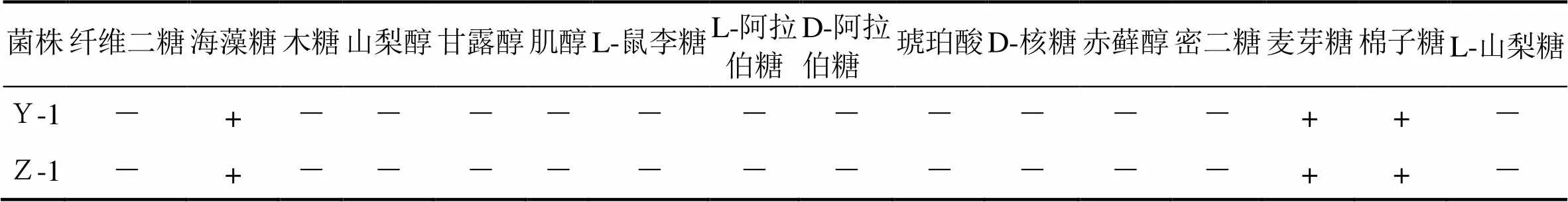
表2 酵母的碳源同化能力
注:“+”的代表同化反应为阳性;“-”的代表同化反应为阴性。
2.1.2.3 菌株糖发酵能力
酵母菌Y-1和Z-1糖发酵能力结果见表3。
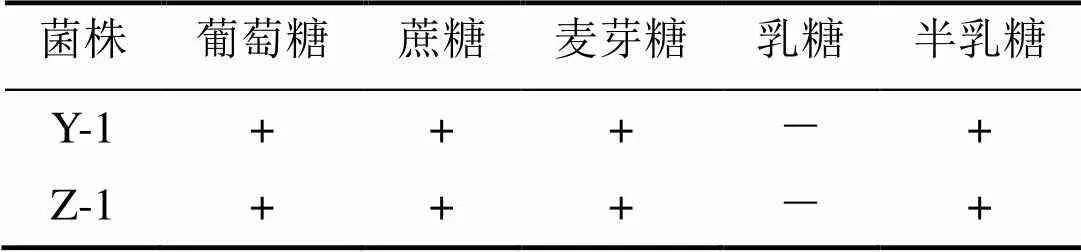
表3 酵母的糖发酵能力
注:“+”的代表发酵;“-”的代表不发酵。
从表1到表3中的结果可以看出,酵母菌Y-1和Z-1菌株可发酵葡萄糖、蔗糖、麦芽糖、半乳糖。在碳源方面,这两株菌均可同化葡萄糖、蔗糖、麦芽糖、海藻糖、半乳糖、棉籽糖。在氮源方面,这些菌株可同化硫酸铵,但不同化硝酸钾、盐酸尸胺、盐酸乙胺。根据上述结果和酵母属种的分类性状,将上述所筛选的两株酵母菌初步确定为酵母属的酿酒酵母。
2.2 酵母生理特性研究
2.2.1 最适生长温度的确定
测定不同温度(15℃、20℃、25℃、30℃和35℃)下OD值,结果见图3。
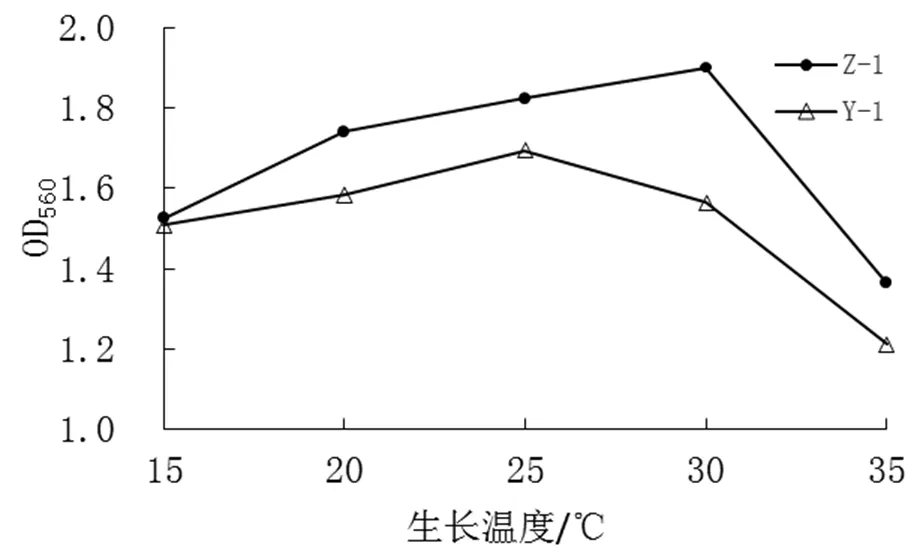
图3 不同生长温度对OD值的影响
从图3可知,酵母菌Z-1和Y-1受温度变化的影响较明显。在30℃时,菌株Z-1的OD值为1.901,生长速度最高;在25℃时,菌株Y-1OD值为1.695,生长速度最高。温度上升到35℃时,两酵母菌Z-1和Y-1的生长速度均有所下降,其OD值分别下降到1.364和1.211。较高的培养温度会抑制酵母菌的生长。菌株Y-1和Z-1分别在25℃和30℃长势最好。
2.2.2 最适生长pH的测定
测定不同pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)下OD值,结果见图4。
由图4中可看出,pH水平会影响酵母菌Z-1和Y-1的生长。菌株Z-1和Y-1的最适pH值分别为5.0和5.5。当pH升高时,两株酵母的生长都受到抑制,OD值分别降低至1.8和1.5左右;当pH降低至3.5时,两株酵母生长同样被抑制。
2.2.3 最适发酵温度确定
测定不同发酵温度(24℃、26℃、28℃、30℃、32℃)下CO2失重,结果见图5。
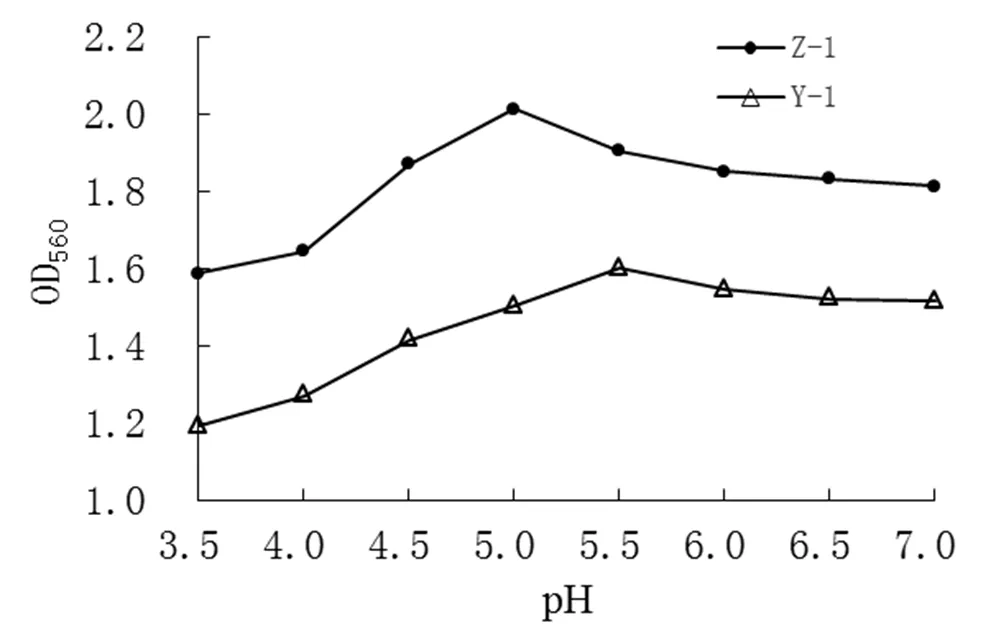
图4 不同pH对OD值的影响
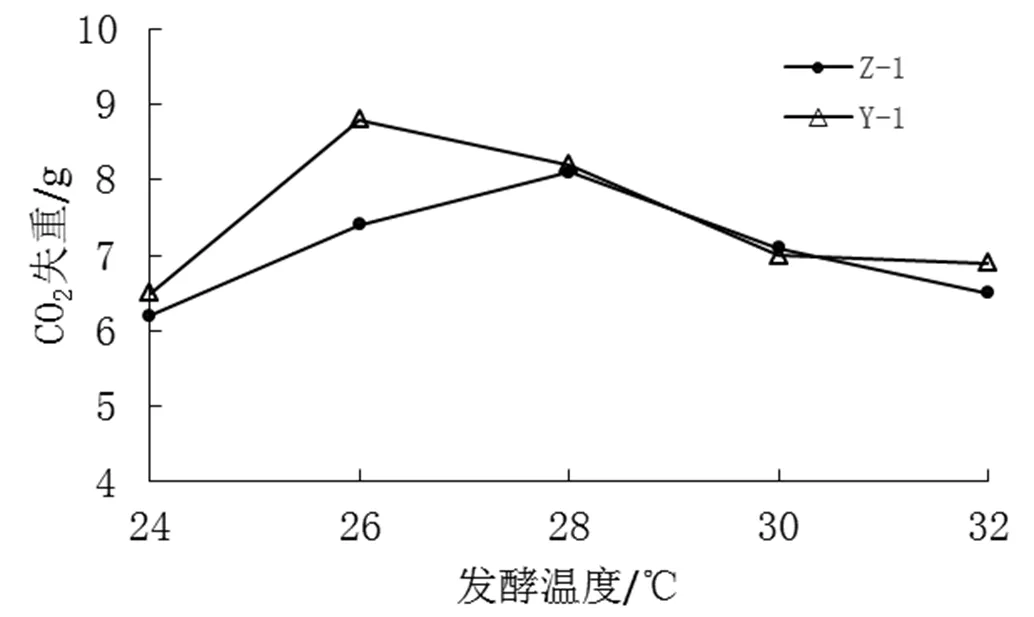
图5 不同发酵温度对CO2失重的影响
由图5中可看出,从24℃开始,CO2失重逐渐增多。在26℃时,菌株Y-1的CO2失重最多,28℃时,菌株Z-1的CO2失重最多,分别为8.8 g和8.1 g,说明此时酵母的发酵力最强。随着温度的继续增高,两株酵母菌株的CO2失重都开始下降,发酵能力逐渐降低。因此,28℃时,菌株Z-1的发酵桃汁能力最强,26℃时,菌株Y-1的发酵桃汁能力最强。
2.2.4 酵母Z-1与Y-1的耐酒精特性
测定不同酒精体积分数(5%、8%、11%、14%和17%)下OD值,结果见图6。
由图6可看出,酵母菌Z-1的酒精耐受性优于Y-1。在5% ~ 8%,两菌株生长良好且趋势稳定,在酒精体积分数8% ~ 14%,两菌株OD值降低,在酒精体积分数17%时,菌株Z-1的OD值降至1.149;菌株Y-1的OD值降至0.249;比较可得知菌株Z-1较菌株Y-1的耐酒精能力强,适应性强。
2.2.5 酵母Z-1与Y-1耐糖特性
测定不同含糖量(5°Bx、10°Bx、15°Bx、20°Bx、25°Bx)的OD值,结果见图7。
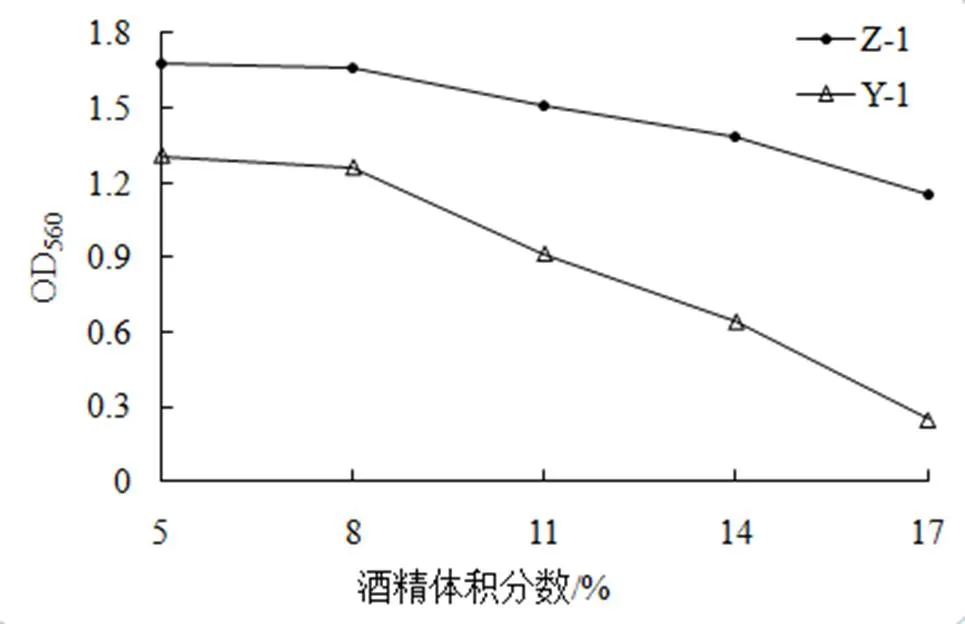
图6 不同酒精体积分数对OD值的影响
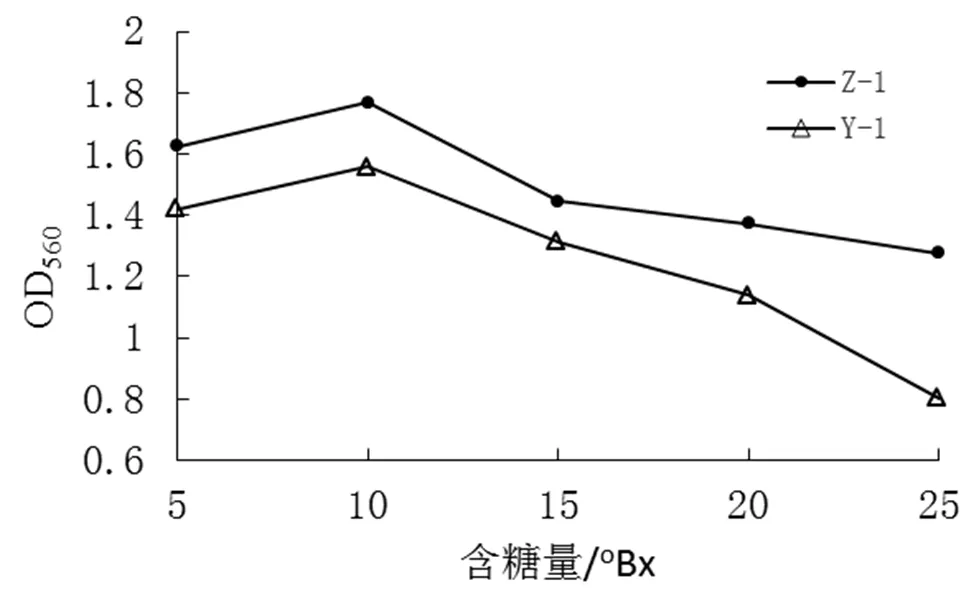
图7 不同含糖量对OD值的影响
由图7可看出,当含糖量在5~10oBx之间,菌株Z-1与Y-1的OD值升高,10~25oBx之间,菌株Z-1与Y-1的OD值不断降低,活菌量不断减少,菌株生长受限制。两菌生长趋势一致。在10oBx时,其OD值均最大,达到1.767和1.559;含糖量为25oBx时,OD值分别达到等到1.275、0.803,两菌株OD值达到最小。可以看出,菌株Z-1对糖环境适应能力较强于Y-1菌株。
3 结论
本实验以河北省衡水市本地油桃、早九宝为分离源,从中各获得一株酵母菌株,编号分别为Y-1,Z-1。经鉴定Y-1,Z-1均为酵母属的酿酒酵母。菌株代谢特性结果表明,菌株Y-1和Z-1的生长最适温度分别为25℃、30℃;生长最适pH分别为5.5、5.0;发酵最适温度分别为26℃、28℃;菌株Z-1的酒精耐受性与耐糖性均高于菌株Y-1。菌株Z-1更适合桃酒的生产。
[1] 李泽霞,王新磊,胡铁功,等.蜜桃酒酿造菌种的筛选[J].酿酒科技,2017(9):44-47.
[2] 蒋锡龙,魏彦锋,孙玉霞,等.桃果酒酿酒酵母选育及酿造条件研究[J].食品工业科技,2013,34(19):156-160.
[3] 罗安伟.猕猴桃酒生香嗜杀酵母的选育[D].咸阳:西北农林科技大学,2012.
[4] 杜刚,詹梦涛,马坚司毅,等.蜂蜜中酵母菌的分离鉴定及蜂蜜酒的研制[J].中国酿造,2020,39(7):78-82.
[5] 乔建援,王林风,银会娟,等.筛分的优良酿酒酵母菌株性能研究[J].食品与发酵科技,2020,55(6):60-64.
[6] 雷梦琳,李湘銮,白卫东,等.酵母菌高糖胁迫机制的研究进展[J].中国酿造,2020,39(7):20-24.
[7] 叶片,刘建,黄均,等.不同种属酵母菌共培发酵桑葚酒的工艺优化[J].食品与发酵工业,2020,46(8):173-178.
[8] 王贵双.嗜杀酵母的筛选及其在苹果酒发酵中的应用[D].北京:北京林业大学,2006.
[9] 吴荣荣.梨酒用酵母的发酵特性研究[J].现代农村科技,2012(21):53-55.
[10] 吴荣荣.苹果酒酵母代谢特性研究[J].现代农村科技,2012(22):56-58.
The Selective Breeding and Fermentation Characteristics of the Yeast in Peach Wine
ZHAO Juanjuan, WU Rongrong, WANG Yan, YUAN Yuanyuan, HU Pengfei
(College of Life Science, Hengshui University, Hengshui, Hebei 053000, China)
One yeast strain is respectively obtained from nectarine andpeach. They are marked as Y-1 and Z-1. By studying the morphological, physiological and biochemical characteristics of cells, the two strains are identified and their fermentation characteristics are determined. The results show that strains Y-1 and Z-1 are saccharomyces cerevisiae of yeast genus. Y-1 and Z-1 grow best at 25℃ and 30℃ respectively and they grow best at PH 5.5 and PH 5.0 respectively. The optimum fermentation temperature is 26℃ and 28℃ respectively, and the CO2weight loss is 8.8g and 8.1g respectively. Z-1 shows better resistance to high concentration of ethanol and sugar than Y-1. Therefore, Z-1 would be more valuable for peach wine production than Y-1.
yeast; isolation and identification; fermentation characteristics; peach wine
10.3969/j.issn.1673-2065.2021.01.002
赵娟娟(1982-),女,河北武邑人,讲师;
吴荣荣(1976-),女,河北深州人,副教授,理学博士。
衡水学院校级课题(2020ZR19)
TS261.9
A
1673-2065(2021)01-0005-05
2020-08-15
(责任编校:李建明 英文校对:李玉玲)

