冷刺激磨牙对TRPM8基因敲除小鼠脑干中c-Fos表达的影响
艾 林,高 鹏,李 恺,张若冰
(1.空军军医大学西京医院口腔科,陕西 西安 710032;2.陕西省药品监督管理局,陕西 西安710065)
牙髓又称牙髓蛋白复合体,是人体内神经支配最密集的组织之一。牙髓中的感觉神经元对温度、物理、化学刺激都有反应,反馈为疼痛[1]。牙髓神经元被各种炎症介质激活,包括内源性物质,如缓激肽和神经生长因子(Nerve growth factor,NGF),以及外源性物质,如辣椒素等[1-2]。人类感知温度的能力很大程度上取决于瞬时受体电位(Transient receptor potential,TRP)离子的受体,TRP通道可以被温度和某些化学物质激活,如辣椒素、薄荷脑、芥末油、樟脑和丁香酚等[3]。当这些化学物质被用于人体时,它们会引起燃烧或冰冷的感觉,激活背根神经节(Dorsal root ganglion,DRG)神经元和三叉神经节神经元中的受体,作为警告信号预防牙髓损伤。此外,炎症介质如缓激肽、前列腺素E2也可以调节这些受体[4]。其中TRPM8受体是冷感觉的主要分子介质,体外研究确定TRPM8的组织分布仅限于成人DRG神经元和三叉神经节,尤其是小直径C纤维神经元,激活范围在19~25 ℃之间[5]。本研究选取基因c-Fos及其蛋白作为脊髓和脑干神经元对温度反应的活性标志物,研究c-Fos在三叉神经核中的表达,确定冷刺激牙髓是否会增加野生型小鼠脑干中c-Fos的表达,观测对伤害性刺激有反应的神经元群的精确解剖位置,以及冷刺激牙髓炎症的小鼠磨牙对脑中c-Fos的表达影响,使用TRPM8基因敲除小鼠研究TRPM8是否介导牙髓冷刺激痛,为临床缓解牙髓炎等疼痛症状提供理论保障。
1 材料与方法
1.1 实验材料与仪器 TRPM8杂合子小鼠由上海交通大学医学院徐天乐教授惠赠。DMEM、DMEM/F-12、胰蛋白酶(Sigma公司,美国);胎牛血清、胶原酶Ⅳ、DMSO(美国Hyclone公司);Percoll分离液、TRIzol溶液、台盼蓝(Invitrogen公司,美国);TRPM8羊抗鼠一抗(Santa Cruz公司,美国);荧光定量RT-PCR试剂盒(深圳科润达生物工程有限公司,中国);BCA蛋白定量试剂盒(上海晶抗生物工程有限公司,中国)。超净工作台(苏州净化设备厂,中国);电子分析天平(赛多利斯公司,德国);CO2培养箱(赛默飞世尔科技有限公司,中国);荧光倒置显微镜、凝胶成像系统、显微摄像全自动图像分析仪(Olympus公司,日本);核酸分析仪(Pharmercia公司,瑞典);定量PCR仪,DNA测序仪(ABI公司,美国);石蜡、冰冻组织切片机(Leica公司,德国);酶联免疫检测仪(Bio-Rad公司,美国)。
1.2 实验方法
1.2.1 TRPM8基因敲除小鼠的繁殖与鉴定:选取TRPM8基因杂合子(TRPM8+/-)小鼠,按照无特异病原体(SPF)级动物饲养标准(26 ℃,相对湿度50%~70%,明暗交替12 h/d,)进行饲养繁殖。本实验采用TRPM8+/-鼠进行繁殖,其子代小鼠可能出现TRPM8+/+、TRPM8+/-、TRPM8-/-的基因型,在小鼠断乳后,剪取小鼠尾尖1.0~1.2 cm,参照试剂盒说明书进行小鼠基因型鉴定,分离出TRPM8-/-进行繁殖。
1.2.2 冷刺激牙髓:通过吸入异氟醚(与氯胺酮相比不会影响脑干神经元的放电)和腹腔注射2.5%三溴乙醇进行麻醉。使用内部饱和冰渣的棉花球在小鼠左上磨牙的颌面上直接涂抹,1次/2 min,在30 min内至少重复12次。以对侧同名牙作为空白对照。使用手术显微镜观察冷刺激对上颌磨牙的作用。根据需要对动物进行再麻醉,以确保它们在灌注前保持无意识。
1.2.3 组织制备:初始刺激结束2 h后,麻醉的小鼠经心灌流20 ml 0.1 mol/L PBS以及20 ml 4%多聚甲醛。灌注后,将脑干解剖取出制备以下标本。①冰冻切片用标本:置于4% PFA中固定48 h,之后转入30%蔗糖PFA中脱水,待标本沉底后更换30%蔗糖PFA溶液;再次沉底脱水充分后,取出脑标本用滤纸吸取表面残留液体,置于-80 ℃超低温冰箱中长期保存备用。②石蜡切片用标本:小心剥离脑组织后置于4% PFA中固定48 h,之后转入50%酒精中脱水30 min,后将脑组织置于70%酒精中室温保存备用。③新鲜标本:小心剥离脑组织,于冰上分离小脑,置于EP管中保存于-80 ℃超低温冰箱中,留待蛋白提取。
1.2.4 免疫组织化学:①石蜡标本制备及HE染色:将标本从70%酒精中取出,取下小脑,置于包埋框,依次将标本脱水、透明、浸蜡处理,按冠状面垂直于底面包埋,4 ℃冰箱中过夜。取出蜡块。用石蜡切片机切取厚度为5 μm小脑矢状面切片,37 ℃恒温箱中烘干,常温保存。标本常规脱蜡及水化,过伊红染色液,冲洗自然风干后,DPX封片,标本室温保存,待拍照。②冰冻切片:从-80 ℃超低温冰箱中取出标本,去除小脑,以嗅球朝上方向包埋固定,用冰冻切片机切取40 μm大脑冠状面切片,0.01 mol/L PBS漂洗,置于防冻液中,-20 ℃冰箱中保存备用。③免疫组织化学荧光染色:选取合适位置的小鼠大脑切片,0.01 mol/L PBS中漂洗3次后分别置于3% H2O2、0.3% Triton以及3% BSA溶液中,浸泡后分别漂洗3次,并置于中在37 ℃恒温箱中孵育30 min。将标本置于一抗中,4 ℃孵育过夜(c-Fos抗体孵育48 h),0.01 mol/L PBS漂洗后置于二抗中,37 ℃恒温箱中孵育2 h后用0.01 mol/L PBS漂洗3次。以AVP及GR指标做免疫荧光染色,再次二抗孵育后,漂洗、复染、封片,-20 ℃保存待拍照。再以c-Fos及Ibal做免疫组化染色,进行DAB显色、漂洗、DPX封片,室温保存待拍照。④免疫印迹试验(Western blot):裂解液裂解后提取小脑蛋白,吸取上清液,计算出小脑蛋白样品的蛋白浓度。将蛋白样品、缓冲液及裂解液混合配平煮沸变性后于-80 ℃冰箱中保存。SDS-PAGE蛋白凝胶电泳,将蛋白进行分离、转膜。取出膜,TBST缓冲液漂洗后于5%脱脂牛奶的摇床上室温孵育3 h。再次使用TBST漂洗3次,将条带加入一抗后4 ℃孵育过夜,漂洗3次后加入二抗后室温孵育3 h。漂洗3次,每次10 min,Western曝光仪下进行曝光。⑤细胞计数:在10倍显微镜下观察载玻片,由一名独立的观测者比较同侧(刺激)和对侧(非刺激)三叉神经核(尾状、过渡区或间极)c-Fos免疫反应细胞的数量,以及细胞是否出现在灰质或白质。
1.3 观察项目 选取小脑矢状面中间部位形态相似切片进行免疫组化荧光染色及HE染色。蛋白印迹分析蛋白表达量为目的条带灰度值与内参灰度值之比,其结果取平均值进行比较。比较各组小鼠同侧和对侧三叉神经核内c-Fos阳性细胞数的平均值。
1.4 统计学方法 采用SPSS 22.0统计学软件进行单因素方差分析,组间比较采取LSD-t法,P<0.05为具有统计学差异。
2 结 果
2.1 尾端核c-Fos表达的差异 同侧和对侧尾端核c-Fos表达比较差异无统计学意义(P>0.05)(图1)。
2.2 间极核c-Fos表达的差异 同侧间极核(平均4.56个细胞/切片)和对侧间极核(平均3.42个细胞/切片)c-Fos表达比较有统计学差异(P<0.05)(图2)。
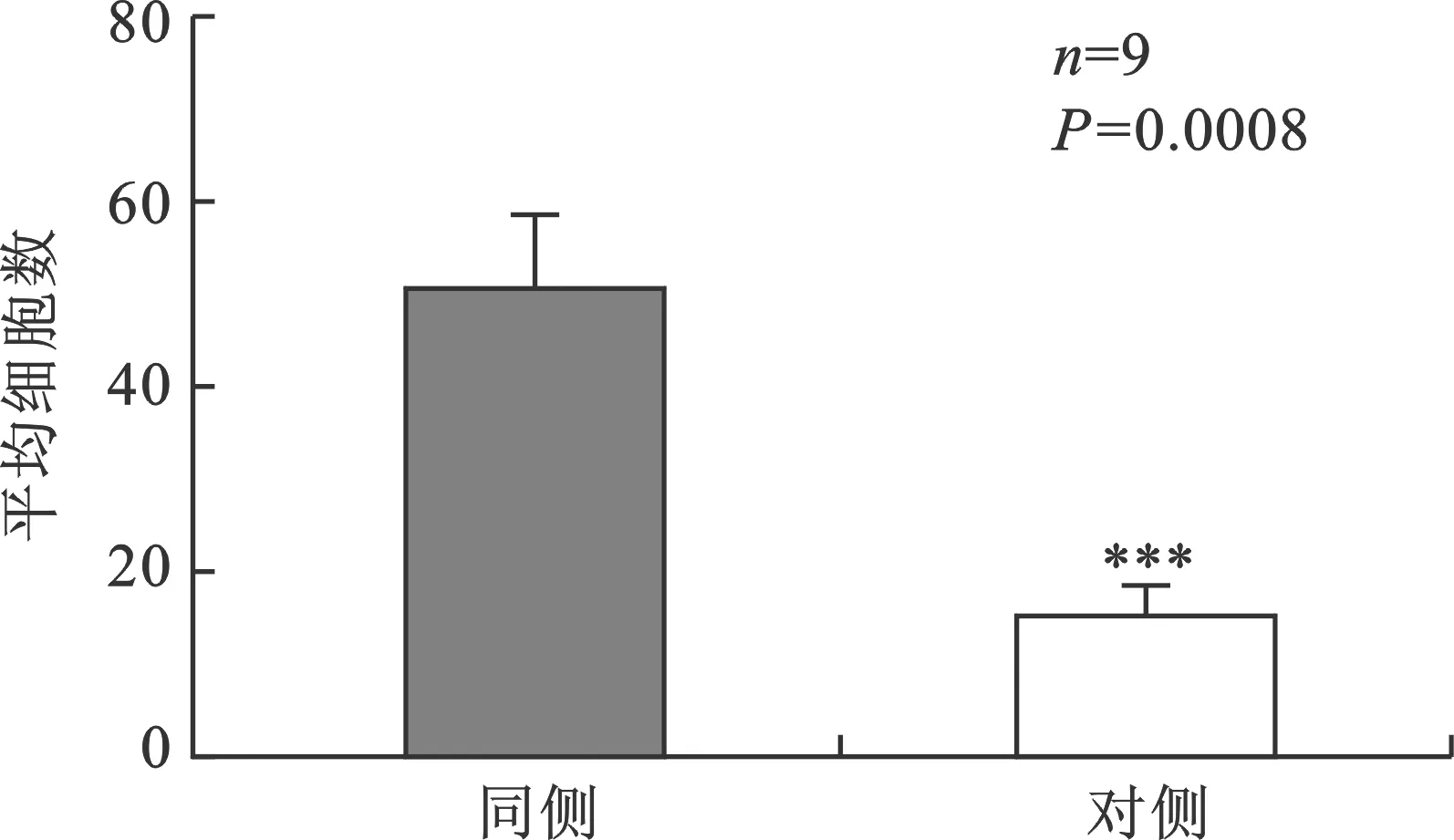
图2 冷刺激对野生型小鼠间极核c-Fos表达的影响
2.3 尾端核和间极核之间过渡区c-Fos表达的差异 在位于尾端核和间极核之间的过渡区,同侧(平均50个细胞/切片)的c-Fos表达显著高于对侧(平均18个细胞/切片)(P<0.05)(图3)。免疫组织学切片显示实验侧c-Fos表达更强(图4)。

图3 冷刺激对野生型小鼠尾端核和间极核过渡区c-Fos表达的影响
2.4 冷刺激对TRPM8基因敲除小鼠c-Fos表达的影响 冷刺激小鼠磨牙,显示TRPM8基因敲除小鼠与野生型小鼠出现相似的c-Fos表达模式,冷刺激侧c-Fos表达增加,但差异无统计学意义(P>0.05)(图5)。

A:脑干免疫组织化学切片显示c-Fos表达(×4);B:同侧(实验侧)放大显示稳定的c-Fos表达(×10);C:对侧(对照侧)放大显示c-Fos细胞较少(×10)

野生型小鼠(WT):在三个解剖位置,实验侧c-Fos表达增加;TRPM8基因敲除小鼠(TRPM8):实验侧c-Fos表达同样增加;野生型小鼠和TRPM8基因敲除小鼠在各个解剖位置上c-Fos表达比较无统计学差异
3 讨 论
瞬时受体电位通道(Transient receptor potential channels,TRPs)是一种位于细胞膜上的阳离子通道,最早在果蝇的视觉系统中发现[6]。根据序列和结构的同源性目前已发现28种TRP通道亚型,分为6个亚家族,参与多种机体调节机制及疾病病理生理过程[7]。TRP通道可以接受信使分子、化学、物理及温度等变化的调节,是细胞重要的感受器。TRP通道家族分布广泛[4,8],主要功能包括:温度和疼痛感觉、机械感觉、味觉感觉、介导PLC依赖的钙内流、维持细胞离子稳态、参与细胞生长调控、调节神经递质释放和激素分泌等。Tsavaler等[9]用人类前列腺特异性互补DNA(cDNA)文库的方法分离出了一种新型的前列腺特异性基因,命名TRPM8。人类TRPM8的基因位于染色体2q37.1部位,全长102.12 kb[10]。TRPM8主要分布于前列腺、背根神经节和三叉神经的感觉神经元,是一种非选择性的阳离子通道,有研究表明TRPM8通道和冷觉感受器之间的温度-反应性曲线有一定的波动性[11]。TRPM8有通道激活的温度阈值,温度阈值指温度感觉神经元开始诱发动作电位的特定温度,其温度敏感性主要依赖于跨膜电压。桉叶脑、芳樟醇、香叶醇也可以激活TRPM8产生凉爽的感觉[12]。因此TRPM8对于冷刺激的传导起着重要作用。
牙髓中的感觉神经元对温度、化学、机械刺激都有反应,就像在牙本质过敏症的情况下一样。此外,牙髓神经元也可以被各种炎症介质激活。牙髓的伤害感受器可分为两类:①A-δ(有髓)纤维位于牙髓周围,刺激阈值相对较低,并产生剧烈的刺痛。这些纤维占支配牙髓、牙本质、前牙本质和牙髓角附近成牙本质细胞层的25%~50%。②C(无髓鞘)纤维位于牙髓深处。它们具有较高的刺激阈值,通常在组织损伤时被激活,并以隐痛为特征。刺激温度分为无害低温(15~30 ℃),有害低温(15 ℃及以下)和有害高温(43 ℃以上)三种类型[2]。人类感知温度的能力很大程度上取决于瞬时受体电位离子的受体。对牙髓的感觉刺激,无论是温度、化学还是机械刺激,都反馈为疼痛。牙本质敏感性的流体动力学理论认为,刺激会引起牙本质液体流动的变化,从而通过机械感受器反应激活神经纤维,从而引起疼痛。然而,最近研究[4,13]发现的TRPs是温度刺激激活神经末梢的另一种机制。
本研究选取的基因c-Fos及其蛋白作为脊髓和脑干神经元对有毒化学、热和机械刺激的反应的活性标志物。通常基因表达是用原位杂交来测量的,而蛋白质的表达也可以用免疫细胞化学技术来评估。通过使用c-Fos,可以观测到对伤害性刺激有反应的神经元群的精确解剖位置。通过计算参与刺激信号的中枢神经系统解剖区域中标记的神经元数量来量化蛋白表达。但将c-Fos表达量诱导到可靠测量的水平需要强烈而持久的刺激,而且并非所有的神经元在激活时都能表达这种基因。因此,c-Fos表达的缺失不能说明对应的神经活动的缺失。
本研究结果表明,冷刺激实验小鼠正常牙髓后,过渡区神经元中c-Fos的表达显著增加,这一发现表明,有害的冷刺激会增加相关脑干神经元的神经活动。本研究所建立的模型可用于研究牙髓疼痛的传导,使用c-Fos表达也可以作为牙髓疼痛传导测量的有效工具。如前所述,诱导c-Fos需要强烈而持久的刺激。尽管我们无法精确测量冷刺激作用于小鼠磨牙的量,但本研究表明,在有害的冷刺激时,c-Fos的表达显著增加,这表明刺激的量和时间是足够的。本研证明c-Fos在三叉神经核中的表达,确定冷刺激牙髓增加了野生型小鼠脑干中c-Fos的表达。
本研究显示:TRPM8的缺失不会影响冷诱导c-Fos的表达,这一发现表明TRPM8可能不是小鼠牙髓中负责温度传递的唯一受体,还应考虑其他冷传导通道的作用,如钾通道和钠通道。有研究[14]证明人牙髓成纤维细胞和成牙本质细胞在分子、蛋白质和功能水平上表达TRPs,特别是TRPA1和TRPM8,结果表明成纤维细胞和成牙本质细胞也可能在调节人类牙齿的冷刺激反应中起作用,本研究为临床缓解牙髓炎等疼痛症状提供理论支持。

