CAR T细胞治疗NHL毒副作用临床管理专家共识
中国研究型医院学会生物治疗学专委会
主 编
韩为东 梁爱斌 钱文斌
副主编
刘 洋 李 萍 张亚晶 史凤霞 梁 赟
专家编委会主要成员(按姓氏汉语拼音排序)

姓 名工作单位薄 剑解放军总医院血液科高素君吉林大学第一医院血液科韩为东解放军总医院生物治疗科胡永仙浙江大学医学院附属第一医院骨髓移植中心胡 豫华中科技大学同济医学院附属协和医院黄 河浙江大学医学院附属第一医院黄晓军北京大学血液病研究所景红梅北京大学第三医院血液内科克晓燕北京大学第三医院血液内科李建勇南京医科大学第一附属医院血液科李 萍上海同济大学附属同济医院血液科李玉华南方医科大学珠江医院血液内科梁爱斌上海同济大学附属同济医院梁 赟浙江大学医学院附属第二医院血液科刘启发南方医科大学南方医院血液科刘 洋解放军总医院生物治疗科陆佩华北京陆道培医院 北京陆道培血液病研究所梅 恒华中科技大学同济医学院附属协和医院牛 挺四川大学华西医院血液科钱文斌浙江大学医学院附属第二医院血液内科宋永平郑州大学附属肿瘤医院宋玉琴北京大学肿瘤医院苏丽萍山西医科大学附属肿瘤医院血液病诊疗中心史凤霞解放军总医院生物治疗科涂三芳南方医科大学珠江医院血液内科王建祥中国医学科学院北京协和医学院血液病医院吴德沛苏州大学附属第一医院血液科王 昭首都医科大学附属北京友谊医院血液科徐开林徐州医科大学血液病研究所应志涛北京大学肿瘤医院淋巴瘤科杨清明解放军总医院生物治疗科张 斌解放军总医院第五医学中心全军造血干细胞研究所张会来天津医科大学肿瘤医院淋巴瘤内科张 曦陆军军医大学新桥医院血液病医学中心张亚晶解放军总医院生物治疗科赵明峰天津市第一中心医院血液科赵维莅上海交通大学医学院附属瑞金医院血液内科
嵌合抗原受体修饰T细胞(Chimeric Antigen Receptor T Cell,CAR T)已成为复发难治性非霍奇金淋巴瘤(Non-Hodgkin′s Lymphoma,NHL)的重要治疗手段。以CD19为靶点的CAR T淋巴瘤治疗在欧美获批[1],中国CAR T临床试验研究在数量上也与美国并行[2],同时国内新型CAR T细胞研发和应用技术创新(如双靶点CAR T技术、多种CAR T序贯治疗等)也在不断刷新数据[3-11],CAR T细胞的淋巴瘤治疗进入常规治疗范畴指日可待。
随着研究的深入和临床应用的增加,临床医生对CAR T细胞相关毒副作用及临床的防控措施愈发重视。共识编写参照和借鉴了现有的CAR T细胞毒性管理共识[12-17],同时综合国内31家CAR T临床研究机构的个案报道和临床处置经验。本共识细化了临床处置流程,注重和强调特征性毒副作用的识别与防控措施,如细胞回输后肿瘤受累部位出现的局灶性炎症,即“局部细胞因子释放综合征”(Local Cytokine Release Syndrome,L-CRS)的识别与干预[18]。本共识旨在为临床医生判别与处理CAR T治疗NHL相关毒副作用提供更为规范的处置原则和探索性处理建议。
本共识分6个部分:前2部分阐述CAR T细胞治疗前评估和共识推荐证据级别的说明,后4个部分介绍CAR T相关毒副作用,包括细胞因子释放综合征、CAR T相关脑病综合征、噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征、其他不良事件(图1)。本文重点对最为常见的细胞因子释放综合征(Cytokine Release Syndrome,CRS)临床管控路径进行了重点阐述。
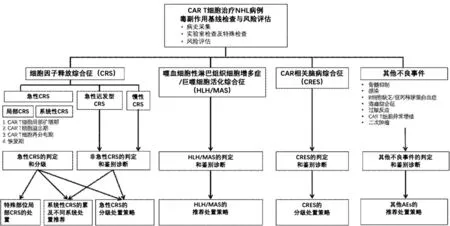
图1 CAR T细胞治疗NHL毒副作用临床管理路径流程图
1 基线检查与风险评估
患者治疗前基线的评估从病史、检查两方面进行,获得初步数据后可以根据“高危因素”对患者进行风险评估。
1.1 病史采集 病史采集包括淋巴瘤病史和基础疾病病史。淋巴瘤病史应涵盖初诊时淋巴瘤病理分型、分期,既往治疗经过等;目前病情,末次治疗、病灶范围、分布、受累器官等;近1个月内病理活检、免疫组化结果等;淋巴瘤相关的既往病史,包括感染性、传染疾病(如肝炎、EBV病毒感染);推荐ECOG评分系统[19]对患者一般状态进行评估。推荐对淋巴瘤受累器官功能进行评估,根据症状、体征、实验室、影像学内窥镜检查结果,评估受累脏器功能(如压迫、梗阻、溃疡出血等)。
1.2 实验室检查、特殊检查及其他有创检查
1.2.1 实验室检查 实验室检查推荐:血常规、尿常规;粪便常规+潜血;血生化(肝肾功能、甘油三酯、乳酸脱氢酶、心肌酶及电解质);凝血功能(APTT、PT、TT、Fg、FDP、D-D二聚体);病毒检测(推荐检测):乙肝6项、丙肝、梅毒、HIV;病毒检测(可选择检测):EBV、CMV、人类疱疹病毒;细胞因子检测(基线)(推荐检测):C-反应蛋白(CRP)、IL-6;细胞因子检测(基线)(可选择检测):IL-1、IL-2、IL-15、血清肿瘤坏死因子TNF-α、血清干扰素IFN-γ、IFN-α;血气分析(可选)。
1.2.2 特殊检查 特殊检查推荐项目:心电图;超声心动图;全身浅表淋巴结超声;胸部(增强)CT;腹部增强CT或增强核磁检查;PET-CT;头颅增强核磁检查;肺功能检查;其他视患者具体病情,需要完善的检查(如腹腔积液应完善腹部超声检查等)。
1.2.3 其他有创检查 病灶病理活检及免疫组化检测(推荐);骨髓穿刺检查:细胞形态学检查(推荐)、骨髓细胞流式检查(推荐),骨髓病理学检查(推荐),骨髓染色体核型分析(可选);脑脊液检查:可疑中枢受累病例(推荐),其他病例(可选);胃肠镜检查:可疑消化道受累病例(推荐),其他病例(可选);其他:视患者具体病情,需要完善的检查(如大量胸腔积液、腹腔积液应完善胸腔和腹腔穿刺引流,及胸腔和腹腔积液的常规、生化、细胞学等检测)。
1.3 CAR T治疗风险评估 根据病史、器官功能评估及检查结果,对入组行CAR T治疗的淋巴瘤患者进行风险评估,预判其可能发生严重毒副作用的可能性。如存在以下“高危因素”之一即可评价为“高危病例”。高危因素包括:①ECOG≥3;②年龄≥70岁③高肿瘤负荷:病灶(所有最大径≥1.5 cm的可测量病灶)最大直径之和[20](Sum of the Product of the Perpendicular Diameters for Multiple Lesions,SPD)≥100 cm;④巨块型病灶:单个病灶直径≥10 cm;⑤病灶位于咽部、气管旁且存在压迫症状;⑥病灶临近胃肠、胆管等重要空腔脏器,如病灶增大可压迫或侵犯周边脏器并影响其功能;⑦浆膜腔受累或存在中、大量浆膜腔积液(如胸腔积液、腹腔积液);⑧乙型肝炎病毒HBsAg(+)、HBV DNA拷贝数监测高于正常值上限或专科医生确诊处于乙型肝炎病毒活动期,且未行抗病毒治疗;⑨重要脏器淋巴瘤受累(如肺、胰腺、骨髓等);⑩存在肿瘤相关性发热。
2 共识推荐证据级别说明
本共识的临床管理措施根据其证据级别分为“推荐应用”和“推荐尝试应用”两种推荐强度,分级说明如下,推荐应用:处置方案具备2期临床研究的循证医学证据;推荐尝试应用:具备1期临床研究的循证医学证据,或基础研究数据证实同时有个案报道证据,或单中心经验性数据支持,或专家推荐。
3 CRS
CRS是由免疫治疗引起的内源性或输注的T细胞以及体内其他免疫细胞激活所产生的一种超生理反应[16]。CAR T细胞治疗相关CRS在淋巴瘤病例中发生率为30%~95%,严重CRS(≥G3)发生率为10%~30%[16,21-22]。
与急性淋巴细胞性白血病不同,淋巴瘤中CAR T细胞治疗相关CRS在发生机制、临床表现上具有特殊性,细化CRS分期、分型,有利于临床医生对这一不良事件进行更为有效的管控。
3.1 CRS分期与分型 按发生时间CRS可分为:①急性CRS(发生时间:CAR T细胞回输后1~3周);②迟发型急性CRS(发生时间:CAR T细胞回输后3~6周);③慢性CRS(发生时间:CAR T细胞回输6周后)。根据发生部位和影响范围CRS可分为:①局部CRS(Local-CRS)(免疫治疗后病灶局部及周边出现的炎症反应,可表现为病灶增大,局部“红肿热痛”、病灶周围可伴有渗出或积液,甚至出血、穿孔等);②系统性CRS(Systematic-CRS)分期与分型。
3.2 CRS的分级标准 表1。
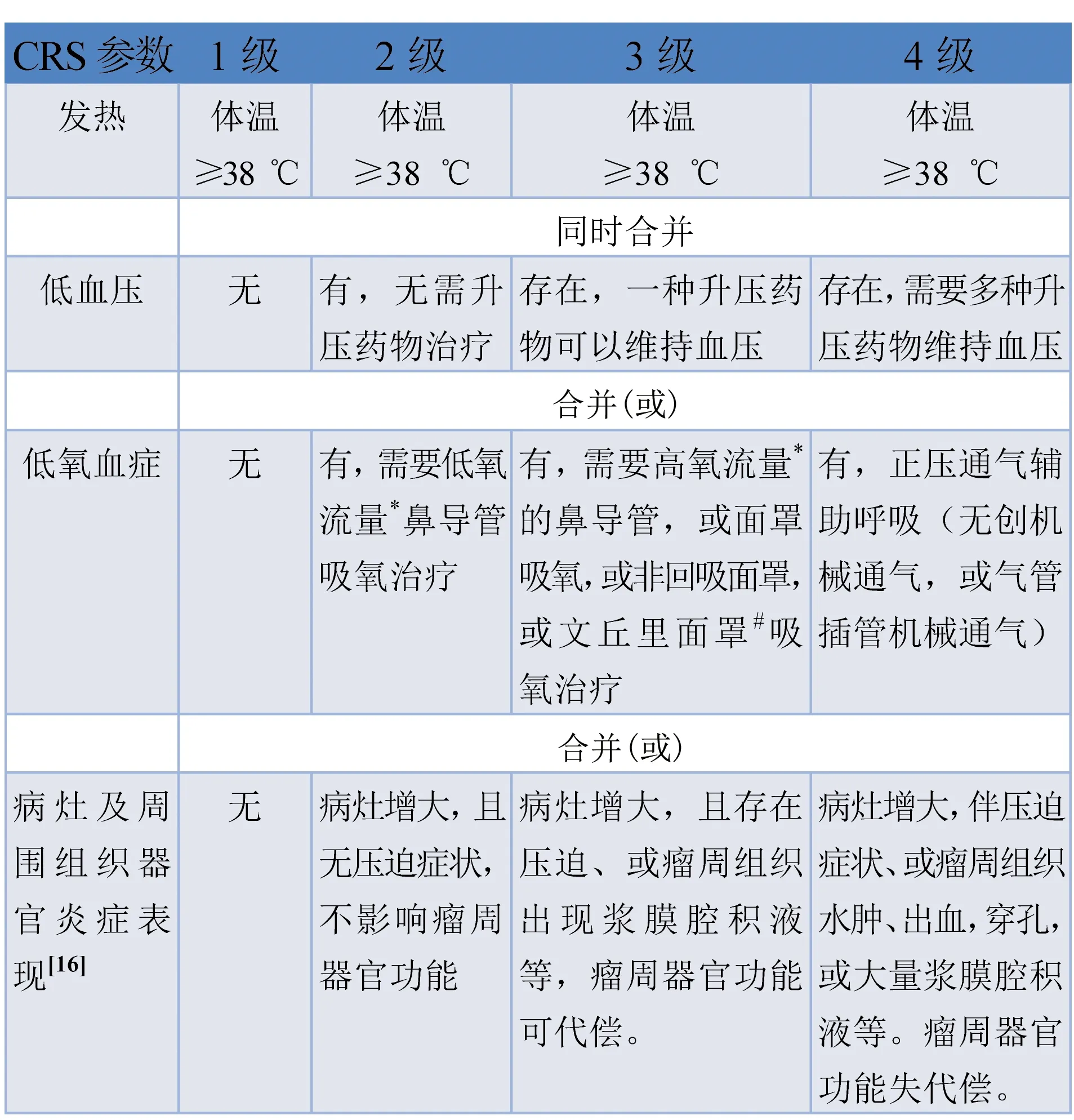
表1 淋巴瘤CAR T细胞治疗相关CRS分级标准[10,16]
3.3 急性CRS CAR T细胞回输后1~3周(急性CRS阶段)是CRS以及严重CRS发生几率最高的时间段,也是处置的关键时期。急性CRS阶段根据临床表现,CAR T细胞体内增殖、分布的变化,可分为4个时期:CAR T细胞局部扩增期(CAR T细胞回输后1~5 d);CAR T细胞溢出期(CAR T细胞回输后5~10 d);CAR T细胞再分布期(CAR T细胞回输后10~15 d);恢复期(CAR T细胞回输后15~21 d)。
3.3.1 急性CRS期间的查体与监护 ①淋巴瘤病灶部位查体:病灶大小、质地、局部温度、压痛;淋巴瘤累及重要脏器,应关注受累脏器体征变化,如肺部淋巴瘤受累应关注呼吸音、肺下界(胸腔积液体征)等;②全身查体:生命体征、皮肤黏膜、胸部、腹部、神经系统等;③CAR T细胞回输后,每天查体至少2次,直至CRS降至1级;④心电监护推荐从CAR T细胞回输开始;⑤心电监护项目:心率、呼吸、血压、血氧饱和度;⑥CRS降至1级时,可以考虑停止监护仪监护;⑦“高危病例”的心电监护:推荐从细胞回输开始,直至回输后3周或高危因素解除;⑧3~4级CRS患者考虑转入ICU监护治疗。
3.3.2 急性CRS期间的实验室检查和特殊检查 实验室检查项目建议:血常规(推荐应用);血生化(肝肾功能、甘油三酯、乳酸脱氢酶、心肌酶及电解质等)(推荐应用);凝血功能检测(推荐应用);动脉血气分析(推荐应用);感染相关检测:降钙素原(推荐应用);血清内毒素(推荐尝试应用);G/GM-试验(推荐尝试应用);细胞因子监测项目:CRP(推荐应用);IL-6(推荐应用);IL-1(推荐尝试应用);IL-2(推荐尝试应用);IL-15(推荐尝试应用);TNF-α(推荐尝试应用);IFN-α(推荐尝试应用);IFN-γ(推荐尝试应用);CAR T细胞检测:CAR基因定量PCR检测(推荐应用);外周血CAR T细胞流式检测(推荐尝试应用)。实验室项目检测频次:(推荐尝试应用)①CAR T细胞回输前检查项目(1 “基线检查与风险评估”),回输后第3天(d3),d7,d10,d14,d21,d28,回输后3个月,6个月,9个月,12个月;②高危病例细胞回输后应每2~3 d检测;③病情变化时,检测项目及频次参考由临床医生决定。特殊检查要点:(推荐尝试应用)①特殊检查项目选择原则:评价淋巴瘤病灶及受累脏器变化(L-CRS),以及S-CRS累及脏器的功能评价;②检测项目及频次参考由临床医生决定。
3.3.3 急性CRS的临床分级处置策略 CRS的临床处置包括监护和治疗两方面,根据CRS的严重程度(分级)采取不同强度的监护模式和治疗策略(表2),托珠单抗单次治疗最大剂量为800 mg(推荐应用);如果需要,托珠单抗可6 h后重复治疗[13]。治疗措施实施后观察24 h CRS症状无改善或加重,应升级至下一级处置(推荐尝试应用);高危病例治疗后观察12 h CRS症状无改善或加重,应升级至下一级处置(推荐尝试应用);高危病例如无β受体阻滞剂治疗禁忌,推荐CAR T细胞回输后即给予β受体阻滞剂(酒石酸美托洛尔片12.5~25 mg口服每12 h 1次)(推荐尝试应用)。
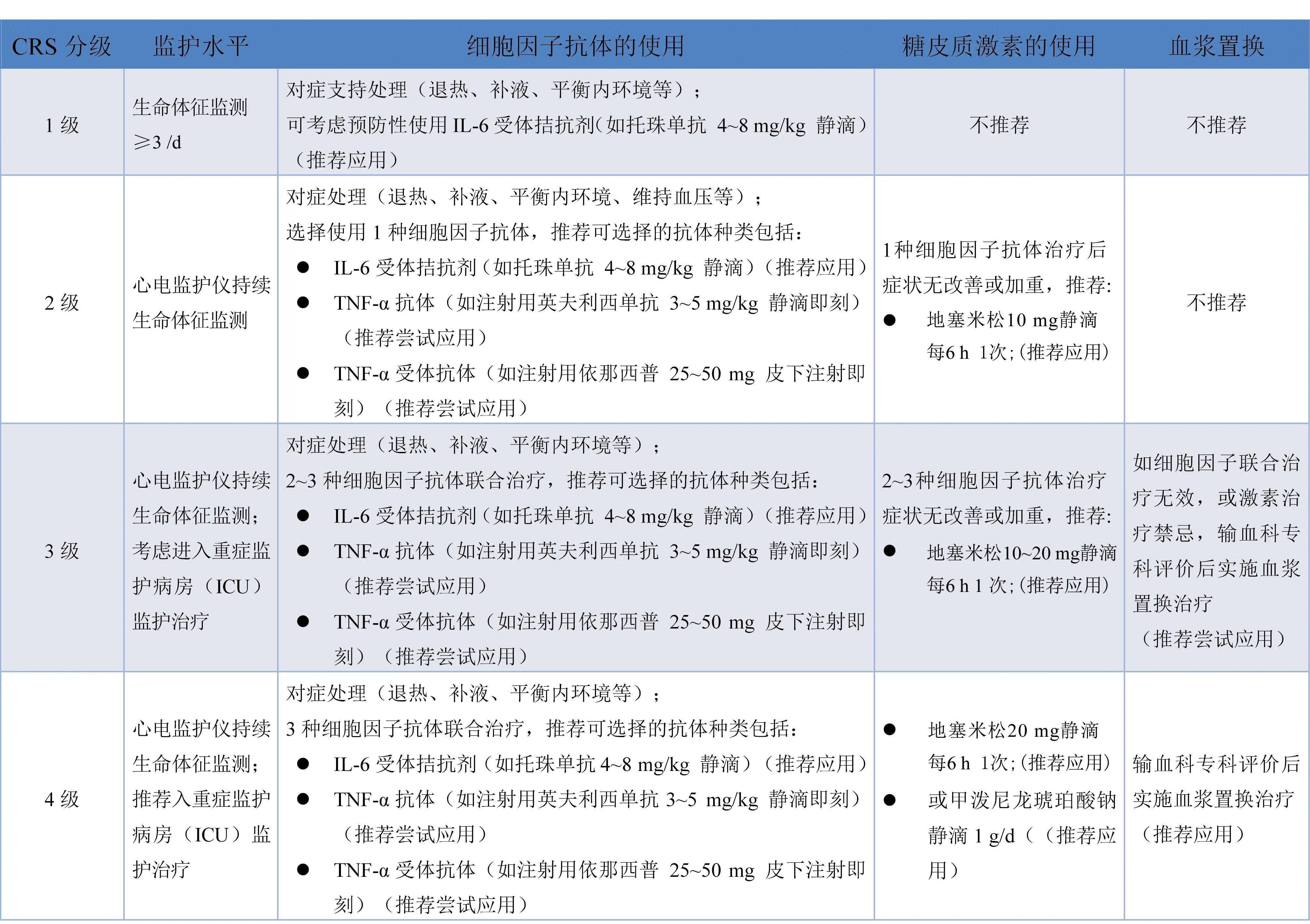
表2 淋巴瘤CAR T细胞治疗相关CRS的常规分级处置策略[13,16,23]
3.3.4 急性CRS的对症支持治疗 对症支持治疗,贯穿于各个级别CRS的处置。这里主要介绍针对发热、低血压、低氧血症、电解质紊乱的推荐处置。发热:主要推荐物理降温配合非甾体药物退热治疗。低血压(收缩压<90 mmHg):快速补充500~1 000 mL的0.9%生理盐水;若血压不恢复,给予胶体补液,如羟乙基淀粉注射液500 mL静滴,或白蛋白注射液(0.25~0.4 g/kg)静滴;若血压仍不恢复,给予1种血管活性药物;无改善则多种血管活性药物联合治疗,血管活性药物如多巴胺剂量范围2~20 μg(min·kg),逐渐加量;去甲肾上腺素起始剂量2 μg/min,逐渐加量;肾上腺素起始剂量2 μg/min,逐渐加量。低氧血症:低流量鼻导管吸氧,氧流量≤6 L/min;低氧血症未纠正,高氧流量(氧流量>6 L/min)鼻导管,或面罩,或文丘里面罩吸氧,低氧血症仍未纠正,呼吸科会诊后给予正压通气辅助呼吸(无创机械通气,或气管插管机械通气)。
3.3.5 急性CRS期间,不同器官淋巴瘤受累涉及L-CRS的处置建议 淋巴瘤可以累及全身各器官,因此不同部位L-CRS的处理存在其特殊性。本共识汇总已有文献及多中心临床研究经验,对不同部位L-CRS的处置推荐如下:肺实质受累:2~3级L-CRS优先选择IL-6受体拮抗剂(如托珠单抗4~8 mg/kg静滴)(推荐应用);4级L-CRS的处理,表4。腹腔内巨块型(最大径≥10 cm)病灶:预处理即开始按照移植模式感控管理(保护性隔离、食物消毒)(推荐尝试应用);调节肠道菌群治疗(预处理开始口服肠道益生菌,如酪酸梭菌三联活菌片口服)(推荐尝试应用);细胞回输d3、d5给予预防性TNF-α抗体治疗(推荐尝试应用);2~3级L-CRS时,优先选择以阻断TNF-α通路抗体组合治疗为主(推荐尝试应用)。浆膜腔淋巴瘤受累致中、大量浆膜腔积液:CAR T细胞回输前穿刺引流浆膜腔积液(推荐尝试应用);留置浆膜腔引流管直至CRS纠正(推荐尝试应用);CAR T细胞回输前3~5 d,浆膜腔局部注射托珠单抗80 mg(推荐尝试应用)。心脏受累:心内科专科评估可能的不良事件(心律失常、心力衰竭、心肌损伤等)(推荐尝试应用);推荐给予非CAR T治疗清除心脏病灶后,再考虑CAR T细胞治疗(推荐尝试应用)。皮肤、肌肉、结缔组织受累:CAR T细胞治疗前,减少或清除皮肤、软组织病灶(推荐尝试应用);加强皮肤局部感染预防(局部用药、清创等)(推荐尝试应用);CAR T细胞回输后早期进行经验性抗感染治疗(推荐尝试应用)。中枢神经系统受累:神经内科专科评估(推荐尝试应用);疗效尚不明确,高风险,慎重选择CAR T细胞治疗(推荐尝试应用)。颈部病灶压迫致吞咽障碍:禁食、留置胃管鼻饲,避免误吸(推荐应用);桥接治疗或强化预处理,尽可能于回输前解除压迫症状(推荐尝试应用)。颈部病灶压迫致呼吸困难:禁食、留置胃管鼻饲,避免误吸(推荐应用);桥接治疗或强化预处理,尽可能回输前解除压迫症状(推荐尝试应用);制定急诊气管插管预案、常规床旁配备气管切开包(推荐尝试应用)。
3.4 迟发型急性CRS
3.4.1 迟发型急性CRS的定义、临床表现及鉴别诊断 迟发型急性CRS,临床表现以系统性CRS为主,是急性CRS的延迟和滞后,发生在CAR T细胞回输后的3~6周。迟发型急性CRS的临床表现:发热;外周血三系下降,多以血小板降低为主;部分患者伴有转氨酶异常升高;出凝血指标异常;外周血检测CAR拷贝数升高;患者未达完全缓解,仍有肿瘤残留。迟发型急性CRS应该与预处理(化疗药物)所致的血液学毒性、消化系统不良事件以及感染相鉴别。
3.4.2 迟发型急性CRS的处置 查体、实验室检查及特殊检查:建议参照急性CRS。处理意见:参照急性CRS处置。
3.5 慢性CRS
3.5.1 慢性CRS的定义、临床表现及鉴别诊断 慢性CRS是指回输CAR T细胞后≥6周后出现的炎性相关或CAR T细胞回输相关的不良事件[24]。慢性CRS临床表现:多表现为缓慢起病或持续性存在;间断低热(38 ℃以下);乏力,纳差;外周血三系下降,多以血小板降低为主;外周血中明确存在CAR拷贝数增加或CAR T细胞流式计数比例再次升高;肿瘤残留,少数患者胸部CT显示肺部间质性炎症样特征,或者支气管扩张样特征。慢性CRS应该与CAR T细胞治疗后感染以及血液学毒性相鉴别[24-27]。
3.5.2 慢性CRS的处置 对症支持治疗,TNF-α/TNF-αR抑制剂,如依纳西普(25~50 mg),或注射用英夫利西单抗3~5 mg/kg,利于改善肺部症状;监测血常规,必要时给予成分血输注支持治疗[24,26-28]。
4 CAR T细胞相关性脑病综合征
CAR T细胞相关性脑病综合征(CAR T Cell-related Encephalopathy Syndrome,CRES)是指CAR T细胞治疗后出现的神经系统功能失调及相关病理性变化[16,29]。免疫效应细胞相关神经毒性综合征(Immune Effector Cell-associated Neurotoxicity Syndrome,ICANS)是指免疫治疗后或继发于输注T细胞或内源性免疫效应细胞激活或应答所导致的中枢神经系统的病理过程和功能失调。相对于CRES,ICANS的定义更为广泛,还包括其他免疫治疗(比如特异性CD3-CD19双抗体、PD-1抗体等)继发的神经系统异常[13,16]。CRES的发病机制尚不明确,高细胞因子水平、高肿瘤负荷、血脑屏障功能异常、CAR T的结构以及颅内血管组织表达CD19等因素可能与CRES发生有关[29]。淋巴瘤患者中CRES发生率为20%~60%,主要发生于CAR T细胞回输后的8周内,中位持续时间为4~6 d。主要临床表现包括头痛、谵妄、认知障碍、肌震颤、共济失调、语言障碍、神经麻痹、感觉障碍、嗜睡、癫痫发作等。继发脑水肿是神经毒性致死的重要原因[13,30-31]。
4.1 CRES的鉴别诊断 CRES发生于回输CAR T细胞后,多数患者同时存在血小板减少,须与脑出血相鉴别。CAR T细胞回输后凝血功能异常,同样存在血栓风险,也应与脑梗死鉴别。通过既往病史,及头颅核磁共振检查可排除及鉴别。
癫痫发作与CRES临床表现易混淆。癫痫患者多有脑血管意外病史及癫痫发作史,同时应警惕CRES合并癫痫的情况。治疗应以CRES治疗为主,可兼顾癫痫的处理。按照推荐意见,控制癫痫大发作,同时可给予激素治疗。
4.2 CRES的分级与临床处置 CRSES的处置流程包括基于CARTOX-10神经系统评分体系(表3)和临床表现对于CRES的诊断和严重程度进行分级(表4);然后根据CRES分级进行相应的临床处置(表5)。
4.3.1 CARTOX-10神经系统评分体系与CRES分级 根据CARTOX-10神经系统评分体系[13](表3)评估患者,结合脑脊液压力,脑电图,体征及影像学检查结果对CRES进行分级[13](表4)。

表3 CARTOX-10神经系统评分体系[13]
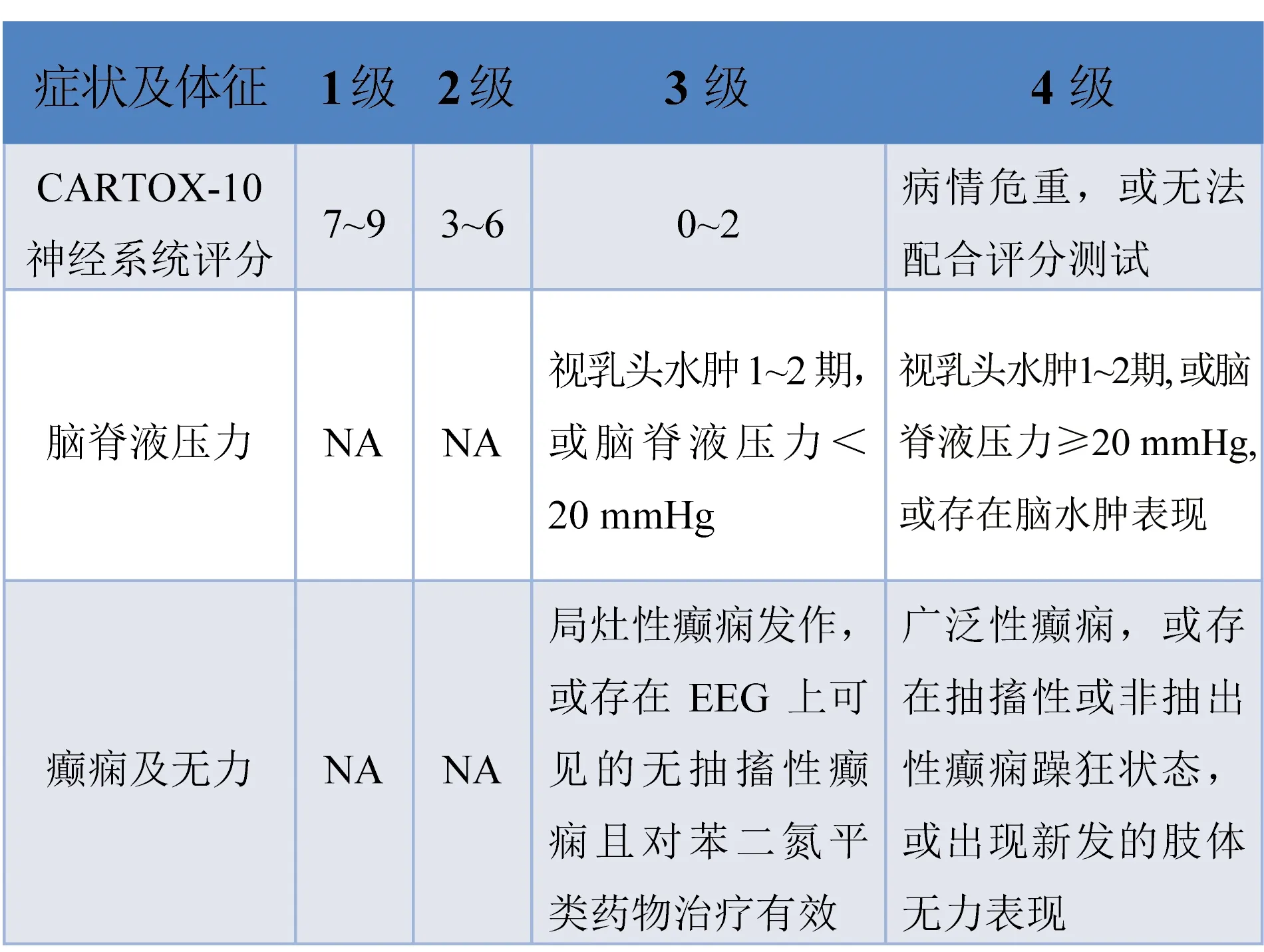
表4 CRES的分级标准[13]
4.3.2 CRES的分级临床处置 表5。

表5 CRES的分级临床处置[13]
5 噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征
5.1 HLH/MAS概述 噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征(Hemophagocytic Lymphohistiocytosis/Macrophage Activation Syndrome,HLH/MAS)是一种涵盖了多种严重免疫功能异常的症候群,特征性表现为巨噬细胞和淋巴细胞的活化,炎性细胞因子升高,淋巴细胞的组织浸润以及免疫介导的多器官功能衰竭。多见于CRS恢复期或伴发CRS过程中[13]。
5.2 HLH/MAS的临床表现及鉴别 与经典的系统性CRS比较,除了常见的发热,HLH/MAS存在相对特征性的临床表现:肝脾肿大,骨髓涂片可见噬血细胞、噬血现象,外周血三系或两系减少,甘油三酯及血清铁蛋白异常增高,多种细胞因子异常增高,sCD25升高等。HLH/MAS可以导致患者长期处于白细胞减少,严重者可因粒细胞缺乏并发感染,存在致死风险。CRS继发HLH/MAS早期易被忽视,其临床表现须与CRS、感染以及CAR T细胞后长期骨髓抑制相鉴别。出现以下情况高度提示HLH/MAS:外周血中CAR T细胞持续高水平存在,超过2周以上,甚至2周后再次升高;再度发热,伴有血象三系下降,肝脾肿大等;铁蛋白持续升高。
5.3 HLH/MAS的处置建议 CAR T细胞后HLH/MAS的临床处理目前尚缺乏规范有效的方法。总结国内多家中心的临床研究经验,并进行相关领域专家交流后,达成以下临床处置和治疗意见:①CAR T细胞后续密切监测患者生命体征及血常规变化(推荐应用);②动态监测血清铁蛋白、甘油三酯(推荐应用)③回输CAR T细胞后出现难以解释的发热和血细胞减少时,须鉴别HLH/MAS(推荐应用);④HLH/MAS确认后,建议应用小剂量依托泊苷(每周50~100 mg)治疗(推荐尝试应用);⑤尝试JAK-2抑制剂(如芦可替尼治疗5 mg,PO,QD-BID),CTLA-4激动性药物(如阿巴西普),CD52抗体(阿仑单抗)(推荐尝试应用);⑥如病情难以控制应及早进行血浆置换(推荐尝试应用);⑦尝试新药,如γ-干扰素抗体等。(推荐尝试应用)。
6 其他毒副反应
6.1 骨髓抑制 骨髓抑制[32]是CAR T细胞治疗后最常见的不良反应之一,其中3级及以上不良反应的发生率约为:中性粒细胞减少(≥70%),贫血(≥50%),血小板减少(≥30%)。
6.1.1 骨髓抑制分级及处理原则 为保证患者治疗流程的顺利进行,降低骨髓抑制期感染及相关并发症,处理措施建议(表6,表7)。
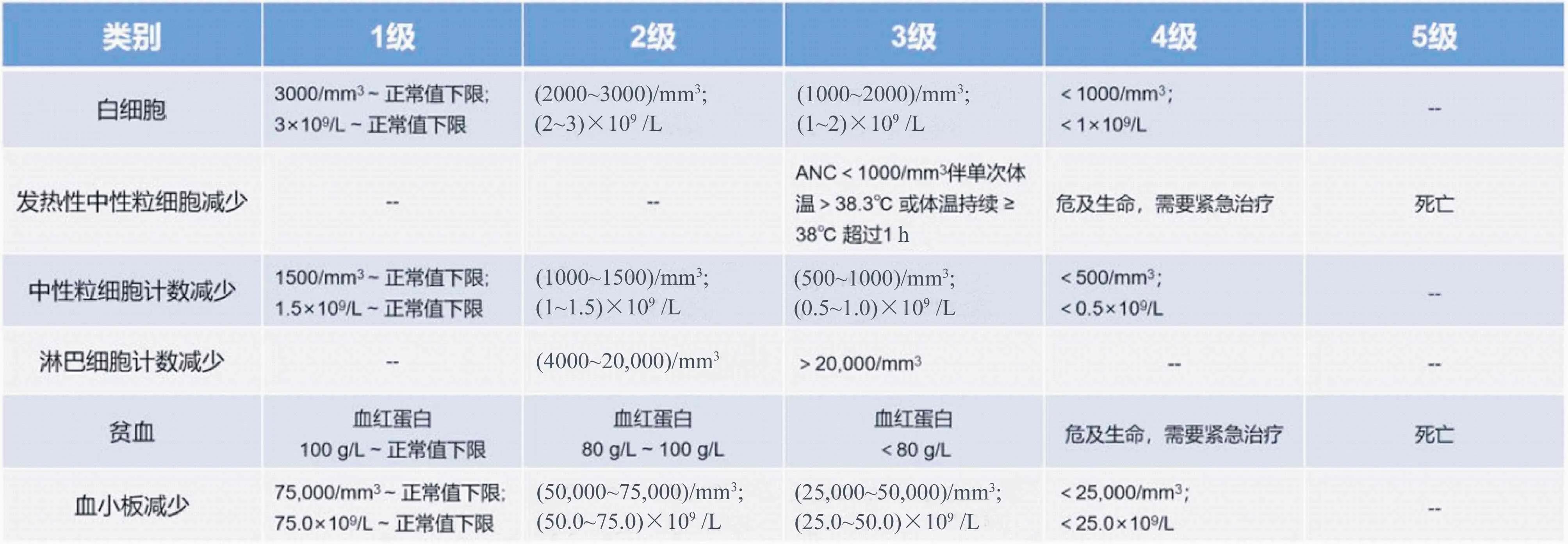
表6 骨髓抑制的分级标准

表7 CAR T细胞治疗期间对应骨髓抑制分级的感染防控推荐处置
保护性隔离措施推荐:紫外线灯消毒每晚1次,每次30 min;清洁肠道:甘油灌肠剂(1/d);坐浴:苯扎氯铵溶液每晚1次;滴鼻:鱼肝油滴鼻液(2/d);擦洗外耳道:75%酒精棉签(2/d);点双眼:左氧氟沙星滴眼液(2/d);漱口:制霉素片+苯扎氯铵溶液交替(6/d)。
6.2 感染 流行病学调查结果显示[34],接受CAR T细胞治疗后1~2年内,各种类型感染发生率约为55%,其中≥3级的严重感染约为33%,侵袭性真菌(含霉菌)感染不超过8%,因严重感染导致死亡的不超过5%,其中,CAR T细胞治疗后1个月内感染最为突出,发生率可高达40%,大部分为细菌感染,主要集中在细胞输注后的2周内。CRS反应期合并感染的死亡率高,因此,感染防控是CAR T细胞治疗的重中之重。
6.2.1 筛选期-预处理前感染筛查项目 乙肝、丙肝、梅毒、艾滋病;EB病毒、巨细胞病毒、单纯-带状疱疹病毒、弓形虫;降钙素原、内毒素;CRP;IL-6;红细胞沉降率;结核分枝杆菌(结核三项、TB SPOT、PPD试验等);肺部CT;呼吸道相关病毒(有上呼吸道症状者);真菌D-葡聚糖检测/曲霉菌半乳甘露聚糖检测。
6.2.2 影像学检查 胸部CT;支气管镜检查/超声引导下支气管镜检查;肺泡灌洗。
6.2.3 特殊检查 感染微生物基因组学检测:样本采集外周血或体液(痰、尿液、浆膜腔积液、皮肤及软组织)等;蛋白组学微生物检测。
6.2.4 CRS与感染的鉴别诊断[35]二者临床表现有相似之处,但目前尚无特异性的标志物将二者明确区分开来;且CRS合并感染的情况时有发生,因此,对二者的发生发展的预判及干预时机把握至关重要;CRS分级与感染程度在细胞因子水平上并未显示出明显的差异;当CRS合并严重感染时,可能会出现IL-6水平的二次升高,可通过IL-8,IL-1β,和IFN-γ等多种细胞因子建立预测模型,来提高CRS与感染鉴别的特异性,但目前仍缺乏足够的临床数据;若二者无法明确鉴别,以预防性抗感染联合CRS分级治疗为指导原则。
6.2.5 感染防控策略
6.2.5.1 预处理期间的感染防控 严重或危及生命的感染约有10%是从CAR T细胞回输前(预处理期)开始的;乙肝表面抗原阳性[36]且乙肝病毒DNA拷贝数<500 U/L(依据各医院检测水平正常值下限),可酌情在预处理开始同时服用抗病毒药物(如恩替卡韦0.5 mg/d),至少持续到细胞回输后6个月,之后每月定期随访检测乙肝病毒DNA拷贝数;预防性抗感染通用原则。

表8 CAR T细胞治疗期间的预防性抗感染处置推荐
6.2.5.2 预处理后的感染防控[34,37]当中性粒细胞绝对数(ANC)<5×10-4/L时(可酌情选择性使用以下治疗):给予粒细胞集落刺激因子(G-CSF)5 μg(kg·d);左氧氟沙星750 mg/d,氟康唑400 mg/d;单纯疱疹/带状疱疹病毒学血清学检测阳性者,持续服用抗病毒药物(如阿昔洛韦800,mg 2/d),直到CAR T细胞回输后3个月;复方新诺明800 mg,2/d(每周2次),从粒缺恢复至CAR T细胞回输后3个月。腹腔高肿瘤负荷预防性处理措施:盐酸小檗碱0.9 g口服3/d;地衣芽孢杆菌胶囊0.25 g口服3/d;生理盐水/甘油灌肠剂250 mL或甘油灌肠剂110 mL灌肠,每晚1次;苯扎氯铵250 mL坐浴,每晚1次。
6.2.5.3 特殊部位感染及处理原则
6.2.5.3.1 皮肤、软组织感染 由于CAR T细胞治疗所致的免疫功能受抑,皮肤及软组织感染多见于以下几种情况:皮肤及软组织局部肿瘤受累伴开放性创面;受累部位局部严重CRS导致的皮肤软组织受损,继发感染,严重者可导致蜂窝织炎甚至危及生命。预防及处理措施:局部开放性创面加强换药,做好创面护理,及时清理坏死组织,保持创面干燥,可局部外用预防性抗感染药物及促进创面愈合敷料;预判可能出现局部严重CRS导致的继发性感染高危患者,参照局部CRS处理原则,预防性使用降低CRS风险相关药物。
6.2.5.3.2 泌尿系统感染 多见于围绝经期或绝经后妇女,由于CAR T细胞治疗所致的免疫功能受抑,泌尿系感染较常规抗肿瘤治疗后更常见,具体预防及处理原则以做好感染预防,如每日坐浴、尿液常规动态监测、及时抗感染治疗为主。
6.2.5.3.3 导管相关性感染 ①导管相关性血流感染:操作人员及患者皮肤表面的表皮葡萄球菌是主要的病原菌来源;常见临床表现有发热、寒战,置管部位红肿、硬结或有脓液渗出等。处理原则:采集血培养+药敏,尽快拔除导管,消毒导管处皮肤,及时更换敷料;血培养结果回报前,可经验性使用广谱抗生素;明确感染病原体后,针对病原体使用药物,监测体温及血压,预防严重感染/感染性休克的发生。②导管相关性尿路感染:CAR T细胞治疗后部分患者可能需要留置尿管,在合并严重CRS及骨髓抑制期间,导管相关性尿路感染风险高,需要做好以下防控原则,如会阴冲洗(每天1~2次),膀胱冲洗(每晚1次),定期更换导尿管,及时监测尿液常规及尿液培养,出现明确的感染指征时积极抗感染治疗。③呼吸机相关肺炎:发生4级CRS和(或)合并感染导致重度呼吸衰竭患者,需气管插管及呼吸机辅助呼吸,此类患者死亡率极高,建议转入呼吸监护室积极治疗。④浆膜腔置管相关性感染:伴胸、腹、心包腔等浆膜腔积液患者,常因压力负荷导致心脏、呼吸功能受抑、严重腹胀以及静脉回流受阻等,需及时进行穿刺置管引流缓解。操作原则参考:保护性隔离状态下,行床旁超声引导下胸腔、腹腔、心包腔置管,定期更换引流袋及接头,穿刺置管部位每日消毒换药,观察创面有无红肿、渗血、渗液,保持局部创面清洁干燥,必要时给予预防性抗感染治疗。
6.3 B细胞缺乏症/低丙种球蛋白血症[38]B细胞缺乏症/低丙种球蛋白血症是CAR T细胞治疗后的特征性不良反应之一,几乎所有接受CAR T细胞治疗患者均会呈现不同程度的B细胞缺乏症,以及由此导致的体液免疫功能不全相关的感染风险,因此,预防性静注人免疫球蛋白输注已成为CAR T细胞治疗后患者的常规辅助治疗手段,具体使用原则如下:B细胞绝对值计算方法:B细胞绝对值=白细胞总数×淋巴细胞%×(CD19+或CD20+)细胞%。
定义/范围:B细胞绝对值<61/μL;IgG≤400 mg/dL。处理策略:替代治疗:静注人免疫球蛋白(5 g×3 d静滴);输注频次:CAR T细胞回输后每月1次,直至B细胞恢复至正常范围或CAR T细胞输注满6个月;高危人群持续每月1次,直至高危因素解除;高危人群:IgG≤4 g/L;严重感染、持续感染或反复感染者;针对高危人群,注意定期监测血清IgG,IgM,IgA及外周血中CD19+或CD20+B细胞数量等。
6.4 肿瘤溶解综合征[39-40]由于肿瘤细胞的大量崩解,释放出其细胞内容物和代谢产物而引起的一组征候群:包括高尿酸血症、高磷酸血症、低钙血症、高钾血症、急性尿酸性肾病等临床表现。诊断标准:血清钾>6 mmol/L;血清钙降低25%;血肌酐>221 μmol/L;尿酸、尿素氮升高25%;可能伴有心律失常。
6.4.3 预防和治疗 预防:针对高肿瘤负荷的患者(病灶SPD≥100 cm2或病灶最大径≥10 cm)或肿瘤增殖活性高(Ki67≥85%),建议预处理前24 h开始水化及碱化治疗,预防性口服别嘌醇片,保持尿液pH值7.0~7.5,必要时使用利尿剂,保证尿量>3 000 mL/d。治疗:持续心电、血压及血氧饱和度监测;静脉补液水化≥3 000 mL/d,保持尿量>3 000 mL/d,必要时使用利尿剂;5%碳酸氢钠125 mL 1~2/d,监测尿液pH值维持在7.0~7.5之间;纠正水、电解质紊乱;口服氢氧化铝凝胶每千克体质量每次50 mg,8 h 1次,抑制肠道磷吸收;出现低钙症状时,葡萄糖酸钙1~2 g+5%葡萄糖注射液100 mL缓慢静滴;出现高钾症状时补碱、利尿;葡萄糖酸钙2 mg/kg+等量5%葡萄糖注射液静滴1~2 h;高渗葡萄糖+胰岛素(促进钾离子进入细胞内)静滴,持续6~12 h;控制尿酸:别嘌呤醇片、苯溴马隆片、非布司他等;血液透析:严重肾功能不全伴电解质紊乱无法纠正时。
6.5 过敏反应[41]CAR T细胞输注相关性过敏反应发生率较低,约为3%,过敏性休克罕见;可能与其他不良反应的伴随症状混淆,如皮疹,多发生于细胞输注后2周内,表现为压之褪色,3~5 d可自行消退,发生原因除过敏外,可能为细胞因子释放导致毛细血管内皮脆性增加,伴或不伴有血小板减少,需结合多项指标综合评判。高敏体质患者为高危人群,致敏因素包括CAR T细胞体外培养试剂;CAR T细胞制备前病毒载体纯度及工艺;回输前患者体内炎性背景未清除导致T细胞激活。其处理原则为入组时排除高敏体质患者;CAR T细胞制备流程、工艺及试剂严格把关;回输前抗感染治疗充分、彻底,消除体内炎性背景;回输前给予预防性使用抗过敏药物,如苯海拉明、异丙嗪等。
6.6 CAR T细胞异常增殖[42]CAR T细胞回输28 d内,监测外周血CAR T细胞体内扩增,当出现外周血白细胞总数≥10×109/L;淋巴细胞百分比≥70%;CAR T细胞绝对值>600 μL情况时,需高度警惕。
6.6.1 外周血CAR T细胞扩增情况监测 CAR T细胞回输后d1,d3,d5,d7,d10,d14,d21,d28采集外周血,监测CAR T细胞体内扩增情况;主要鉴别点:CAR T细胞的扩增程度是否与肿瘤负荷大小一致;是否存在除外周血之外,全身其他部位的CAR T细胞增殖及定植(如皮肤、肺、肝等);是否为病毒体内异常激活导致的增殖失控。
6.6.2 处理原则 糖皮质激素(如甲泼尼龙琥珀酸钠、地塞米松等);其他免疫抑制剂;抑制T细胞功能及活性相关的药物;严重者可酌情2种或2种以上联合应用。
6.7 二次肿瘤[43]流行病学结果 据统计,CAR T细胞治疗后罹患二次肿瘤发生率约为15%,其中MDS发生率约为5%;发生时间为CAR T细胞治疗后>1年;因此早发现、早诊断、早治疗;规律定期复查,如PETCT,骨髓穿刺检查,血常规、乳酸脱氢酶、肿瘤标记物等;表观遗传学药物联合治疗改善预后。

