新型固定床生物反应器在细胞源猪伪狂犬病毒生产中的应用
聂简琪,孙 杨, 杨艳坤,刘秀霞,李 业,白仲虎
(1.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122; 2.江南大学 工业生物技术教育部重点实验室,无锡 214122; 3.江南大学 生物工程学院,无锡 214122)
目前细胞源疫苗已经广泛地应用于疾病的防疫与治疗[1]。随着细胞培养技术在生物制药领域的不断发展,对细胞的需求量越来越大,因而急需发展大规模培养细胞技术。此外,我国国家食品药品监督管理总局对疫苗产品的标准和要求逐渐提高,也对疫苗生产的装置装备提出更高的要求。
固定床生物反应器由于其高单位细胞密度、低剪切力、可低密度接种等优点被广泛地应用于贴壁细胞的培养。目前商业化的固定床反应器主要有CelliGen®篮式反应器(New Brunswick Scientific,USA)、TideCell®潮汐式反应器(CESCO Bioengineering Co.Ltd,Taiwan)和激流式反应器(Amprotein Bioengineering Co.Ltd, China)。篮式反应器采用具有专利的提升桨驱动培养基在罐体内流动,但该提升桨结构复杂[2]。潮汐式反应器与激流式反应器分为培养单元与培养基单元,结构相对复杂。此外,由于固定床中载体对细胞的截留作用,细胞在载体中分布不均匀,无法充分利用载体,因而需要研发结构简单、可无泡通气、细胞分布均匀的新型固定床生物反应器。
伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起的包括猪、牛、羊、犬、家兔等多种家畜和野生动物以发热、奇痒(猪除外)、脑脊髓炎、呼吸和神经系统疾病为主要症状的一种急性传染病[3-5]。感染PRV导致仔猪死亡率增加、生长猪生长迟缓、母猪繁殖障碍等,给全球的养猪业带来严重的经济损失[6-7]。目前疫苗免疫接种是防控PRV的主要方式及有效手段[4, 8]。PRV能够在多种细胞系上进行增殖,目前文献报道的PRV产毒工艺研究主要基于BHK-21细胞与鸡胚成纤维细胞。非洲绿猴肾细胞(Vero细胞)由于其安全性以及可感染多种病毒,是世界卫生组织和《中国药典》认可的用于人用疫苗和动物疫苗生产的细胞系[9]。
针对目前固定床生物反应器的缺点以及Vero细胞生产疫苗的安全性以及高产性,本研究设计了结构简单、可无泡通气的新型固定床生物反应器,并对其性能(混合时间、kLa、细胞分布均匀性、细胞捕获能力)进行了评价,建立了基于该反应器的低密度接种Vero细胞进行PRV病毒扩增的工艺,为PRV疫苗以及其他细胞源疫苗的生产提供新的思路。
1 材料与方法
1.1 细胞与毒株
贴壁依赖型Vero细胞购于ATCC(CCL-81);猪伪狂犬病毒Bathar-K61弱毒株,由浙江诺倍威生物技术有限公司提供。
1.2 主要仪器
Portavo手持校准器(德国Knick公司);CKX31SF倒置显微镜(日本奥林巴斯公司);HERACELL CO2培养箱(美国Thermo公司);L535R离心机(湖南湘仪实验室仪器开发有限公司);BSC-1300IA2生物安全柜(苏州安泰空气技术有限公司);LDZX-50KBS立式压力蒸汽灭菌器(上海申安医疗器械厂);HH-4数显恒温水浴锅(金坛市荣华仪器制造有限公司)。
1.3 主要试剂与耗材
DMEM高糖培养基,美国Hyclone公司;胎牛血清(FBS),以色列Biological Industries公司;胰酶,美国Sigma-Aldrich公司;D-PBS,杭州吉诺生物医药技术有限公司;结晶紫、柠檬酸、NaOH,国药集团化学试剂有限公司。BioNOC II片状载体,CESCO Bioengineering公司;T-175细胞培养瓶,德国Eppendorf公司;96孔细胞培养板,美国Thermo公司。
细胞生长培养基:DMEM高糖培养基添加10%FBS;病毒维持培养基:DMEM高糖培养基添加2%FBS。
1.4 新型固定床生物反应器
潮汐式反应器与激流式反应器主要包括培养单元与培养基单元,两个单元通过硅胶管连接,并以蠕动泵驱动培养基在两个单元中进行循环。该结构相对复杂,且存在硅胶管磨损的风险。篮式反应器采用提升桨驱动培养基流经片状载体,提升桨结构复杂。此外,篮式反应器采用底层通气,会产生大量泡沫,泡沫通过提升桨顶部的消泡腔去除,提升桨与泡腔结构复杂。
新型固定床生物反应器为射流式反应器,由本实验室自主设计。其结构简单,罐体结构设计如图1所示,主要包括玻璃罐体、法兰、固定床模块等3个部分。固定床模块底部的叶轮旋转形成射流,将培养基压入固定床模块中并流经载体,然后从固定床模块顶端溢流并沿外壁回落至玻璃罐体(图1中箭头所示)。液体在固定床外壁形成液膜,通入罐体的气体在该液膜中完成气体交换(“瀑布式”传氧)。该反应器采用表层通气,无泡沫产生。新颖的射流设计与“瀑布式”传氧保证反应器的kLa满足细胞培养所需。
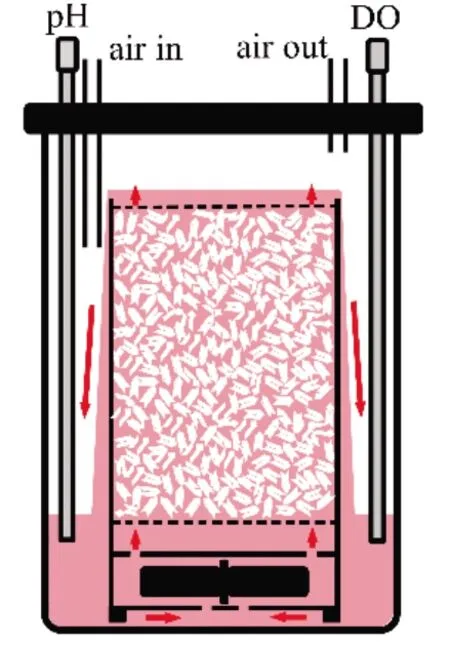
图1 新型固定床生物反应器罐体示意图
1.5 kLa的测定
采用动态法测定反应器在非培养系统条件下kLa[10-11]。在反应器罐体内加入500 mL PBS溶液,并设定转速及空气进气量。通入空气直至DO电极指数恒定,将DO电极校准为100%。停止通空气并立即通入高纯氮气,待DO电极示数为0%(或者示数接近于0%且稳定不变)时,停止通高纯氮气,并立即通入洁净空气,记录DO随时间的变化,待DO电极示数为100%(或示数接近100%并保持稳定不变),停止记录。根据记录数据对固定床反应器的kLa进行衡算。
1.6 混合时间的测定
反应器混合时间的测定参考Xing等[12]的传感器法。在固定床生物反应器罐体内加入PBS,并安置两根pH电极于液面下的两个检测点处,用Portavo手持校准器实时记录两根pH电极的示数。设定所需转速,待pH值计示数稳定不变后,向罐体内迅速加入3 mL的NaOH溶液(4 mol/L),检测溶液pH值随时间变化曲线。混合时间定义为加入碱液后达到95%均质所需的时间,试验重复3次,混合时间取两个检测点的平均值。
1.7 固定床生物反应器中Vero细胞培养
反应器的固定床模块装填11.05 g载体,并在罐体内加入1 L PBS溶液,罐体管线安装好后置于灭菌锅中灭菌,121 ℃灭菌30 min。待回复室温后,用蠕动泵将PBS泵出罐体,将400 mL培养基(DMEM+10% FBS)泵入罐体。按照接种量为0.2×106cells/mL接种Vero细胞,补加培养基至500 mL。将转速设置为580 r/min,温度设置为37 ℃,pH值设置为7.2,DO设置为50%。待细胞贴附于载体(5.5 h)后,将转速设置为1 200 r/min。待培养基中葡萄糖浓度低于1 g/L时,按照每天1.5倍体积的灌流速度进行灌流培养。
1.8 低密度接种Vero细胞生产PRV病毒
反应器中Vero细胞接种量为5×104cells/mL,待细胞生长至第5.5 d后,吸去反应器中旧培养基,并替换为病毒维持培养基。按照MOI=0.001接入毒种,接毒后每天收获培养基并替换为新鲜的病毒维持培养基,利用TCID50方法检测收获培养基中的病毒滴度。
1.9 固定床生物反应器中细胞分布测定
待细胞培养结束后,取出反应器中的固定床模块。分别于顶层、中层、底层等3个高度取样,每个高度选取前、中、后等3个取样点,共计9个取样点,每个取样点分别取10片载体。将片状载体放置于10 mL离心管中,并加入4 mL结晶紫溶液。37 ℃水浴2 h,用移液枪吸吹数次使得载体上细胞充分脱落,将结晶紫溶液适当稀释后用血球计数板进行计数。
1.10 固定床生物反应器中细胞总数测定
待细胞培养结束后,将固定床模块中的片状载体转移至1 L塑料容器中,加入250 mL结晶紫溶液,完全浸泡载体,置于37 ℃中水浴,每隔0.5 h振荡数次。2 h后充分振荡使细胞充分从片状载体上脱落,将结晶紫溶液转移至新的塑料容器中。分别取250 mL PBS溶液冲洗片状载体上残余的细胞,合并2次溶液并充分振荡混匀,适当稀释后采用血球计数板进行计数。
1.11 病毒滴度测定(TCID50)
将样品3 000 r/min离心10 min后取上清,采用TCID50(Tissue culture′s infectious dose,半数组织培养感染剂量)法检测病毒滴度。参考Ru[13]等和Liu等[14]的实验方法,结果以log10TCID50/mL表示。病毒颗粒数为病毒滴度(TCID50/mL)与收获培养基体积(mL)的乘积,累积病毒颗粒数为每天收获病毒颗粒数的累加。
1.12 统计学分析
2 结果与分析
2.1 叶轮的设计及评价
本研究设计了后弯式叶轮、平板式叶轮(部分)、平板式叶轮(完整)等3种桨叶结构(图2),并以磁力棒为对照,对4的射流效果进行分析(图3)。在本研究中,规定液体完全充满固定床模块的腔体而不溢出时所需的叶轮转速称之为溢出临界转速,规定保持稳定射流状态下的叶轮最高转速称之为最大稳定运行速度。磁力棒结构简单,但射流效率较差,最大稳定运行速度为1 300 r/min,此时最大射流量为18.3 mL/s。后弯式叶轮与平板式叶轮的溢出临界转速无显著差异,均为580 r/min。但后弯式叶轮的最大稳定运行速度可达1 450 r/min,最大射流流量可达29.1 mL/s(图3)。通过线性拟合后弯式叶轮转速与射流流量,两者呈线性关系(R2>0.99),即可通过调节转速对射流流量进行调节。综合以上研究结果,固定床模块的叶轮采用后弯式结构。

图2 叶轮设计图
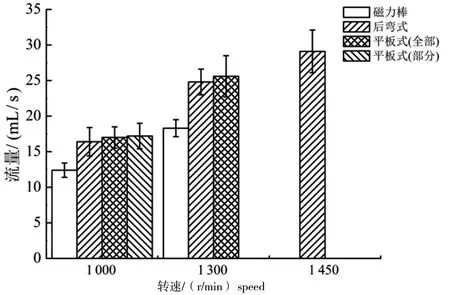
图3 转速与射流流量相关性
2.2 反应器kLa的测定
kLa通常被用来评价反应器提供氧气的能力,也通常被用作规模放大/缩小的准则。Xing等[12]测得用于细胞培养的STR的kLa为2.1~7.6。在通气量为1 vvm的条件下,CelliGen®篮式反应器反应器的kLa可以达到8/h[15]。本研究中反应器的kLa如图4所示,在通气量为1 vvm,转速为1 200 r/min时,新型固定床生物反应器的kLa为7.1/h,与CelliGen®篮式反应器相当。此外,由于本研究的反应器采用无泡通气策略,可通过提高通气量或使用纯氧进一步提高反应器的kLa。
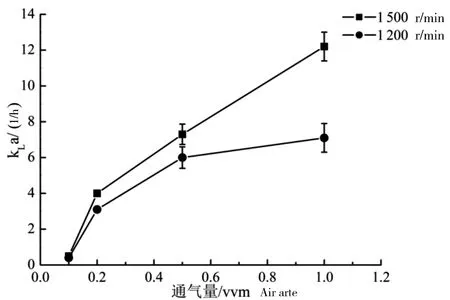
图4 转速与通气量对kLa的影响
2.3 反应器混合时间的测定
为了避免出现浓度或者温度梯度,反应器必须充分混合确保均质性。反应器的混合时间是评价反应器性能的重要参数之一。本研究测定反应器在不同转速下的混合时间,试验结果如图5所示。转速越高,液体混合均匀所需的时间越短。转速为1 000 r/min时混合时间为48 s,转速为1 200 r/min时混合时间为38 s,与STR混合性能相当。
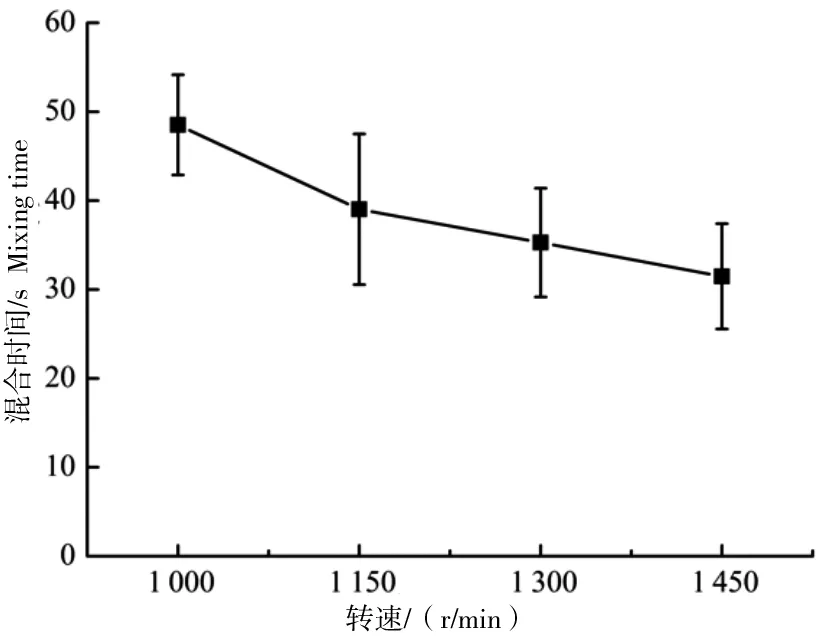
图5 转速对混合时间的影响
2.4 细胞捕获能力
细胞接种至反应器的固定床模块后,细胞通过流体驱动与载体接触,并被载体捕获进而贴附于载体上进行生长。反应器对细胞的捕获能力可以表征反应器对细胞种子的利用率。本研究通过测定培养1 d后固定床中载体的细胞数,用来评价反应器对细胞的捕获能力。结果经过1 d培养,反应器的固定床模块所捕获的细胞密度为0.24×106cells/mL,细胞扩增1.2倍,表明该反应器对细胞捕获性能良好。
2.5 细胞接种位置
为了实现细胞在固定床载体中的均匀分布,本研究探索了细胞接种位置(固定床顶部接种、固定床中部接种、固定床底部接种)对细胞在反应器中分布的影响。经过7 d培养,细胞在载体中的分布如表1所示。当采用顶部接种方案时,顶部的载体贴附的细胞数最高,底部的载体贴附的细胞数最低,这主要是由于种子细胞从固定床模块顶部进入,片状载体对细胞有一定的截留作用。此时固定床底部与顶部的细胞密度差异为1.9倍,在接受范围内。当采用中间接种时,细胞在固定床模块的中部与底部的分布比例增加,细胞密度最大差异为1.9倍,但中间接种会增加罐体操作与使用的复杂性。当采用底部接种时,固定床模块底部的载体贴附的细胞数最高,顶部载体贴附的细胞数最低,细胞密度最大差异2.3倍。综合考虑,采取固定床顶部接种的策略。
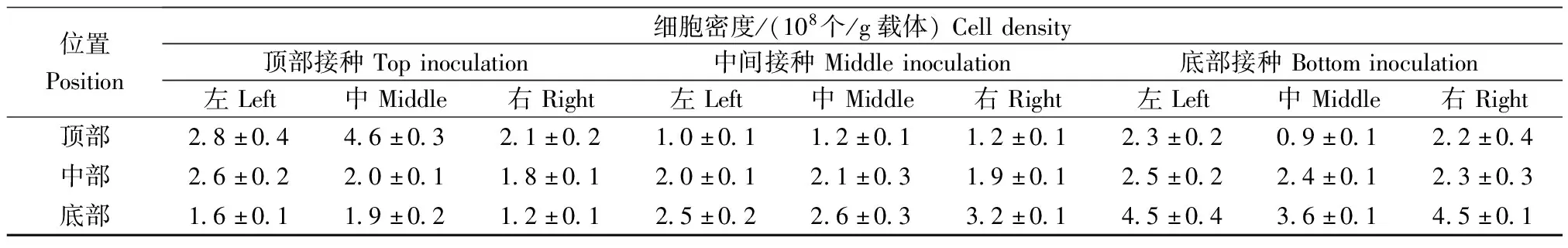
表1 接种位置对细胞在反应器中分布的影响
2.6 低密度接种Vero细胞PRV产毒性能评价
为了验证该新型固定床生物反应在低密度接种下细胞培养性能以及用于病毒扩增的可行性,利用该反应器进行Vero细胞的培养以及PRV病毒的扩增。当采用低密度接种时,Vero细胞仍能够在该固定床反应器中进行良好的扩增。待细胞生长5.5 d后进行接毒,接毒后收获的病毒滴度如图6所示。每日收获的病毒滴度于2 dpi达到最大,为7.5 log10TCID50/mL。接毒5 d后累计收获2.5 L含病毒的培养基,收获病毒的总颗粒数达到10.37 log10TCID50,相当于2.3×105剂量疫苗(每剂量疫苗需要7.5 log10TCID50/mL[16]),为常规细胞密度接种条件下收获病毒总滴度的1.3倍。试验结果表明,在该新型固定床生物反应器中,采用低密度细胞接种进行PRV产毒时仍能获得较高的病毒滴度。
图6 低密度接种的PRV产毒曲线
3 讨论与结论
固定床生物反应器由于低剪切力、可获得较高细胞密度、可低密度接种等优点被广泛地应用于哺乳动物细胞的培养。基于现有固定床生物反应器结构复杂、细胞分布不均等缺点,研发了新型固定床生物反应器。相对于篮式反应器复杂的提升桨结构,该反应器采用结构简单且新颖的“瀑布式”传氧,可实现无泡通气。混合时间、kLa是反应器设计以及反应器规模放大的关键参数[12]。动物细胞培养所需的kLa范围通常在1~25/h[17-18]。本研究测得的该新型固定床生物反应器的kLa在该范围之内,且混合时间与STR相当[19]。结果表明该反应器可以提供良好的氧传递性能以及混合特性,也为规模放大提供了参考数据。
由于Vero细胞生产疫苗的安全性与高产性,Vero细胞广泛地用于人用疫苗以及动物疫苗的生产[9]。本研究进一步验证了该反应器用于低密度接种Vero细胞进行细胞培养以及进行PRV病毒扩增的可行性。当低密度接种Vero细胞时,细胞在反应器中仍生长良好。当进一步进行PRV病毒扩增时,与在常规密度接种条件下收获病毒总颗粒数相当。疫苗生产过程常用的细胞接种密度一般为0.2×106cells/mL(甚至更高)[20],这通常需要利用大量方瓶、滚瓶、细胞工程进行种子链扩增。本研究采用低密度接种进行细胞培养以及病毒扩增,该工艺收获培养基中病毒的滴度为采用BHK 21悬浮细胞的产毒工艺的2.9倍[16]。此外,该工艺将所需种子细胞数缩减4倍,大大简化种子细胞的制备工艺,降低了种子制备过程中人工操作可能引起的污染风险。
本研究在实验室规模(培养体积为500 mL)固定床生物反应器上成功地实现了PRV病毒的扩增,验证了该新型固定床生物反应器用于病毒扩增的可行性。本研究以病毒滴度为指标,后续研究可增加抗原含量、DNA残留等其他参数指标,进而从多尺度评价该反应器用于生产高质量疫苗工艺研发与生产的可行性。本研究为细胞源疫苗的生产提供了新的反应器与方案。

