大熊猫源细小病毒病毒样颗粒的构建与免疫原性
焦翠翠,金宏丽,冯 娜,黄 培,刘 迪,李丽娜,赵 健,王 倩,丁秋雨,杨松涛,夏咸柱,石 晶*,王化磊*
(1.长春西诺生物科技有限公司,吉林 长春130012;2.吉林大学 动物医学学院/人兽共患病研究教育部重点实验室,吉林 长春130062;3.军事科学院 军事医学研究院 军事兽医研究所/吉林省人兽共患病预防与控制重点实验室,吉林 长春130122)
肉食动物细小病毒属于细小病毒科,细小病毒属,包括猫泛白细胞减少症病毒(feline panleukopenia virus,FPV)、犬细小病毒(canine parvovirus,CPV)、水貂肠炎病毒(mink enteritis virus,MEV)等,可感染犬科、猫科、鼬科、灵猫科、浣熊科等多种家养、圈养、经济和野生动物,对动物健康和行业发展构成了严重威胁[1-4]。在我国,家养动物和野生动物均有细小病毒相关疫病流行的报道[5-8]。邬捷等[7]对成都、重庆两地动物园的大熊猫进行血清学调查,在其血清内检出抗体,阳性率达50%,首次证实大熊猫能够自然感染细小病毒。2012年梁萌[8]对大熊猫中分离的细小病毒基因序列进行遗传进化分析,发现病毒VP2基因10个关键氨基酸位点有3个氨基酸位点与CPV一致,其余位点与FPV一致。细小病毒为单股无囊膜的DNA病毒,病毒粒子呈对称的二十面体结构[9],基因组包括2个开放阅读框,分别编码非结构蛋白(NS1,NS2)以及结构蛋白(VP1,VP2,VP3)[9]。其中VP2蛋白包含刺激机体产生中和抗体的主要抗原表位[10],VP2关键氨基酸位点的突变可以改变其抗原特性和宿主范围[11]。
疫苗免疫是预防传染病的最主要措施,对于大熊猫等珍稀濒危野生动物,疫苗的安全性尤为重要。当前,针对细小病毒病的疫苗主要包括减毒活疫苗和灭活疫苗,减毒活疫苗存在毒力返强的风险,全病毒灭活疫苗可能存在病毒灭活不彻底的危险[12]。安全、高效的基因工程亚单位疫苗是大熊猫等珍稀濒危野生动物疫苗研究的发展方向。病毒样颗粒(virus-like particles,VLPs)是由病毒的一个或者多个结构蛋白组装成的天然病毒粒子[13]。VLPs形态上与天然病毒相似,但不含病毒的基因组,无复制能力,所以不具有感染性,安全性更高。与传统疫苗相比,VLPs更容易被免疫系统识别,引起体液和细胞免疫反应[14]。本研究选用大熊猫源细小病毒的VP2基因,利用昆虫细胞/杆状病毒表达系统构建表达VP2蛋白的重组杆状病毒,重组病毒感染昆虫细胞使其成功组装成VLPs,为大熊猫细小病毒病新型疫苗的研制提供前期基础和技术支持。
1 材料与方法
1.1 主要试剂DH10Bac、DH5α感受态,供体质粒pFastBac Dual以及Sf9细胞均由长春西诺生物科技有限公司保存;高保真DNA聚合酶购自全式金公司;限制性核酸内切酶、T4DNA连接酶、DNA Marker、蛋白质Marker购自宝生物工程(大连)有限公司;Cellfectin Ⅱ Reagent转染试剂购自Thermo公司;硝酸纤维素膜(NC膜)购自GE公司;HRP标记的羊抗鼠IgG、FITC标记的羊抗鼠IgG、BSA购于北京索莱宝科技有限公司;鼠抗犬细小病毒VP2蛋白单克隆抗体由吉林大学人兽共患病研究教育部重点实验室制备。
1.2 VP2基因的引物设计及PCR扩增参考大熊猫源细小病毒的VP2基因序列,根据昆虫细胞密码子偏爱性进行序列优化并合成。利用Primer Premier 5.0软件对优化后的VP2序列设计引物,引物序列见表1。质粒序列优化、合成,引物合成均由上海生物工程有限公司完成。以合成的质粒为模板,利用表1中的引物分别进行PCR扩增。反应体系:ddH2O 32 μL,5×PCR缓冲液10 μL,模板1 μL,上、下游引物(20 μmol/L)各1 μL,高保真DNA聚合酶1 μL,2.5 mmol/L dNTP 4 μL,共50 μL。反应条件:95℃预变性2 min;95℃ 20 s,55℃ 30 s,72℃ 1 min,共35个循环;72℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳,回收目的基因。

表1 引物序列及产物长度
1.3 重组供体质粒及穿梭质粒的构建将PH-FPV-VP2、P10-FPV-VP2 PCR产物分别通过相应酶切位点连入供体质粒pFastBac Dual中,构建含有双拷贝VP2基因的重组供体质粒pFBD-Panda-dVP2。将鉴定正确的pFBD-Panda-dVP2转化DH10Bac感受态,37℃培养48 h,在含四环素、庆大霉素和卡那霉素的平板蓝白斑筛选后,挑取白色菌落,提取重组杆状病毒质粒并对其进行PCR鉴定,鉴定引物见表2,将鉴定正确的质粒命名为rBacmid-Panda-dVP2。

表2 重组杆状病毒质粒鉴定引物序列及产物长度
1.4 重组杆状病毒的拯救利用Cellfectin Ⅱ Reagent转染试剂将rBacmid-Panda-dVP2转染Sf9细胞,27℃培养72 h后出现细胞病变,收集细胞上清,获得重组杆状病毒rpFBD-Panda-dVP2。将rpFBD-Panda-dVP2进行连续传代,毒种于-80℃保存备用。
1.5 间接免疫荧光鉴定将rpFBD-Panda-dVP2以MOI=0.5接种已长成单层的Sf9细胞(24孔板),并设立正常细胞对照,于27℃培养48 h后,用70%冷乙醇室温固定30 min,以细小病毒VP2单克隆抗体(1∶400倍稀释)为一抗,FITC标记羊抗鼠IgG(1∶200倍稀释)为二抗进行染色,同时加入伊文思蓝(1∶300倍稀释),于荧光显微镜下观察荧光结果。
1.6 SDS-PAGE及Western blot检测将rpFBD-Panda-dVP2以MOI=0.5接种悬浮培养的Sf9细胞,96 h后收获混合物。将收获的混合物,3 000 r/min离心30 min分离细胞和上清,细胞加入25 mmol/L NaHCO3裂解后,离心收获上清,加入5×Loading Buffer,制备上样产物,进行SDS-PAGE电泳鉴定。
将上样产物经SDS-PAGE电泳,转膜至NC膜,以细小病毒VP2单克隆抗体为一抗(1∶500倍稀释),HRP标记的羊抗鼠IgG(1∶5 000倍稀释)为二抗进行Western blot分析。
1.7 电镜观察将1.6中经NaHCO3裂解后的细胞上清中滴加饱和(NH4)2SO4至终浓度为20%,轻轻摇匀,置冰上30 min后,12 000 ×g离心30 min,收获沉淀,用饱和EDTA重悬沉淀,进行蔗糖密度梯度(35%,45%,55%,65%)38 000 r/min离心2 h[15]。将蛋白条带使用PBS重悬,在45 000 r/min离心2 h去蔗糖,获得的沉淀用少量PBS重悬,用电子显微镜观察Panda-VLPs形态大小。
1.8 血凝检测在V型血凝板中,使用15 mmol/L pH6.5 PBS将混合物进行2倍倍比稀释,每孔再加入50 μL 1%猪红细胞悬液(含0.5%兔血清),4℃静置1 h后,判定样品的血凝效价。
1.9 动物免疫试验将1.6中处理后上清液进行稀释,使其血凝效价为1∶211,与Gel 02佐剂等体积乳化,皮下注射免疫10周龄猫,1 mL/只,5只/组。首免后2周加强免疫1次。首次免疫后2,4,5,6周及2,3,4,5,6,7,8,9,10,12月进行采血,分离血清,通过HI试验检测血清中细小病毒抗体水平。方法如下:在V型血凝板中,使用15 mmol/L pH6.5 PBS将血清进行2倍倍比稀释,每孔加入8个血凝单位的Panda-VLPs抗原(25 μL),在37℃温箱孵育1 h,每孔再加入50 μL 1%猪红细胞悬液(含0.5%兔血清),4℃静置1 h后,判定结果。
2 结果
2.1 转移载体的构建将扩增的两段目的基因(PH-FPV-VP2、P10-FPV-VP2 PCR产物)分别克隆至供体质粒pFastBac Dual PH启动子和P10启动子下游,经NotⅠ/HindⅢ和XhoⅠ/KpnⅠ双酶切鉴定(图1),证明含有双拷贝VP2基因的转移载体pFBD-Panda-dVP2构建成功。

M.DL15000 DNA Marker;1.NotⅠ/HindⅢ酶切pFBD-Panda-dVP2;2.XhoⅠ/KpnⅠ酶切pFBD-Panda-dVP2
2.2 重组杆粒rBacmid-Panda-dVP2的构建与鉴定将鉴定正确的pFBD-Panda-dVP2转化至DH10Bac感受态,筛选获得携带双拷贝VP2基因的重组杆状病毒质粒rBacmid-Panda-dVP2;以p10F/p10R、pHF/pHF两对引物对rBacmid-Panda-dVP2进行鉴定,可分别扩增出长度约为3 727,2 578 bp的产物,与理论值相符,表明rBacmid-Panda-dVP2构建成功(图2)。

M.DL15000 DNA Marker;1.p10F/p10R引物鉴定;2.pHF/pHF引物鉴定
2.3 重组杆状病毒的拯救与鉴定将rBacmid-Panda-dVP2转染Sf9细胞,27℃培养72 h后出现细胞病变,即细胞变大、变圆、脱落。待细胞病变达80%左右时,收集上清获得P1代重组杆状病毒,提取基因组,经PCR鉴定正确,命名为rpFBD-Panda-dVP2。将P1代rpFBD-Panda-dVP2连续传代,扩增至第3代,rpFBD-Panda-dVP2感染Sf9细胞48 h后可见明显细胞病变(图3)。
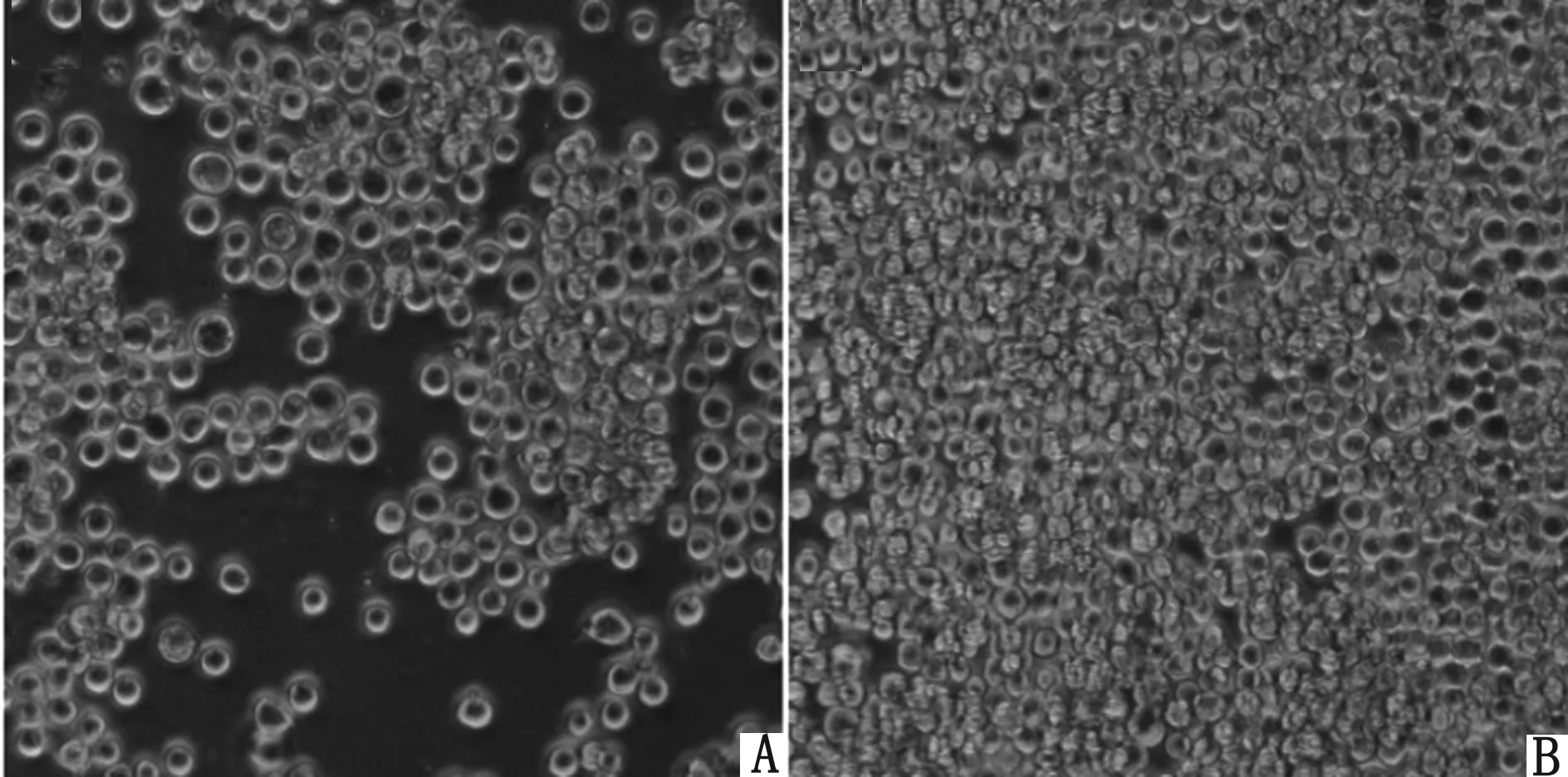
A.rpFBD-dVP2感染后的Sf9细胞;B.正常细胞
2.3.1间接免疫荧光鉴定 间接免疫荧光鉴定结果显示,重组杆状病毒rpFBD-Panda-dVP2感染的Sf9细胞可见明显绿色荧光(图4A),正常Sf9细胞(图4B)则未见特异性荧光反应,仅见到红色细胞背景;表明VP2蛋白在细胞中得以表达,且目的蛋白可被VP2单克隆抗体特异性识别。

A.重组杆状病毒感染的Sf9细胞;B.正常Sf9细胞
2.3.2SDS-PAGE鉴定 利用SDS-PAGE对VP2蛋白的表达情况进行鉴定,结果可见在65 kDa有明显目的条带,表明rpFBD-Panda-dVP2感染Sf9细胞后可成功表达VP2蛋白,且感染细胞经NaHCO3溶液处理后可获得较单一的目的条带(图5)。

M.蛋白Marker;1.正常Sf9细胞;2.Panda-VLPs经NaHCO3处理后上清液
2.3.3Western blot鉴定 以鼠抗犬细小病毒VP2单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗进行Western blot分析,结果显示,目的蛋白可与细小病毒VP2单克隆抗体特异性结合,在相对分子质量约65 kDa处可见目的蛋白条带(图6)。
2.3.4电镜观察 将重组病毒rpFBD-Panda-dVP2感染Sf9细胞混合物和纯化后的Panda-VLPs经电子显微镜观察,结果表明重组病毒感染Sf9细胞后可成功包装形成病毒样粒子,其形态与天然细小病毒粒子相似,大小约为22 nm(图7)。

M.蛋白Marker;1.rpFBD-Panda-dVP2感染的Sf9细胞;2.正常Sf9细胞

A.混合物;B.纯化后的Panda-VLPs
2.3.5血凝检测 将 rpFBD-Panda-dVP2感染细胞混合物进行血凝效价检测,结果显示,收获的VLPs可成功凝集猪红细胞,其血凝效价达1∶215(图8)。

图8 血凝效价检测
2.4 动物免疫结果将Panda-VLPs辅以Gel 02佐剂后免疫幼猫,对免疫后不同时间的猫血清进行HI效价测定,结果显示,首次免疫后2周,免疫猫体内即可产生抗细小病毒HI抗体;加强免疫后,HI抗体迅速升高,之后抗体水平基本稳定,效价持续在1∶27~1∶28之间,首免后12个月仍能检测到HI抗体(图9);结果说明制备的VLPs可以有效刺激机体产生免疫反应,具有良好的免疫效果。

图9 猫免疫Panda-FPV-VLPs后血清HI抗体效价检测
3 讨论
细小病毒粒子由60个蛋白亚基组成,其中VP2蛋白亚基约占50个,是构成衣壳蛋白的主要成分[16]。VP2蛋白包含主要的保护性抗原位点,可诱导机体产生良好的免疫反应,是疫苗研制的主要靶抗原。杨松涛等[17]以犬2型腺病毒(canine adenovirus,CAV-2)为载体构建了能表达FPV VP2蛋白的重组病毒,动物试验结果表明,该重组病毒可以有效诱导猫产生抗FPV和CAV-2的抗体。此外,细小病毒VP2蛋白可在体外自主包装形成VLPs,具有血凝活性。BROWN等[18]利用杆状病毒-昆虫细胞表达系统表达人细小病毒VP2蛋白,发现其可以单独组装成类似于病毒的空衣壳。吕建强等[19]证明猪细小病毒(porcine parvovirus,PPV)VP2蛋白可以体外自行组装成PPV VLPs,大小形态与活病毒相似。科研人员利用不同表达系统表达犬细小病毒(CPV) VP2蛋白,均可以获得CPV VLPs,且免疫效果良好[20-22]。本研究选用大熊猫源细小病毒的VP2基因,通过昆虫细胞/杆状病毒表达系统表达VP2蛋白,经过间接免疫荧光、SDS-PAGE、Western blot鉴定,均表明VP2蛋白获得成功表达,同时电镜观察结果证实体外表达的VP2蛋白可自主组装成VLPs,空间结构与天然细小病毒相似,且组装的VLPs具有较高的血凝活性。通常HI试验被认为是细小病毒抗体检测的金标准[23-25]。本研究将制备的VLPs免疫幼猫后,可有效刺激机体产生抗细小病毒HI抗体,免疫两次可使机体内的HI抗体水平维持在1∶40以上至少12个月。不同动物源细小病毒刺激机体产生的抗体水平和保护能力存在差异。有文献表明,猫体内的HI抗体水平大于1∶40即可达到保护效果[26],犬体内产生的CPV HI抗体水平大于1∶80可起到保护效果[27],水貂体内产生的HI抗体水平大于1∶32即可抵抗MEV的攻击[28]。
CPV、FPV、MEV VP2蛋白具有相同的抗原成分,在血清学上具有交叉反应。STRASSHEIM等[29]研究发现针对CPV的单克隆抗体可同时识别CPV、FPV和MEV。本研究通过Western blot和间接免疫荧光验证发现,大熊猫源细小病毒VP2蛋白同样可被抗CPV VP2蛋白单克隆抗体识别,表明大熊猫源细小病毒VP2蛋白与CPV VP2蛋白具有相同的抗原决定簇。尽管CPV、FPV和MEV的VP2蛋白之间存在交叉保护性,但利用特异性的单克隆抗体仍能显示其抗原差异性[30]。对影响宿主范围、生物特性的VP2蛋白关键氨基酸位点分析发现,除第101位氨基酸与CPV参考序列一致外,大熊猫源细小病毒VP2蛋白的其余关键氨基酸位点均与FPV参考序列一致,因此根据分离的大熊猫源细小病毒VP2蛋白进行大熊猫细小病毒病新型基因工程疫苗的研制,相比其他毒株更具代表性。
疾病死亡是导致我国大熊猫数量减少、种族濒危的主要原因,其中细小病毒病的病死率较高,也可能导致其他疾病的继发感染。疫苗免疫是预防传染病的最主要措施,对于大熊猫等珍稀濒危野生动物,疫苗安全性尤为重要。当前,针对细小病毒病的疫苗主要包括减毒活疫苗和灭活疫苗,减毒活疫苗存在毒力返强的风险,全病毒灭活疫苗可能存在病毒灭活不彻底的危险[12]。本研究通过表达大熊猫源细小病毒VP2蛋白,体外组装成与天然病毒粒子形态结构相似的VLPs,由于VLPs不含病毒核酸,具有更高的安全性。此外,VLPs免疫动物后可刺激机体产生良好的免疫反应。大熊猫源细小病毒VLPs的制备为大熊猫细小病毒病新型基因工程亚单位疫苗的创制提供了安全、高效的免疫原,为该疫苗的后期研究和开发奠定前期基础,同时为珍稀濒危野生动物新型疫苗的创制提供研究思路。

