利血平对化脓隐秘杆菌大环内酯类外排基因mefA表达的影响
苏鸿雨,黄程程,刘耀川,陈梦涵,朱晓明,刘利鹏,张德显,刘明春
(沈阳农业大学 畜牧兽医学院, 辽宁 沈阳 110866)
化脓隐秘杆菌(Trueperellapyogenes,T.pyogenes)是一种条件性致病菌,可黏附于动物的乳房、泌尿生殖道、呼吸道等部位,引起猪、牛、羊等动物的乳房炎、子宫内膜炎等化脓性感染,给养殖业带来较大的经济损失[1-3]。由于缺乏有效的疫苗,到目前为止,T.pyogenes引起的感染主要依靠使用抗菌药物来进行治疗。但随着抗菌药物的广泛使用,有关T.pyogenes耐药性的报道越来越多,尤其是对临床常用的大环内酯类和四环素类抗生素的耐药问题,已引起人们的关注[4-6]。存在于细菌细胞膜上的外排蛋白的外排作用,可以使药物在细菌细胞内的聚集减少,从而使细菌逃避药物的抑杀作用,该机制被普遍认为是细菌产生耐药性的重要方式之一。外排基因mefA可介导革兰阳性菌如金黄色葡萄球菌、链球菌对大环内酯类药物的耐药性。在对大环丙酯类抗生素耐药的肺炎链球菌中,外排基因mefA的检出率为20.5%[7]。而有关T.pyogenes耐药机制的研究报道较少。本课题组前期研究发现,对大环丙酯类抗生素产生耐药的T.pyogenes分离株中,mefA基因的检出率为18.2%[8]。MefA蛋白的外排作用可能是介导该菌对大环内酯类抗生素耐药的主要机制之一。外排泵抑制剂可以通过抑制外排基因的表达来逆转/消减耐药菌株的耐药性,有望成为抗耐药菌新药研发的主要策略[9]。
利血平是一种公认的外排泵抑制剂,可逆转大肠杆菌、金黄色葡萄球菌等细菌对氟喹诺酮类、四环素类等多种抗生素的耐药性[10-12]。但尚未见有关利血平对T.pyogenes外排蛋白外排作用影响的相关报道。本试验通过检测利血平作用后T.pyogenes对大环内酯类药物的耐药表型、外排基因mRNA表达水平及其编码蛋白表达水平的变化情况,分析T.pyogenes对大环内酯类药物耐药的主动外排机制,以期为深入研究T.pyogenes的耐药机制及寻找抗耐药菌药物作用的新靶标奠定理论基础。
1 材料与方法
1.1 试验菌株与药物2株携带mefA(17,20号)基因的T.pyogenes,由本实验室分离鉴定并保存;利血平标准品购自成都曼斯特生物科技有限责任公司;乙酰螺旋霉素标准品购自大连美仑生物有限责任公司;红霉素、罗红霉素、替米考星、阿奇霉素及泰乐菌素标准品购自中国兽医药品监察所;2×Easy Taq PCR SuperMix、RNA Disslution、TransScrip ALL-in-One First-Strand cDNA Synthesis SuperMix for qPCR均购自大连宝生物工程有限公司;一抗(自制兔抗T.pyogenesMefA蛋白多克隆抗体,效价为1∶64 000);二抗(HRP标记的山羊抗兔IgG多克隆抗体)北京百奥莱博科技有限公司;荧光定量PCR仪购自ABI公司。
1.2 利血平逆转T.pyogenes对大环内酯类抗生素耐药性试验采用微量肉汤稀释法分别测定红霉素(erythromycin)、罗红霉素(roxithromycinid)、乙酰螺旋霉素(acetylspiramycin)、泰乐菌素(tylosin)、阿奇霉素(azithromycin)和替米考星(tilmicosin)6种大环内酯类抗生素及外排泵抑制剂利血平对2株携带携带mefA基因的T.pyogenes的最小抑菌浓度(MIC),每种药物进行3个平行,同时以ATCC 19411即T.pyogenes标准菌株为质控菌[13]。
根据利血平对T.pyogenesMIC的测定结果,将利血平稀释成对应菌株的1/2,1/4,1/8,1/16 MIC作为工作浓度,测定大环内酯类抗生素对亚抑菌浓度利血平作用后的各菌株的MIC值,分析利血平作用前后T.pyogenes对抗生素耐药性的变化情况,并确定各菌株恢复对抗生素敏感性的最佳作用条件,用于后续试验。
1.3 荧光定量PCR引物的设计与合成选择GenBank中收录的T.pyogenes16S rRNA作为实时荧光定量PCR试验的内参基因(KY694370.1)。根据mefA基因序列的测序结果,分别设计mefA和16S rRNA的荧光定量PCR引物,将设计完成的引物序列提交到生工生物官方网站上进行合成[14]。引物信息详见1。
1.4 利血平作用前后T.pyogenes总RNA的提取分别取药物作用前和1/2 MIC利血平作用36 h的T.pyogenes菌液,按照说明书采用Trizol法提取T.pyogenes的总RNA。利用分光光度计检测总RNA浓度和纯度,使用琼脂糖凝胶电泳检测RNA的完整性。最后利用RNA反转录试剂盒将RNA反转录成cDNA[15],于-80℃保存备用。
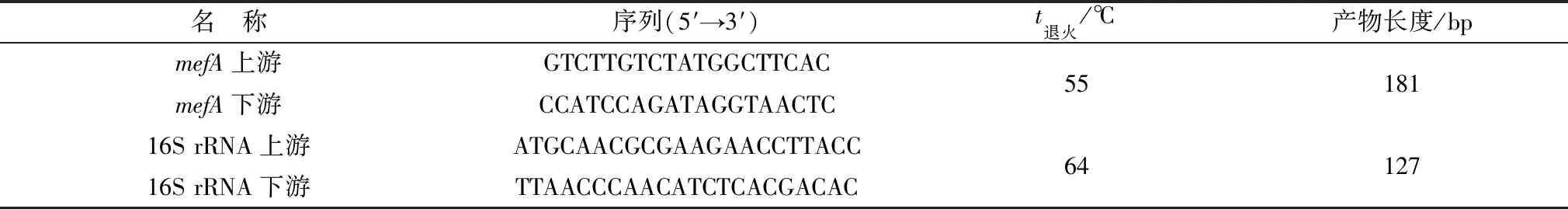
表1 mefA和16S rRNA基因引物序列
1.5 利血平作用前后菌株的mefAmRNA表达量的检测以利血平作用前后菌株的cDNA为模板,以荧光定量PCR的引物为特异性引物,采用实时荧光定量PCR方法进行扩增,建立标准曲线。以标准曲线判断荧光定量PCR引物的扩增效率,当目的基因与内参基因的扩增效率几乎一致,而且都接近于100%时,计算目的基因mRNA的相对转录水平[16]。
1.6 利血平作用前后菌株的MefA蛋白表达水平的检测分别取利血平作用前后的T.pyogenes菌液,采用溶菌酶破壁、超声处理的方法提取其总蛋白;用BCA法测定蛋白质的含量,加入Loading Buffer,98℃变性10 min,进行SDS-PAGE;将蛋白湿转印至PVDF膜上,脱脂奶粉4℃封闭。BSA 4℃一抗过夜孵育,37℃二抗孵育1.5 h,最后曝光检测[17]。
1.7 数据处理与分析按文献[18]的方法,基因转录水平相对表达倍数计算结果为2-△△Ct。利用Azure Biosystems软件对蛋白灰度值进行分析。
使用SPSS 17.0软件对利血平作用前后目的基因mefA的mRNA表达量及MefA蛋白表达量的差异显著性进行分析。使用GraphPad Prism 5.0对处理后的数据进行作图分析。
2 结果
2.1 利血平逆转T.pyogenes耐药性的检测结果见表2。利血平对17和20号T.pyogenes的MIC值均为32 mg/L。亚抑菌浓度利血平作用T.pyogenes后,筛选出利血平逆转T.pyogenes耐药性的最佳条件为1/2 MIC作用36 h。依据各药对T.pyogenesATCC19411的MIC值,判定T.pyogenes对罗红霉素、乙酰螺旋霉素、替米考星、泰乐菌素、阿奇霉素和红霉素的耐药临界点分别为2,1,8,2,4,1 mg/L。据此判断,利血平作用后的17号和20号菌株对替米考星和阿奇霉素均由耐药转为敏感。利血平作用后6种大环内酯类抗生素对携带mefA基因的17号T.pyogenes的MIC值下降到利血平作用前的 1/4~1/32,而20号菌株的MIC值下降到利血平作用前的1/2~1/8。
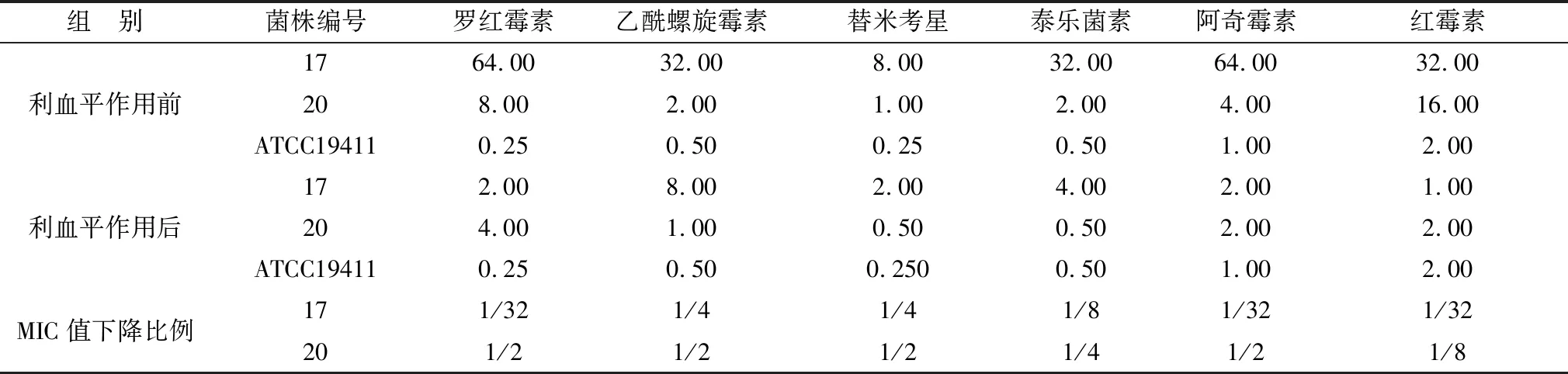
表2 1/2 MIC利血平作用前后T.pyogenes对大环内酯类抗生素的MIC值 mg/L
2.2 利血平作用后T.pyogenes外排基因mefAmRNA表达水平的变化利血平作用后T.pyogenes外排基因mefAmRNA相对表达量变化情况如图1所示。设利血平处理前T.pyogenesmefA基因mRNA相对表达量为1,1/2 MIC利血平作用耐大环内酯类药物分离株36 h后, 2株分离株mefA基因mRNA表达水平(利血平作用前是作用后的5.18,17.54倍)均极显著降低(P<0.01),而溶剂对T.pyogenesmefA基因mRNA的相对表达水平无显著性影响。
2.3 利血平作用后T.pyogenes外排蛋白MefA表达水平的变化采用Western blot技术检测外排蛋白MefA的表达量,设利血平作用前T.pyogenes的MefA表达量为1,利血平作用前后T.pyogenesMefA的表达量及其变化情况如图2,3所示。1/2 MIC利血平作用耐药菌株36 h后,外排蛋白MefA较药物作用前也分别显著降低(利血平作用前是作用后的1.08,1.70倍)。

图1 利血平作用前后T.pyogenes mefA mRNA的转录水平(**P<0.01,下同)
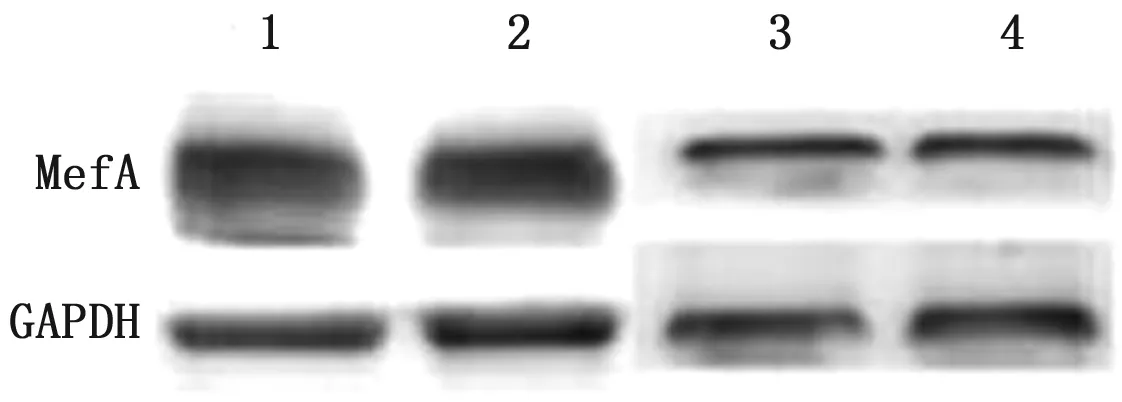
1,2.利血平作用前17,20号T.pyogenes分离株;3,4.利血平作用后17,20号T.pyogenes分离株
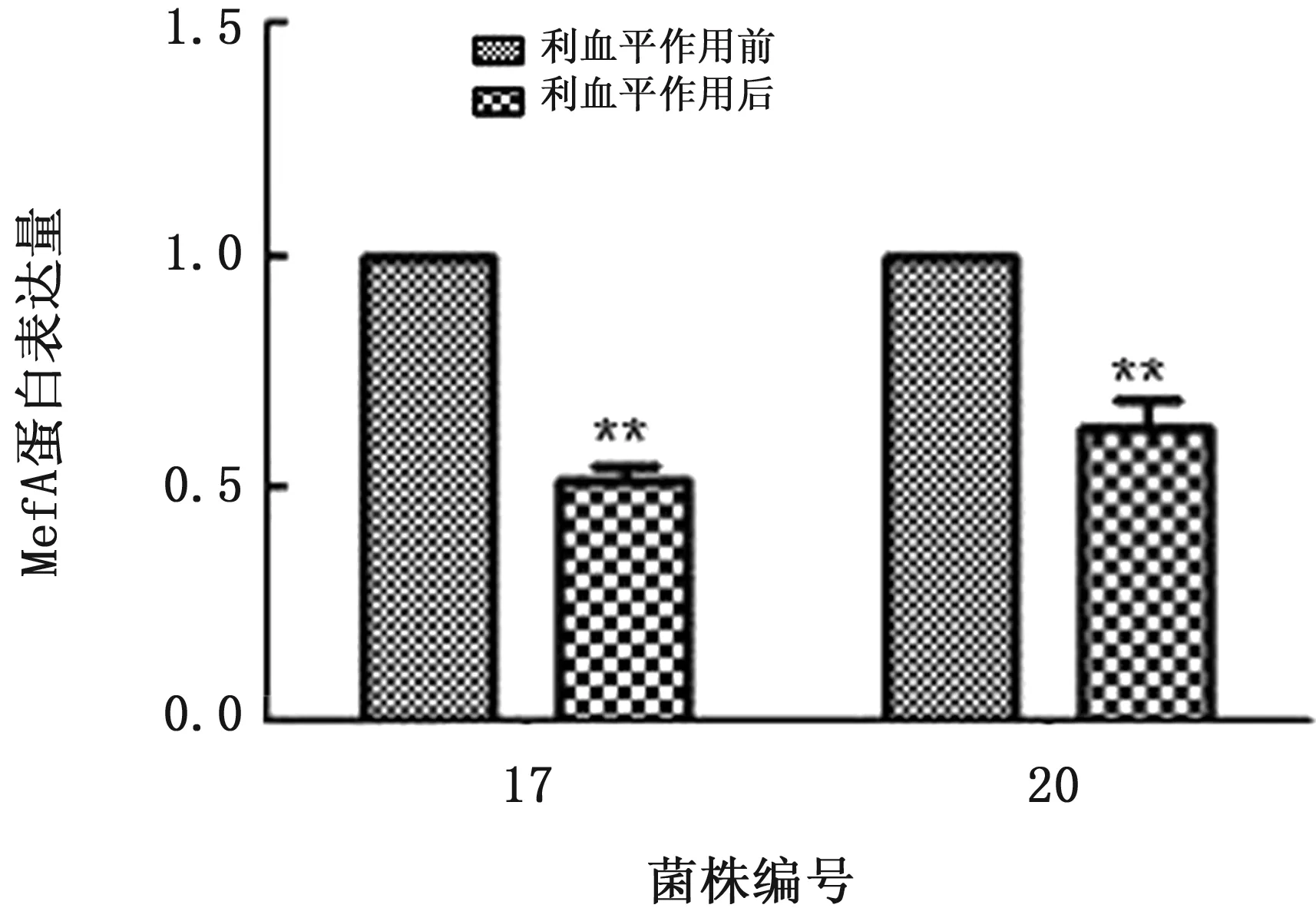
图3 利血平对T.pyogenes外排蛋白MefA表达量的影响
3 讨论
T.pyogenes可引起牛、羊、猪等多种经济类动物的化脓性感染,给养殖业带来了较大的经济损失。目前临床上治疗T.pyogenes感染性疾病的药物主要有大环内酯类、头孢菌素类和四环素类等抗生素[19]。但是由于大环内酯类抗生素在畜牧行业的应用极其广泛,导致T.pyogenes对该类抗生素产生了严重的耐药性,因此开展与耐药机制相关的研究、研发新药已经成为当前研究的热点[20]。据报道,介导T.pyogenes对大环内酯类药物耐药的外排基因有msr和mef等,由它们编码的膜蛋白能够将进入菌体内的大环内酯类药物外排,从而使抗生素的药效降低甚至失效[21]。本课题组前期研究发现,耐大环内酯类药物的T.pyogenes分离株中外排基因mefA的检出率为18.2%,且携带mefA基因的菌株对大环内酯类抗生素存在多重药耐现象[22]。
外排泵抑制剂是一类具有抑制细菌外排泵作用的物质,可通过抑制外排基因的转录和翻译来逆转或消减细菌的耐药性。据相关文献报道,外排泵抑制剂氢氯苯腙(CCCP)可以抑制鲍曼不动杆菌(Acinetobacterbaumannii)外排基因adeB的表达;奥美拉唑(omeprazole)可以抑制金黄色葡萄球菌(Staphylococcusaureus)NorA的表达量[22-23]。与耐药相关的外排泵Bmr的氨基酸序列中缬氨酸和苯丙氨酸能够与公认的外排泵抑制剂利血平结合,从而抑制枯草芽孢杆菌(Bacillussubtilis)向外泵出药物;还可以抑制金黄色葡萄球菌耐药泵NorA的活性,提高耐诺氟沙星菌株对其的敏感性[24-26]。
到目前为止,有关外排泵抑制剂利血平对细菌耐药基因及耐药蛋白的影响鲜有报道。本试验主要从利血平作用前后2株携带mefA基因的T.pyogenes的耐药性变化情况、外排基因及其编码蛋白表达水平的变化情况,探究利血平对T.pyogenes外排基因mefA的影响。研究发现,1/2MIC 利血平作用菌体 36 h 后,T.pyogenes对大环内酯类抗生素的耐药性明显降低,甚至逆转了菌株对替米考星和阿奇霉素的耐药性;利血平亦显著抑制了外排基因mefA的mRNA转录水平及其编码蛋白MefA的表达水平。提示利血平可能是通过影响外排蛋白MefA的表达减少菌体对大环内酯类药物的外排作用,从而消减了T.pyogenes对大环内酯类抗生素的耐药性。但由于携带mefA基因的菌株数量较少,尚需进一步验证。

