抗肿瘤药物FTY720对p53依赖的基因转录调控
姚 涵,徐文彬,王冬来
(中国医学科学院基础医学研究所 北京协和医学院基础学院 医学遗传学系,北京 100005)
TP53(tumor protein p53)作为一个抑癌基因通过编码转录因子p53发挥抑癌作用。当DNA受到各种类型的损伤时,p53被激活,通过调控细胞生物学过程,促进细胞的存活,抑制细胞的恶性转化[1],常被称为“基因组卫士”(genome guardian)[2]。几乎所有的人类肿瘤中均存在p53信号通路的异常,而50%的恶性肿瘤中也存在p53的突变[3],所以p53突变在肿瘤发生发展中起着重要的作用。Fingolimod又称为FTY720,是一种FDA批准的神经氨酸类似物[4],具有抗肿瘤特性。一方面,FTY720可通过破坏SET-PP2Ac(PP2A catalgtic subunit)之间的相互作用来重新激活PP2A(protein phosphatase 2A)磷酸酶活性,发挥抗癌作用[5]。另一方面,FTY720也可通过影响SET/PP2Ac-Myc/NDRG1/Snail信号通路,抑制上皮间质转化(epithelial-mesenchymal transition,EMT)过程[5],从而抑制肿瘤细胞的转移。基于p53和FTY720在肿瘤发生发展过程中均起着重要的抑癌作用,且FTY720作为一种抗肿瘤药物,其抗肿瘤的分子机制尚不完全清楚。本研究拟通过CRISPR/Cas9技术构建内源性p53缺失的骨肉瘤U2OS细胞株(U2OS CRISPR p53 knockout,U2OS CRISPR p53 KO),并通过全转录组测序(RNA-sequencing,RNA-seq)的方法,分析FTY720是否调控p53依赖的基因表达谱及相应的细胞生物学功能。
1 材料与方法
1.1 材料
1.1.1 细胞:人源骨肉瘤细胞系U2OS[中国医学科学院基础医学研究所细胞资源中心(国家生物医学实验细胞资源库)]。
1.1.2 试剂及试剂盒:胎牛血清(Gibco公司);DMEM培养基[康宁(上海)管理有限公司];FTY720(Cayman Chemical公司);Trizol®试剂、SuperScriptTMⅣ VILOTMMaster Mix和ECL(Invitrogen公司);氯仿、异丙醇和异丙醇(国药集团化学试剂有限公司);RT-qPCR试剂盒(天根生化科技有限公司);NP40缓冲液(50 mmol/L Tris-HCl pH 8.0,150 mmol/L NaCl,1% NP40,1×蛋白酶抑制剂)、脱脂牛奶溶解在TBST缓冲液(20 mmol/L Tris-HCl pH 7.6,137 mmol/L NaCl,0.05 % Triton X-100)(Sigma-Aldrich公司)。
1.2 方法
1.2.1 细胞的分组及干预处理:利用CRISPR/Cas9技术转染sgRNA靶向敲除p53基因,构建U2OS CRISPR对照细胞株(U2OS CRISPR Ctrl)和U2OS CRISPR p53 Knockout细胞株(U2OS CRISPR p53 KO)。将浓度为5 μmol/L的FTY720药物作用于U2OS CRISPR Ctrl和U2OS CRISPR p53 KO于24 h,进行后续检测。
1.2.2 RT-qPCR检测细胞中p53 mRNA水平:将构建的U2OS CRISPR Ctrl和U2OS CRISPR p53 KO细胞用1 mL Trizol®试剂收集,室温裂解5 min,加入200 μL氯仿,快速混匀30 s后,于4 ℃ 15 000 r/min离心15 min。取400 μL上层清液于无RNase的1.5 mL 离心管中,加入相同体积的异丙醇上下颠倒混匀后室温沉淀RNA 10 min后,在4 ℃ 15 000 r/min离心10 min,去掉上层清液后用75%异丙醇清洗RNA沉淀,4 ℃ 15 000 r/min离心5 min,除去上清,晾干RNA沉淀。用适量无RNase的H2O重悬RNA沉淀。用SuperScriptTMIV VILOTMMaster Mix将1 μg总RNA按说明书操作反转录得到互补DNA (complementary DNA,cDNA)。TP53上游引物为5′-AGCCCCCTCTGA GTCAGGAA-3′,下游引物为5′-GGGTCTTCAGTGAAC CATTGTTC-3′。以B2M作为内参,在real-time PCR系统采用SYBR Green法按说明书操作测定各基因的相对表达量。
1.2.3 Western blot检测细胞内蛋白质表达水平:收集对照组及用FTY720 5 μmol/L处理24 h的实验组U2OS CRISPR Ctrl和U2OS CRISPR p53 KO细胞,用NP40裂解液在冰上裂解30 min后,在4 ℃ 15 000 r/min离心15 min,收集上清液,蛋白定量后95 ℃变性5 min,用SDS-PAGE分离后转入硝化纤维素膜。膜用5 %的脱脂牛奶封闭,然后孵育一抗,用TBST缓冲液清洗3次,孵育二抗,用TBST缓冲液清洗3次。最后将膜与ECL孵育并进行曝光。
1.2.4 RNA-sequencing样品制备:将对照组及用FTY720 5 μmol/L处理24 h实验组的U2OS CRISPR ctr和U2OS CRISPR p53 KO细胞,用无RNase的PBS清洗后,加入1 mL Trizol®试剂,提取RNA(同上步骤)。
1.3 统计学分析

2 结果
2.1 U2OS CRISPR/Cas9 p53 KO细胞内p53的mRNA和蛋白质水平显著缺失
在U2OS细胞敲除p53基因,构建U2OS CRISPR/Cas9 p53 KO细胞株(图1A)。p53 KO组中p53 mRNA表达水平与p53 WT组相比显著下降(P<0.001)(图1B);p53 KO组中p53蛋白质表达水平与p53 WT相比显著缺失(图1C)。
2.2 FTY720作用后细胞内磷酸化AKT蛋白的水平明显降低
U2OS CRISPR Ctrl组和U2OS CRISPR p53 KO组在FTY720作用后磷酸化AKT的表达水平均显著降低(图2)。
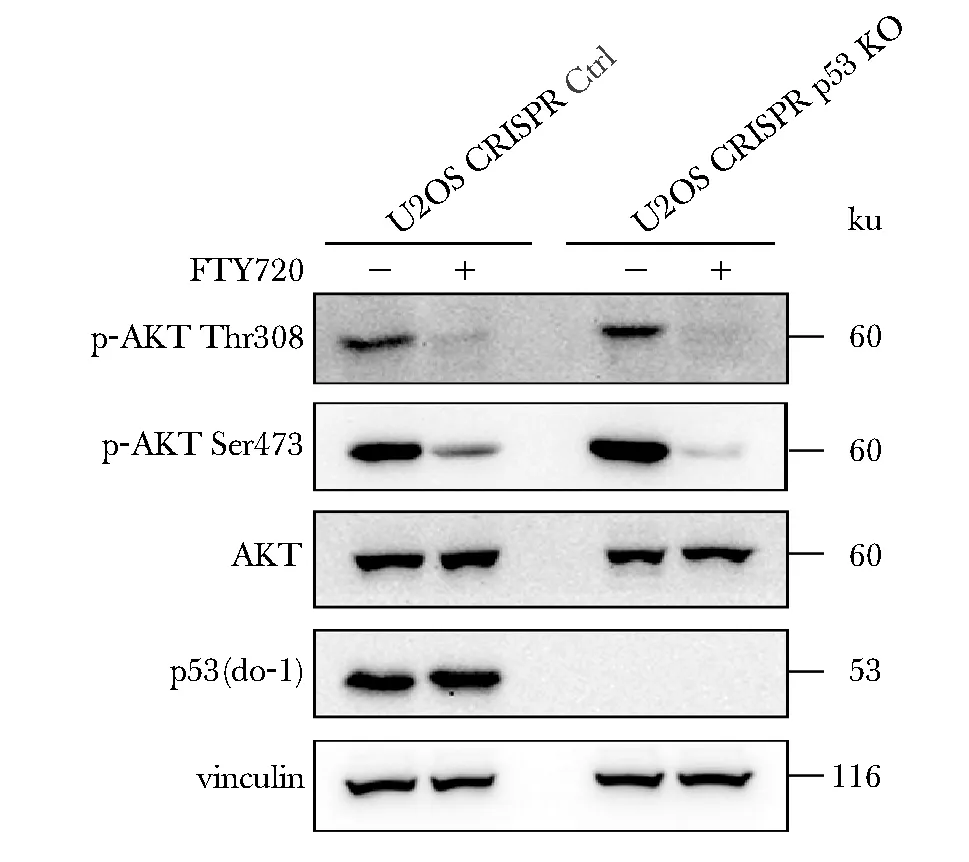
图2 FTY720作用24 h后U2OS CRISPR Ctrland U2OS CRISPR p53 KO细胞内磷酸化AKT蛋白的表达Fig 2 Phosphorylated AKT protein in U2OS CRISPR Ctrl and U2OS CRISPR p53 KO cells after 24 hours of FTY720
2.3 筛选p53依赖的差异表达基因
对RNA-seq样本进行测序分析(图3A),在U2OS CRISPR Ctrl组筛选出了270个差异表达基因(图3B),其中158个基因上调,112个基因下调(图3C,D);在U2OS CRISPR p53 KO组中筛选出了163个差异表达基因(图3B),其中117个基因上调,46个基因下调(图3C,D)。而U2OS CRISPR Ctrl和U2OS CRISPR p53 KO两组之间的差异表达分析筛选出了220个p53依赖的差异表达基因(图3B)。
2.4 p53依赖的差异表达基因的生物学功能分析
对220个p53依赖的差异表达基因进行GO分析,这些基因主要富集在温度稳态调控、血小板活化负调控、细胞趋化因子反应、Rho蛋白信号传导正调控和多细胞生物体内平衡等生物学过程(图4A)。
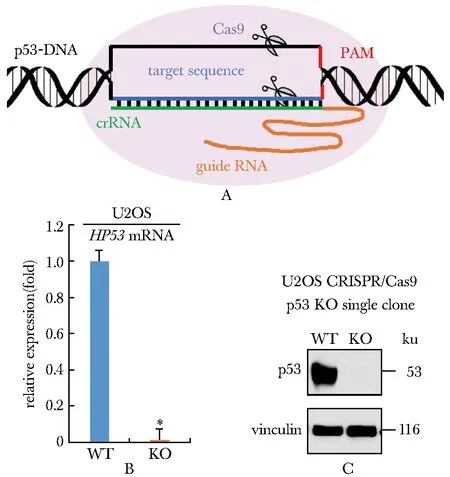
A.schematic diagram of CRISPR/Cas9;B.mRNA level of p53;C.expression of p53 protein;*P<0.001 compared with WT group图1 U2OS细胞中p53 mRNA水平(B)和p53蛋白的表达(C)Fig 1 p53 mRNA level and expression of p53 protein
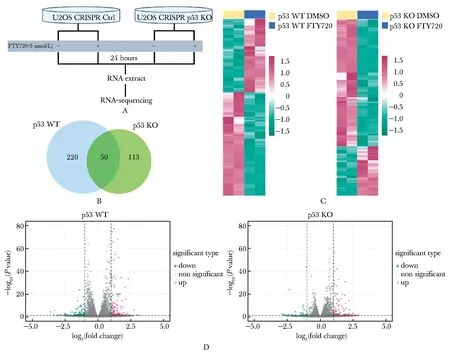
A.flow chart of RNA-sequencing sample preparation;B.Venn diagram;C.heat map;D.volcano plots图3 RNA-sequencing筛选FTY720作用U2OS细胞后p53依赖的差异表达基因Fig 3 p53-dependent differentially expressed genes in U2OS cells treated with FTY720 by RNA-sequencing
在KEGG分析中这些基因则主要富集在血小板活化、黏蛋白型O-聚糖生物合成、细胞外基质(extracellular matrix,ECM)-受体相互作用、病毒蛋白与细胞因子和细胞因子受体的相互作用、糖尿病并发症中的糖基化终未产物及其受体[advanced glycation end products and its receptor(receptor for AGE),AGE-RAGE]信号通路、趋化因子等信号通路(图4B)。
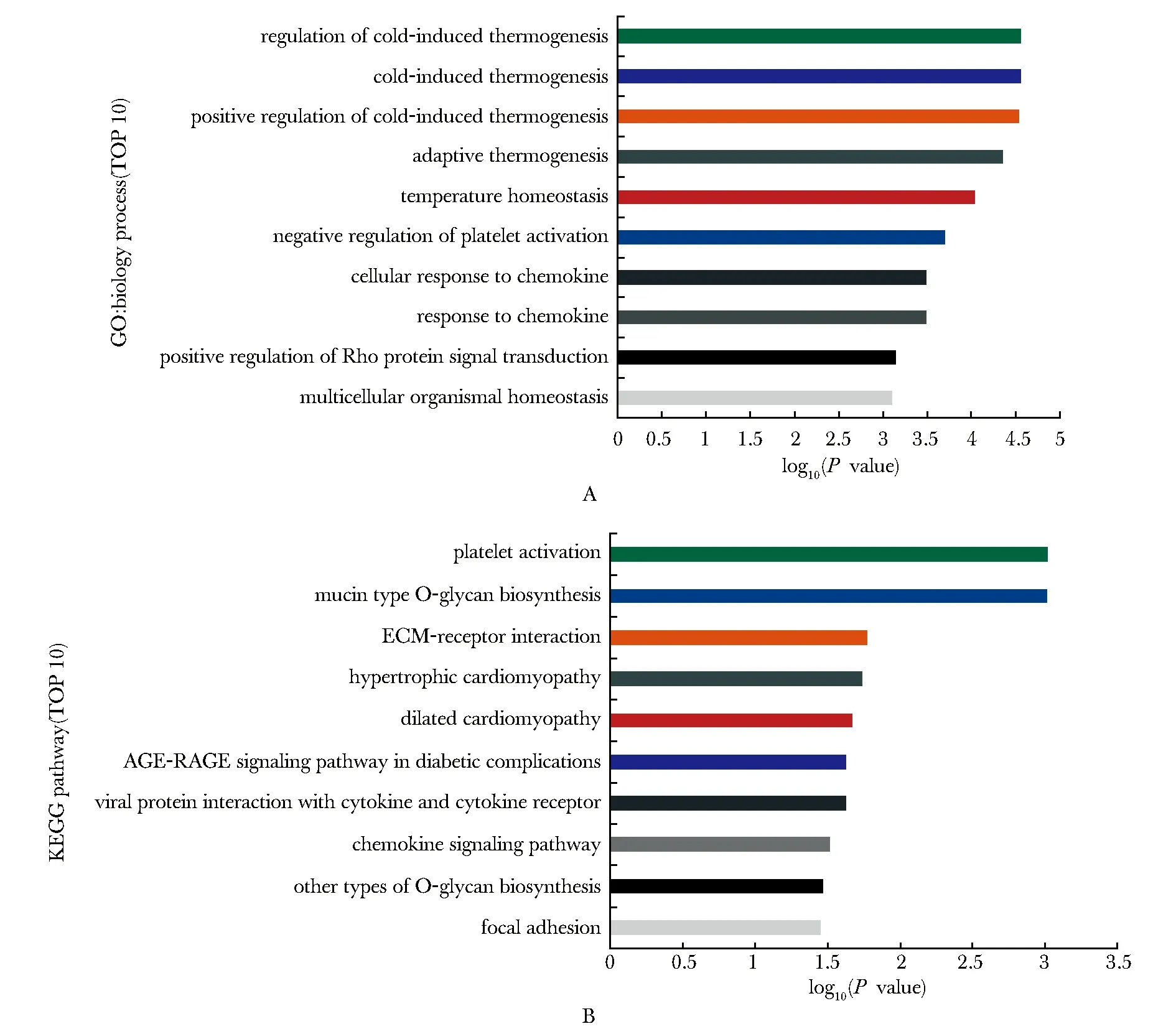
图4 p53依赖的差异表达基因的GO富集分析(A)和KEGG通路分析(B)Fig 4 GO enrichment analysis(A) and KEGG pathway analysis (B) of p53-dependent differentially expressed genes(n=220)
2.5 p53依赖的差异表达基因PDGFRA和CCL20的mRNA水平
参与血小板活化生物学过程的基因PDGFRA在U2OS 细胞中p53 WT组与p53 KO组相比,p53 WT组下调PDGFRAmRNA的水平(图5A)。同时,在另一种人骨肉瘤细胞SJSA-1中p53 WT组的PDGFRAmRNA水平也下调(图5A)。参与趋化因子反应生物学过程的基因CCL20在U2OS 细胞中p53 WT组与p53 KO组相比,p53 WT组上调CCL20mRNA的水平(图5B)。同时,在另一种人骨肉瘤细胞SJSA-1中p53 WT组的CCL20mRNA水平也上调(图5B)。
3 讨论
FTY720可以通过干扰SET和PP2Ac之间的相互作用,激活PP2A的磷酸酶活性,抑制下游AKT信号通路[6]。这与本实验观察到的结果一致,即通过给予抗肿瘤药物FTY720处理,U2OS CRISPR Ctrl和U2OS CRISPR p53 KO两者的磷酸化AKT蛋白表达均下降。
FTY720抗肿瘤药物作用下p53依赖的差异表达基因有220个,包括血小板活化负调控基因NOS3、PDGFRA和PRKG1等;趋化因子反应基因CCL20/26/4、RIPOR2和SLIT3等;Rho蛋白信号传导的正调控基因COL3A1、GPR20和SYNPO2L等。其中与本实验观察到的有一些基因与报道一致。例如:CCL20基因是一种趋化因子配体,CCL20可以与其相应的受体结合,招募体内中性粒细胞等最终触发免疫反应[7];CXCL8基因可以通过细胞内的MAPK信号通路来抑制TLR(Toll like receptor)介导的CXCL8分泌[8];BMP基因翻译的蛋白是一种骨形态发生蛋白,可诱导成骨分化[9];PDGFRA基因在血小板活化过程中起着负调节的作用。
p53依赖的差异表达基因参与血小板活化、细胞趋化因子反应、Rho蛋白信号传导调控、黏蛋白型O-聚糖生物合成、ECM-受体相互作用、糖尿病并发症中AGE-RAGE等信号通路等生物学过程,这些都是一些“非经典”(non-cononical)的p53下游靶基因和相关生物学过程。这提示FTY720对p53调控具有“选择性”,这种“选择性”作用显著富集于血小板活化和细胞趋化因子反应两个生物学过程。参与这两个生物学过程的基因调控作用在本实验中通过两种人骨肉瘤细胞系得到了验证。有报道,在肿瘤组织中,血小板活化会选择性的释放多种含有血管生成促进因子的颗粒来促进血管生成,从而促进肿瘤转移[10]。而趋化因子在肿瘤发生和发展过程中具有有关键作用,比如当CCL5和CXCL9同时存在于肿瘤组织中时,可引起CD8+T细胞浸入肿瘤细胞来诱发T细胞介导的免疫反应[11]。这提示靶向血小板活化的基因可能成为肿瘤治疗的新靶点;干预细胞趋化因子反应的基因可能通过p53介导抑制肿瘤生长和转移实现肿瘤免疫治疗,为免疫检查点的治疗提供新的思路。
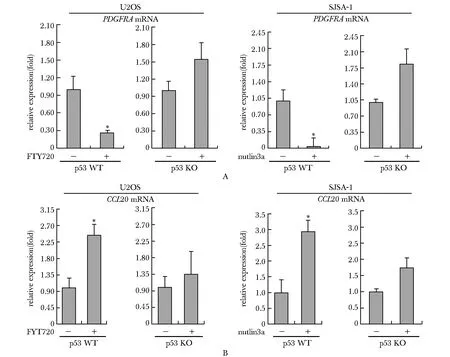
A.mRNA level of PDGFRA;b.mRNA level of CCL20;*P<0.05 compared with p53 WT group图5 功能富集分析中排名前10的基因(PDGFRA,CCL20)的表达Fig 5 Expression of top 10 genes (PDGFRA and CCL20) in functional enrichment analysis of differentially
本研究通过转录组测序RNA-seq分析和生物信息分析,揭示了FTY720参与p53依赖的基因转录调控并选择性调节非经典的p53依赖的生物学过程,提示p53的激活可能在FTY720抑制肿瘤进展的过程中起到一定作用。但p53是如何在FTY720抑癌过程中发挥作用的有待于进一步研究。

