新型苄叉丙酮曼尼希碱缓蚀剂的合成及其缓蚀性能研究
乔梦娇,李克华,胡闪,石东坡
(长江大学化学与环境工程学院,湖北 荆州 434023)
油井酸化是增加输油流动的重要技术[1]。但酸液会对石油管线造成严重的腐蚀,造成严重的经济损失和安全隐患[2]。使用缓蚀剂是防止金属在酸性介质中腐蚀的最有效方法之一。就分子结构而言,分子中同时含N和S的一类化合物比仅含单个的N或S的一类化合物具有更好的缓蚀性能[2-4]。苄叉丙酮中的双键与苯环共轭,具有更大离域π电子[5]。氨基硫脲中既含有硫代碳酰键又含有N原子,可以提供孤对电子与金属表面形成配位键,吸附在金属表面,减缓金属腐蚀。现有曼尼希碱缓蚀剂大多只含有π键或N原子,尚未见分子结构中同时含有π键和S原子的曼尼希碱作为酸化缓蚀剂的研究报道。本工作采用苄叉丙酮、苯甲醛和氨基硫脲为原料合成曼尼希碱缓蚀剂。通过静态失重法、电化学方法和分子模拟方法研究了该缓蚀剂在酸性介质中对N80钢的缓蚀行为。
1 实 验
1.1 主要试剂和仪器
苄叉丙酮、苯甲醛、氨基硫脲等,均为分析纯;标准N80钢。
CHI600E型电化学工作站,NICO-LET6700型红外光谱仪。
1.2 缓蚀剂合成
将一定量的苯甲醛、氨基硫脲、苄叉丙酮依次加入圆底烧瓶中,加入一定量的无水乙醇作溶剂,滴加盐酸调节溶液的pH值,放入恒温水浴锅中在给定温度下搅拌加热回流一段时间,得到缓蚀剂溶液。冷却并进行减压蒸馏得到粗产品,用无水乙醇重结晶提纯。

1.3 缓蚀性能评价
1.3.1 静态失重法
参照文献[6]方法对曼尼希缓蚀剂进行性能评价。使用式(1)计算其腐蚀速率(v),式(2)计算其缓蚀率(η)。
(1)
(2)
收稿日期:2020-12-20;修改稿收到日期:2021-02-25。
作者简介:乔梦娇(1997-),女,硕士在读,研究方向为金属腐蚀与防护。E-mail:1807313506@qq.com。
基金项目:湖北省教育厅科学技术研究项目(B2016445)。
*通信联系人,E-mail:cd@yangtzeu.edu.cn。
式中:m1为碳钢片腐蚀前的质量,g;m2为钢片腐蚀后除去腐蚀产物的质量,g;A为碳钢片腐蚀介质中的总面积,mm2;t为腐蚀时间,h;v0,v1分别为添加缓蚀剂前后的腐蚀速率(g/(m2·h))。
1.3.2 电化学测试法
在常规三电极电池体系[7]中使用CHI600E型电化学工作站进行测试:铂电极用作辅助电极,饱和甘汞电极(SCE)用作参比电极,工作电极由N80钢加工而成。室温下测量,极化曲线测试扫描为-800~-200 mV(相对于开路电位),电位扫描速率为5 mV/s,电化学阻抗测量频率范围为0.1~100 kHz,交流激励信号幅值为5 mV[8]。
1.3.3 分子动力学模拟
分子模拟是从物理模型出发,定义明确的物理条件,由体系分子的微观性质求其宏观性质[9]。实验采用Materials Studio 8.0软件COMPASS力场对体系进行优化,正则系综(NVT)的MD模拟通过Forcite模块完成。选用Fe的(001)晶面为吸附表面进行模拟。吸附能是缓蚀剂在金属表面结合强度的一个重要体现,吸附能通过式(3)计算:
Ead=Et-(Em+Es)
(3)
式中:Ead为吸附能,Em为自由分子总能量,Es为未吸附分子的晶束表面能量,Et为金属表面体系和分子的总能量。
2 结果与讨论
2.1 合成条件的优化
选取反应的醛胺摩尔比、酮胺摩尔比、pH、反应时间和反应温度为考察因素,采用L16(45)正交实验对缓蚀剂的合成进行优化,因素水平见表1,正交实验结果见表2。
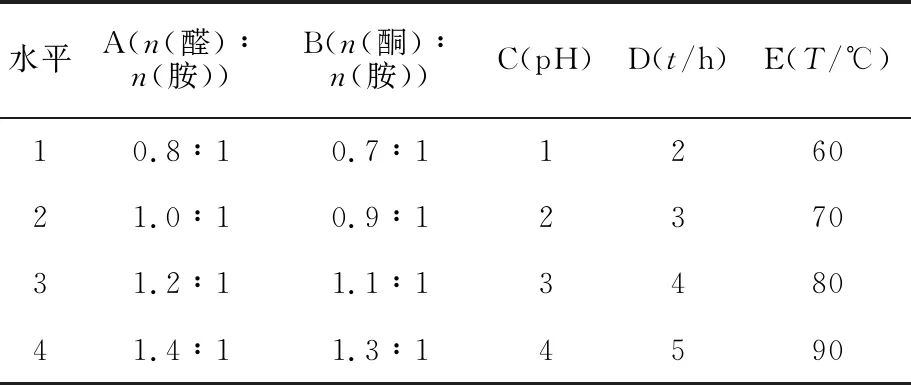
表1 正交实验设计的因素及水平
由表2可知,对缓蚀剂缓蚀性能影响顺序为:pH>醛胺摩尔比>反应时间>反应温度>酮胺摩尔比,合成反应的最佳条件为A2B3C1D4E4,即:n(醛)∶n(胺)=1.0∶1,n(醛)∶n(胺)=1.1∶1,pH=1,t=5 h,T=90 ℃。在此条件下重复3次合成曼尼希碱,测得其对N80钢试片的腐蚀速率平均值为1.156 1 g/(m2·h),稍差于实验6得出的缓蚀剂,因此使用实验6条件下合成的缓蚀剂进行后续性能评价。

表2 正交实验结果
2.2 合成产物的表征
图1是产物的红外光谱(kBr压片法)。

图1 产物的红外光谱
由图1可以看出,在3 233、3 146 cm-1处为N—H伸缩振动峰;在1 603 cm-1处出现了—C=O的吸收峰,羰基向低波数移动是由于羰基与烯键共轭;在1 530 cm-1处为N—H变形振动吸收峰;在1 285 cm-1处为C=S伸缩振动吸收峰;在1 098 cm-1处为C—N伸缩振动吸收峰;816、547 cm-1处出现了苯环的弯曲振动双峰。由以上分析可知,合成产物符合目标产物结构。
2.3 失重法测试结果
2.3.1 缓蚀剂加量对缓蚀性能的影响
在10%盐酸溶液加入不同量的曼尼希碱缓蚀剂,在60 ℃、常压条件下反应4 h之后测定N80钢的腐蚀速率,结果见图2。

图2 不同缓蚀剂加量下N80钢的腐蚀速率
由图2可以看出,随着缓蚀剂量的增加,N80钢的腐蚀速率下降,说明缓蚀剂能够起到抑制腐蚀的作用。当缓蚀剂加量为1%时,腐蚀速率为0.747 1 g/(m2·h),缓蚀率达到98%以上,缓蚀性能优异。
2.3.2 盐酸浓度对缓蚀性能的影响
图3为不同盐酸浓度下添加1%缓蚀剂,在60 ℃、常压条件下反应4 h后N80钢的腐蚀速率。

图3 不同盐酸浓度下N80钢的腐蚀速率
由图3可知,随着盐酸浓度的增加,金属的腐蚀速率增大。随着盐酸浓度的增加,金属在金属表面的生成速度增加,从而增加了金属离子向溶液中扩散的速度,缓蚀剂难以在金属表面形成致密吸附膜,因此腐蚀速率加快[13]。
2.3.3 温度对缓蚀性能的影响
在不同温度、常压条件下,在10%盐酸溶液中加入1%缓蚀剂反应4 h后测定N80钢的腐蚀速率,结果见图4。

图4 不同温度下N80钢的腐蚀速率
由图4可知,随着温度的升高,腐蚀速率升高,主要因为温度升高,腐蚀反应的速率也在升高,影响缓蚀剂在钢片表面的吸附。
2.4 电化学分析结果
2.4.1 极化曲线分析
图5显示了在常温下在10%HCl中不存在和存在不同浓度缓蚀剂的情况下的极化曲线。通过极化曲线外推得到的电化学参数例如阴极和阳极Tafel斜率(bc,ba),极化电阻R,腐蚀电流密度(Icorr),腐蚀电位(Ecorr),以及缓蚀率见表3。
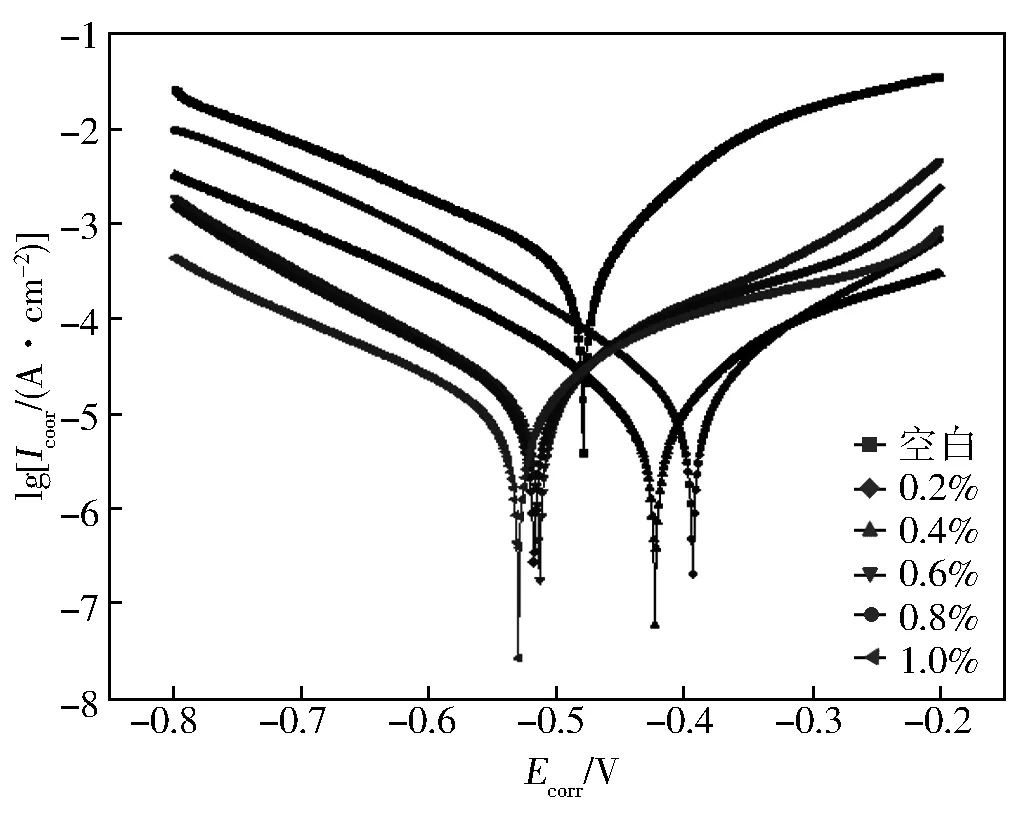
图5 不同缓蚀剂加量下N80钢的极化曲线
由图5可以看出,当溶液中缓蚀剂浓度增加时,腐蚀电流密度降低,因此缓蚀剂对腐蚀过程的电极反应有抑制作用,从而使腐蚀反应的速率降低。平行的阴极Tafel线表明,添加缓蚀剂不会改变N80钢表面H+的还原机制,这主要是通过电荷转移机制引起的[10]。当缓蚀剂的浓度增加时,阳极和阴极Tafel斜率(ba,bc)的值都会略有变化,这表明缓蚀剂的加入会降低N80钢的阳极溶解并延迟阴极氢的析出反应,而不会影响反应机理[11],该缓蚀剂为混合型缓蚀剂。从表3可以看出,缓蚀效率随缓蚀剂浓度的增加而提高,这是由于吸附作用对表面的阻断作用所致。
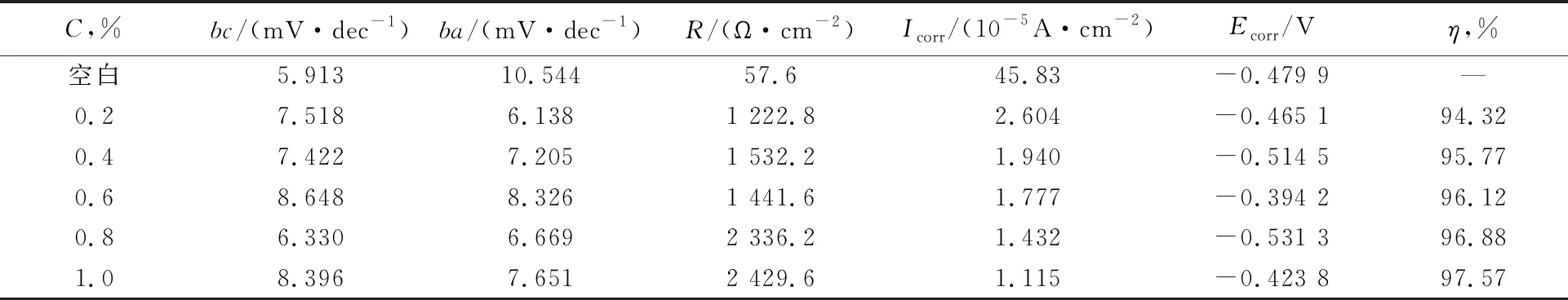
表3 N80钢在不同缓蚀剂加量下的电化学参数
2.4.2 交流阻抗分析
常温下N80钢在10%HCl中不同缓蚀剂浓度中的化学阻抗谱图见图6,图7为等效拟合电路图,使用Zview对测试结果进行拟合,结果见表4。
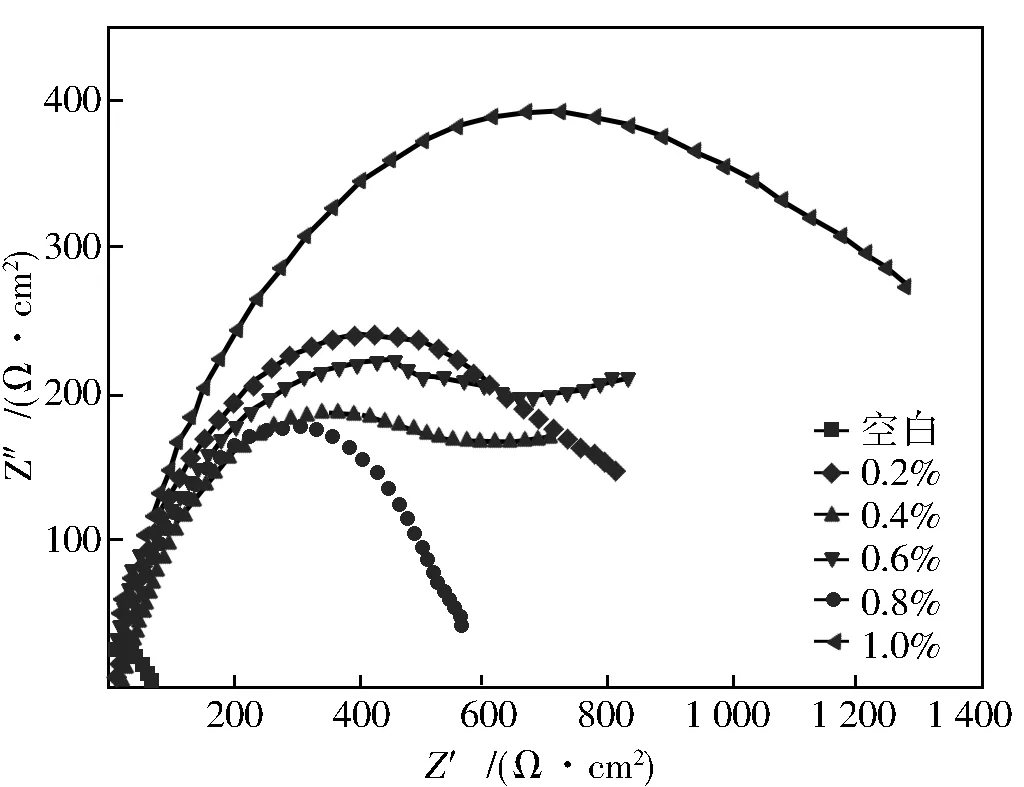
图6 不同缓蚀剂加量下N80钢的Nyquist曲线
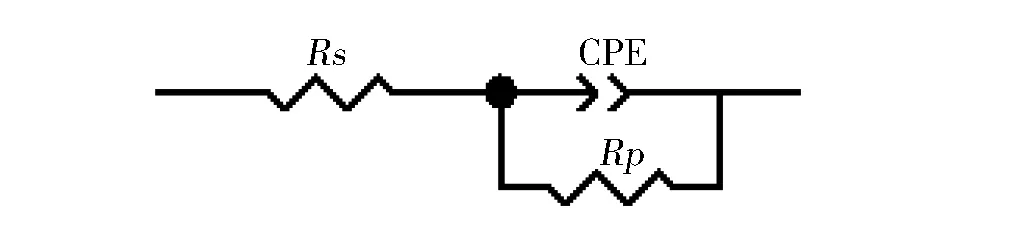
图7 电化学阻抗谱等效电路图
由图6和表4可知,N80钢的能奎斯特图表现为一个凹陷的半圆,其直径随着缓蚀剂浓度的增加而增加,直径的增加是由于缓蚀剂分子吸附到金属表面上导致腐蚀速率降低。另外,这些奈奎斯特图不是完美的半圆,这种偏离完美圆形的现象通常被称为界面阻抗的频散[12]。这种现象通常归因于金属表面粗糙度或界面现象而产生的不均匀性。

表4 腐蚀过程中交流阻抗拟合参数
2.5 吸附机理分析
2.5.1 缓蚀剂的吸附性能
在60 ℃条件下用静态失重法测得的缓蚀剂的缓蚀率。结果如图8所示。

图8 不同缓蚀剂加量下N80钢的腐蚀速率
通常情况下,吸附粒子的表面覆盖度θ近似等于缓蚀率η[13],因此将θ=η代入各种吸附等温线(Bockris-Swinkels[14],Frumkin[15]和Langmuir[16]等温线)。发现Langmuir吸附等温线是最合适的,可以通过公式(4)给出:
(4)
式中:Kad为Langmuir吸附平衡常数,c为缓蚀剂浓度。以c/θ为纵坐标,c为横坐标作图得图9。
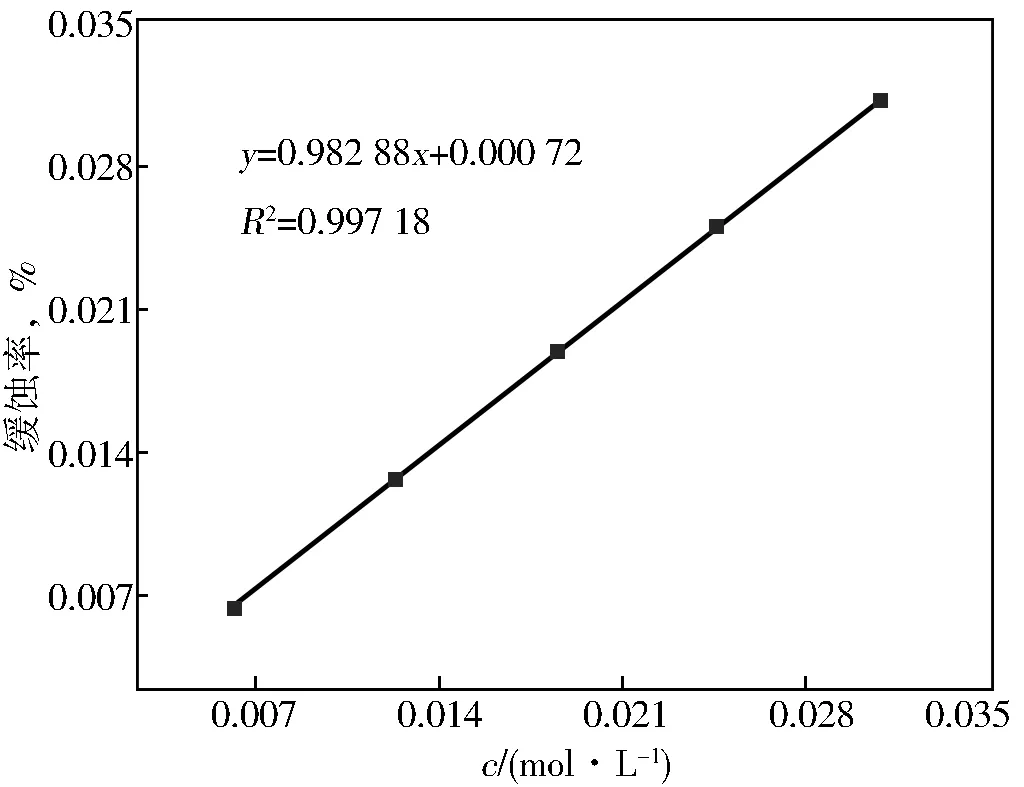
图9 缓蚀剂在N80钢片的吸附等温线
由图8可计算Kad,从而可以根据式(5)计算反应的吉布斯自由能ΔGad,计算结果见表5。
(5)
式中:Cso为溶剂水的摩尔浓度,取值55.5 mol/L;R是理想气体常数,8.314 J/(mol·K);T为热力学温度,K。

表5 吸附过程的热力学参数
由图9可知,线性相关系数为0.997 18,表明该缓蚀剂在金属表面的吸附符合Langmuir吸附等温线,即该缓蚀剂在N80钢表面呈单分子层吸附,从而起到缓蚀作用。从表5可以看出,ΔGad<0且其绝对值处于20~40 kJ/mol之间,所以吸附过程自发且为物理化学吸附。
2.5.2 分子动力学模拟结果
缓蚀剂在Fe(001)晶面的吸附构型见图10,吸附能参数见表6。
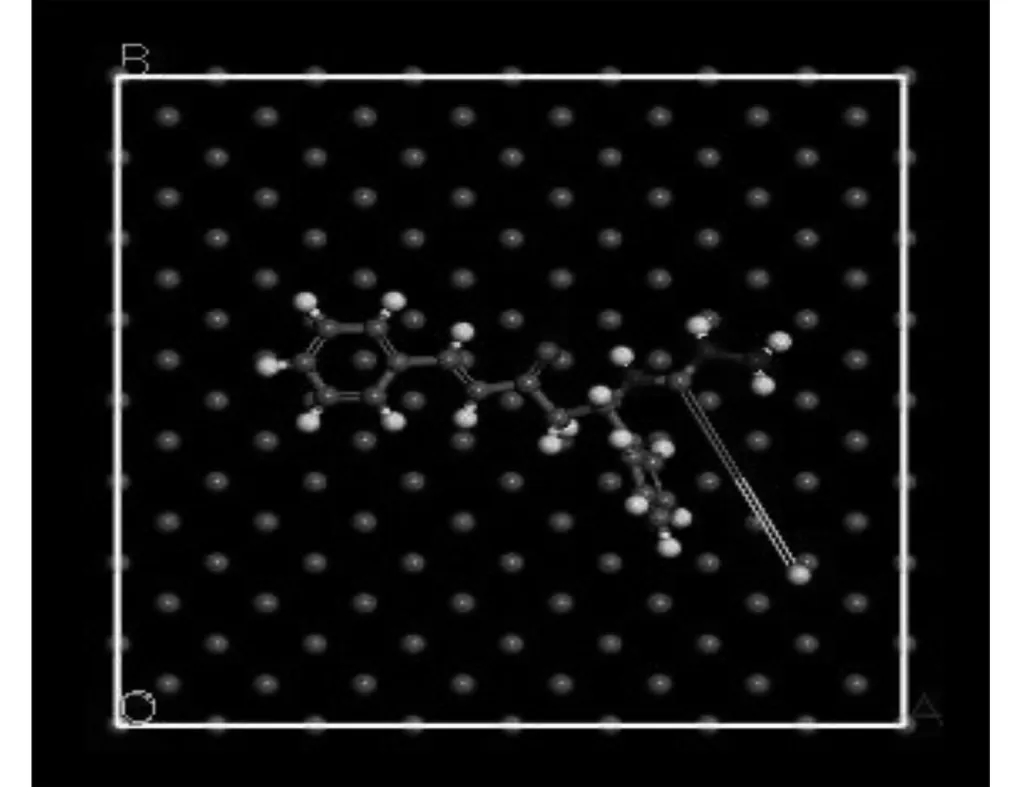
图10 缓蚀剂分子在Fe(001)晶面的平衡吸附构型

表6 缓蚀剂分子与Fe(001)面的吸附能 kJ/mol
由图10可以看出,缓蚀剂分子平行地吸附在Fe(001)的表面上。缓蚀剂分子中的氮、氧、硫原子上存在的孤对电子,芳环中的π轨道与Fe表面的空d轨道之间形成配位键而吸附在金属表面。这种平行的吸附方式有利于缓蚀剂分子与金属表面形成覆盖率更大且致密的分子膜,从而抑制金属的腐蚀。从表6可以看出,在真空条件下,H2O分子和缓蚀剂分子与Fe(001)晶面的吸附能均小于0,表明缓蚀剂分子可以自发的吸附于Fe(001)晶面上。缓蚀剂分子与Fe(001)晶面间的吸附能绝对值大于H2O分子与Fe(001)晶面间的吸附能绝对值,表明缓蚀剂与金属表面的结合强度更大,能驱逐吸附在Fe(001)表面的H2O分子,从而起到保护金属的作用。
3 结 论
a.以苄叉丙酮、苯甲醛和氨基硫脲为主要原料合成了一种新型苄叉丙酮曼尼希碱缓蚀剂,在温度为60 ℃,质量分数为10%的盐酸体系中缓蚀剂添加量为1%时,酸液对N80钢试片的腐蚀速率降为0.747 1 g/(m2·h),低于SY/T5405—1996中的一级标准。缓蚀剂表现出了优异的缓蚀性能,显示出良好的工业应用前景,进一步丰富了缓蚀剂品种。
b.电化学测试结果表明,该缓蚀剂为混合型缓蚀剂,腐蚀电流随着缓蚀剂在溶液中浓度的增加而减小;缓蚀剂在N80钢上的吸附服从Langmuir吸附等温模型。
c.分子动力学模拟结果表明,缓蚀剂分子中芳环、N、S、O与Fe(001)表面形成多个吸附中心,形成更致密的分子膜。缓蚀剂分子可以驱走H2O分子,隔开腐蚀介质与金属表面,从而起到缓蚀作用。

